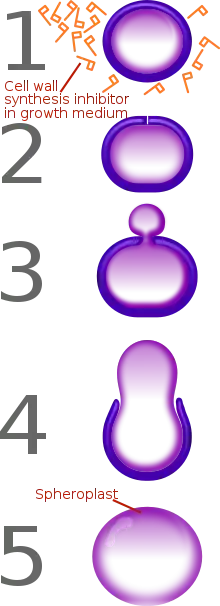Сферопласт
Сферопласт — це мікробна клітина з майже або повністю зруйнованою (редукованою) клітинною стінкою в результаті дії на неї пеніциліну або лізоциму. Найчастіше цей термін використовується для опису грам-негативних бактерій[3][4]. Згідно з деякими визначеннями, цей термін також охоплює дріжджі.[5][6] Назва сферопласту походить від його особливої сферичної форми, яка з'являється після того, як клітинна стінка мікроба перетравлюється, змінюючи натяг.[4] Сферопласти є осмотично крихкими та піддаються лізису, якщо їх перенести в гіпотонічний розчин, а тому характеризується поганою стійкістю до змін осмотичного тиску.[5]
У випадку використання терміну для опису грам-негатичних бактерій, він застосовується для характеристики клітин, з яких був видалений пептидоглікановий компонент.[5][1]
Формування сферопластів
Сферопласти індуковані антибіотиками
Деякі антибіотики здатні перетворювати грам-негативних бактерій на сферопласти. До них відносяться інгібітори синтезу пептидоглікану, такі як фосфоміцин, ванкоміцин, моеноміцин, лактивіцин та β-лактамні антибіотики.[1][2] Антибіотики, що інгібують біохімічні шляхи безпосередньо перед синтезом пептидоглікану також індукують сферопласти (наприклад, фосмідоміцин, фосфоенолпіруват).[1] [2]Крім вище вказаних антибіотиків, інгібітори синтезу білків (наприклад, хлорамфенікол, окситетрациклін, деякі аміноглікозиди) та інгібітори синтезу фолієвої кислоти (приклад, триметоприм, сульфаметоксазол) також викликають утворення сферопластів з грам-негативних бактерій[2].
Фермент-індуковані сферопласти
Фермент лізоцим змушує грам-негативні бактерії утворювати сферопласти, але тільки у випадку, якщо для полегшення проходження ферменту через зовнішню мембрану використовується мембранний пермеабілізатор, такий як лактоферин або етилендіамінтетраацетат (EDTA).[2][7] EDTA діє як стабілізатор проникності, зв'язуючись з двовалентними іонами Ca2+, він видаляє їх із зовнішньої мембрани.[8]
Дріжджі Candida albicans можна перетворити у сферопласти за допомогою ферментів літикази, хітинази та β-глюкуронідази.[9]
Використання та застосування
Відкриття антибіотиків
З 1960-х до 1990-х років компанія Merck and Co. використовувала сферопластовий екран, як основний метод для виявлення антибіотиків, що пригнічують біосинтез клітинної стінки. На цьому екрані, розробленому Юджином Дюлейні, бактерії, що росли, піддавалися впливу досліджуваних речовин у гіпертонічних умовах. Інгібітори синтезу клітинної стінки змушували зростаючі бактерії утворювати сферопласти. Цей метод дозволив виявити фосфоміцин, цефаміцин С, тієнаміцин та декілька карбапенемів.[1]
Patch clamping
Спеціально підготовлені гігантські сферопласти грам-негативних бактерій можна використовувати для вивчення функції бактеріальних іонних каналів за допомогою методики під назвою patch-clamp, яка від початку була розроблена для характеристики поведінки нейронів та інших збудливих клітин. Для утворення гігантських сферопластів бактерії обробляють інгібітором септації (наприклад, цефалексином). Це змушує бактерії утворювати ниткоподібні, подовжені клітини, у яких відсутні внутрішні поперечні стінки.[10] Через деякий час клітинні стінки філаментів перетравлюються, і бактерії руйнуються на дуже великі сфери, що оточені лише їх цитоплазматичною та зовнішньою мембранами. Потім мембрани можуть бути проаналізовані на пристрої для визначення фенотипу вбудованих в них іонних каналів. Також поширено, при експерименті, зустрічається надмірне вираження певного одного каналу, з метою посилення його ефекту та полегшення визначення характеристик.
Методика фіксації гігантських сферопластів E. coli була використана для вивчення нативних механочутливих каналів (MscL, MscS і MscM) E. coli.[11][12] Його було розширено для вивчення інших гетерологічно експресованих іонних каналів та продемостровано, що гігантський сферопласт E.coli можна використовувати як систему експресії іонних каналів, на рівні з ооцитами Xenopus.[13][14][15][16]
Лізис клітин
Клітини дріжджів зазвичай захищені товстою клітинною стінкою, що ускладнює вилучення з них клітинних білків. Ферментативне розщеплення клітинної стінки за допомогою зимоліази, з утворенням сферопластів, робить клітини вразливими до легкого лізису за допомогою детергентів або швидких змін осмолярного тиску.[9]
Трансфекція
Бактеріальні сферопласти з відповідною рекомбінантною ДНК, вставленою в них, можна використовувати для трансфекції клітин тварин. Сферопласти з рекомбінантною ДНК вводяться в середовище, що містить в собі тваринні клітини, та зливаються за допомогою поліетиленгліколю (ПЕГ). При використанні цього методу майже 100 % тваринних клітин можуть поглинати чужорідну ДНК.[17] Після проведення експериментів за модифікованим протоколом Ханахана з використанням хлориду кальцію в E.coli було встановлено, що сферопласти можуть трансформуватися при 4,9x10−4.[18]
Примітки
- Silver, Lynn L. (2012). У Dougherty, Thomas J.; Pucci, Michael J. Rational Approaches to Antibacterial Discovery: Pre-Genomic Directed and Phenotypic Screening. Antibiotic Discovery and Development (англ.). Boston, MA: Springer US. с. 33–75. ISBN 978-1-4614-1399-8. doi:10.1007/978-1-4614-1400-1_2.
- Cushnie, T. P. Tim; O’Driscoll, Noëlle H.; Lamb, Andrew J. (2016-12). Morphological and ultrastructural changes in bacterial cells as an indicator of antibacterial mechanism of action. Cellular and Molecular Life Sciences (англ.) 73 (23). с. 4471–4492. ISSN 1420-682X. doi:10.1007/s00018-016-2302-2. Процитовано 4 грудня 2021.
- Dictionary.com Is The World’s Favorite Online Dictionary. Dictionary.com (англ.). Процитовано 4 грудня 2021.
- Company, Houghton Mifflin Harcourt Publishing. The American Heritage Dictionary entry: spheroplast. ahdictionary.com. Процитовано 4 грудня 2021.
- Protoplasts and Spheroplasts | Encyclopedia.com. www.encyclopedia.com. Процитовано 4 грудня 2021.
- Definition of SPHEROPLAST. www.merriam-webster.com (англ.). Процитовано 4 грудня 2021.
- Funke, Berdell R.; Case, Christine L. (2016). Microbiology : an introduction (вид. Twelfth edition). Boston. ISBN 978-0-321-92915-0. OCLC 892055958.
- Ballou, David P.; Benore, Marilee (2010). Fundamental laboratory approaches for biochemistry and biotechnology (вид. 2nd ed). Hoboken, NJ: John Wiley. ISBN 978-0-470-08766-4. OCLC 420027217.
- Calvert, Caroline M.; Sanders, Dale (1995-03). Inositol Trisphosphate-dependent and -independent Ca2+ Mobilization Pathways at the Vacuolar Membrane of Candida albicans. Journal of Biological Chemistry (англ.) 270 (13). с. 7272–7280. doi:10.1074/jbc.270.13.7272. Процитовано 4 грудня 2021.
- Kikuchi, Kyoko; Sugiura, Mika; Nishizawa-Harada, Chizuko; Kimura, Tadashi (2015-09). The application of the Escherichia coli giant spheroplast for drug screening with automated planar patch clamp system. Biotechnology Reports (англ.) 7. с. 17–23. doi:10.1016/j.btre.2015.04.007. Процитовано 4 грудня 2021.
- Martinac, B.; Buechner, M.; Delcour, A. H.; Adler, J.; Kung, C. (1 квітня 1987). Pressure-sensitive ion channel in Escherichia coli.. Proceedings of the National Academy of Sciences (англ.) 84 (8). с. 2297–2301. ISSN 0027-8424. PMC PMC304637. PMID 2436228. doi:10.1073/pnas.84.8.2297. Процитовано 4 грудня 2021.
- Blount, Paul; Sukharev, Sergei I.; Moe, Paul C.; Martinac, Boris; Kung, Ching (1999). [24] Mechanosensitive channels of bacteria. Methods in Enzymology (англ.) 294. Elsevier. с. 458–482. ISBN 978-0-12-182195-1. doi:10.1016/s0076-6879(99)94027-2.
- Santos, Jose S.; Lundby, Alicia; Zazueta, Cecilia; Montal, Mauricio (1 вересня 2006). Molecular Template for a Voltage Sensor in a Novel K+ Channel. I. Identification and Functional Characterization of KvLm, a Voltage-gated K+ Channel from Listeria monocytogenes. Journal of General Physiology (англ.) 128 (3). с. 283–292. ISSN 1540-7748. PMC PMC2151562. PMID 16908725. doi:10.1085/jgp.200609572. Процитовано 4 грудня 2021.
- Nakayama, Y.; Fujiu, K.; Sokabe, M.; Yoshimura, K. (3 квітня 2007). Molecular and electrophysiological characterization of a mechanosensitive channel expressed in the chloroplasts of Chlamydomonas. Proceedings of the National Academy of Sciences (англ.) 104 (14). с. 5883–5888. ISSN 0027-8424. PMC PMC1851586. PMID 17389370. doi:10.1073/pnas.0609996104. Процитовано 4 грудня 2021.
- Kuo, M. M.-C.; Baker, K. A.; Wong, L.; Choe, S. (13 лютого 2007). Dynamic oligomeric conversions of the cytoplasmic RCK domains mediate MthK potassium channel activity. Proceedings of the National Academy of Sciences (англ.) 104 (7). с. 2151–2156. ISSN 0027-8424. PMC PMC1892972. PMID 17287352. doi:10.1073/pnas.0609085104. Процитовано 4 грудня 2021.
- Kuo, Mario Meng-Chiang; Saimi, Yoshiro; Kung, Ching; Choe, Senyon (2007-08). Patch Clamp and Phenotypic Analyses of a Prokaryotic Cyclic Nucleotide-gated K+ Channel Using Escherichia coli as a Host. Journal of Biological Chemistry (англ.) 282 (33). с. 24294–24301. PMC PMC3521034. PMID 17588940. doi:10.1074/jbc.M703618200. Процитовано 4 грудня 2021.
- Gietz, R. Daniel; Woods, Robin A. (2001-04). Genetic Transformation of Yeast. BioTechniques (англ.) 30 (4). с. 816–831. ISSN 0736-6205. doi:10.2144/01304rv02. Процитовано 4 грудня 2021.
- Ng, Wenfa (4 вересня 2020). Effect of polyethylene glycol on growth of Escherichia coli DH5α and Bacillus subtilis NRS-762. dx.doi.org. Процитовано 4 грудня 2021.