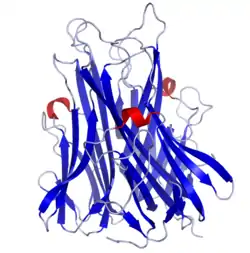
Фактор некрозу пухлини
TNF (англ. Tumor necrosis factor) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 6-ї хромосоми.[3] Довжина поліпептидного ланцюга білка становить 233 амінокислоти, а молекулярна маса — 25 644[4].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSTESMIRDV | ELAEEALPKK | TGGPQGSRRC | LFLSLFSFLI | VAGATTLFCL | ||||
| LHFGVIGPQR | EEFPRDLSLI | SPLAQAVRSS | SRTPSDKPVA | HVVANPQAEG | ||||
| QLQWLNRRAN | ALLANGVELR | DNQLVVPSEG | LYLIYSQVLF | KGQGCPSTHV | ||||
| LLTHTISRIA | VSYQTKVNLL | SAIKSPCQRE | TPEGAEAKPW | YEPIYLGGVF | ||||
| QLEKGDRLSA | EINRPDYLDF | AESGQVYFGI | IAL |
Кодований геном білок за функціями належить до клітинних сигнальних білків (цитокінів, фосфопротеїнів), бере участь у процесах системного запалення, є одним з цитокінів що формують реакцію гострої фази. Фактор некрозу пухлин виробляється переважно активованими макрофагами, меншою мірою його синтезують інші типи клітин (CD4+-лімфоцити, NK-клітини, нейтрофіли, опасисті клітини, еозинофіли та нейтрофіли. Локалізований у клітинній мембрані.
Фізіологія
Основна роль ФНП полягає в регуляції взаємодії імунних клітин. ФНП є ендогенним пірогеном (викликає лихоманку), запускає процес клітинного апоптозу, спричинює кахексію, запалення та пригнічення росту пухлини і реплікацію вірусів, при сепсисі регулює продукцію прозапальних інтерлейкінів IL1 та IL6. Порушення регуляції продукції ФНП спостерігається при різних захворювань, зокрема при хворобі Альцгеймера, злоякісних новоутвореннях, великій депресії, псоріазі, запальних захворюваннях кишечника.
Фармакологія
ФНП стимулює запальні реакції, що, своєю чергою, викликає багато клінічних проблем, пов'язаних з аутоімунними розладами. Зокрема, підвищення синтезу ФНП супроводжує ревматоїдний артрит, анкілозуючий спондиліт (хвороба Бехтерєва), запальні захворювання кишечника (хвороба Крона, неспецифічний виразковий коліт), псоріаз, персистуючу бронхіальну астму. У деяких випадках лікування, спрямоване не інгібування ФНП, дозволяє досягти доброго клінічного ефекту. Гальмування ФНП може бути досягнуто за допомогою моноклональних антитіл, що безпосередньо зв'язуються з ФНП: інфліксимаб (Remicade), адалімумаб (Humira), цертолізумаб-пегол (Cimzia). Іншим шляхом зниження активності ФНП є уведення до організму штучного циркулюючого білка-рецептора, який зв'язує ФНП з більшою афінністю, ніж рецептор на клітинній мембрані. Препаратом такої дії є етанерцепт (Enbrel).
На жаль, анти-ФНП-терапія показала скромну ефективність при онкопатології. Лікування нирково-клітинної карциноми з інфліксимабом призвело до тривалої стабілізації хвороби лише у деяких пацієнтів. Етанерцепт був протестований для лікування хворих на рак молочної залози та раку яєчників і спричинив більш тривалу стабілізацію захворювання у деяких пацієнток шляхом зниження експресії IL-6 та CCL2. З іншого боку, додавання інфліксимабу або етанерцепту до гемцитабіну для лікування пацієнтів із запущеним раком підшлункової залози не підвищило ефективності лікування порівняно з плацебо.
Талідомід (Immunoprin) та його похідні леналідомід (Ревлімід) і помалідомід (Pomalyst, Imnovid) також активні проти ФНП. Іншими прикладами простих препаратів, що мають супресивний ефект щодо ФНП, є пентоксифілін[5] і бупропіон.[6]
Рекомбінантний ФНП використовується як імуностимулятор під INN тасонермін[7].
Література
- Shirai T., Yamaguchi H., Ito H., Todd C.W., Wallace R.B. (1985). Cloning and expression in Escherichia coli of the gene for human tumour necrosis factor.. Nature 313: 803 — 806. PubMed DOI:10.1038/313803a0
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Takakura-Yamamoto R., Yamamoto S., Fukuda S., Kurimoto M. (1996). O-glycosylated species of natural human tumor-necrosis factor-alpha.. Eur. J. Biochem. 235: 431 — 437. PubMed DOI:10.1111/j.1432-1033.1996.00431.x
- Stevenson F.T., Bursten S.L., Locksley R.M., Lovett D.H. (1992). Myristyl acylation of the tumor necrosis factor alpha precursor on specific lysine residues.. J. Exp. Med. 176: 1053 — 1062. PubMed DOI:10.1084/jem.176.4.1053
- Jinesh G.G., Chunduru S., Kamat A.M. (2012). Smac mimetic enables the anticancer action of BCG-stimulated neutrophils through TNF-alpha but not through TRAIL and FasL.. J. Leukoc. Biol. 92: 233 — 244. PubMed DOI:10.1189/jlb.1211623
- Jones E.Y., Stuart D.I., Walker N.P. (1989). Structure of tumour necrosis factor.. Nature 338: 225 — 228. PubMed DOI:10.1038/338225a0
Примітки
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:11892 (англ.). Процитовано 6 вересня 2017.
- UniProt, P01375 (англ.). Процитовано 6 вересня 2017.
- Pentoxifylline Inhibits TNF-α Production from Human Alveolar Macrophages
- A new chapter opens in anti-inflammatory treatments:The antidepressant bupropion lowers production of tumor necrosis factor-alpha and interferon-gamma in mice
- Beromun (INN tasonermin)