Хвороба Альцгеймера
Хвороба Альцгеймера, також сенільна деменція Альцгеймерівського типу — один з різновидів деменції, що уражає близько 6 % (одного з 16) людей віком понад 65 років.[7] Названа на честь німецького психіатра і невролога Алоїза Альцгеймера.
| Хвороба Альцгеймера | |
|---|---|
 Зліва направо: головний мозок здорової людини в похилому віці та хворого на хворобу Альцгеймера Зліва направо: головний мозок здорової людини в похилому віці та хворого на хворобу Альцгеймера | |
| Спеціальність | неврологія[1] |
| Симптоми | втрата пам'яті, розлади поведінки |
| Початок | понад 65 років |
| Причини | невідомеd |
| Метод діагностики | неврологічні методи діагностикиd[1], анамнез[1], МРТ[1] і Психологічне тестування |
| Ведення | мемантин[1], донепезил[1], ривастигмін[1], галантамін[1] і physostigmined[2] |
| Препарати | кветіапін[3], арипіпразол[3], галантамін[3][1], донепезил[3], рисперидон[3], мемантин[3], ривастигмін[3], ривастигмін[4], мемантин[5] і pyritinold[6] |
| Частота | 5.05% (Європа) |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 8A20 |
| МКХ-10 | F00 та G30 |
| OMIM | 104300 |
| DiseasesDB | 490 |
| MedlinePlus | 000760 |
| eMedicine | neuro/13 |
| MeSH | D000544 |
| | |
Існують різновиди цієї хвороби, які також уражають людей молодшого віку. Уражається «сіра речовина» головного мозку, що призводить до втрати пам'яті і прогресуючого слабоумства. Це порушення мозкових процесів, не фізичних функцій. Воно зумовлене накопиченням β-амілоїду (продукту розпаду білка, попередника амілоїду — Amyloid Precursor Protein або скорочено APP), здатного до утворення волоконних структур (fibrils). Вчені, які займаються вивченням цієї хвороби, поділилися на два табори: одні відстоюють важливу роль тау білка (tau protein), а інші — β-амілоїду (Аβ) і його різновидів (Аβ42, Аβ40, олігомерних форм обох різновидів, а також їх N-термінальних модифікацій) у розвитку і перебігу хвороби.
Історія дослідження
Лікарі і філософи Стародавньої Греції і Риму пов'язували старість з ослабленням розуму, однак тільки 1901 року німецький психіатр Алоїз Альцгеймер виявив випадок хвороби, яку згодом назвали його ім'ям. Аналіз захворювання п'ятдесятирічної Августи Д. він опублікував вперше 1906 року вже після смерті пацієнтки[8].
Впродовж наступних п'яти років у медичній літературі з'явилося ще одинадцять схожих описів, причому автори деяких з них вже використовували термін «хвороба Альцгеймера»[9]. Еміль Крепелін став першим, хто назвав хворобу Альцгеймера самостійним захворюванням. 1910 року він виділив її як підтип сенільної деменції у восьмому виданні свого підручника з психіатрії, давши їй паралельну назву «пресенільна деменція»[10].
Діагноз хвороби Альцгеймера впродовж більшої частини XX століття ставили лише відносно молодим пацієнтам, у яких перші симптоми деменції з'явилися у віці від 45 до 65 років. Термінологія змінилася після проведеної 1977 року конференції з хвороби Альцгеймера, учасники якої прийшли до висновку, що клінічні і патологічні прояви пресенільної і сенільної деменцій практично ідентичні, хоча і не виключили існування етіологічних відмінностей[11]. Поступово діагноз стали ставити незалежно від віку[12], хоча якийсь час для опису хвороби в осіб старше 65 років все ще використовували термін «сенільна деменція Альцгеймерского типу» (SDAT), залишаючи «класичний» діагноз хвороби Альцгеймера для більш молодих. У підсумку термін «хвороба Альцгеймера» формально прийняли в медичну номенклатуру як назву захворювання, яке діагностується незалежно від віку, при наявності відповідних симптомів, що розвиваються характерним чином і супроводжуються появою типових нейропатологічних ознак[13].
Епідеміологія
| Вік, років | Захворюваність (нові випадки) на тисячу людино-років[15] |
|---|---|
| 65-69 | 3 |
| 70-74 | 6 |
| 75-79 | 9 |
| 80-84 | 23 |
| 85-89 | 40 |
| 90- | 69 |
Два основні показники, що використовуються в епідеміологічних дослідженнях — захворюваність та поширеність захворювання. Захворюваність відображає число нових випадків на одиницю людино-часу (зазвичай кількість нових випадків на тисячу людей за рік), а хворобливість говорить про загальну кількість уражених хворобою в популяції на конкретний момент часу.
Когортні лонгітюдні дослідження (в ході яких спочатку здорова популяція відстежується впродовж багатьох років) свідчать про захворюваність на рівні 10-15 нових випадків на тисячу людей за рік для всіх типів деменції і 5-8 випадків для хвороби Альцгеймера[14][16], що становить приблизно половину від загального числа щорічних діагнозів. Похилий вік — головний фактор ризику, що відображається в статистиці. На кожні п'ять років після 65-річного віку показник ризику збільшується приблизно вдвічі, виростаючи від 3 випадків в 65 років до 69 випадків до 95 років[14][16]. Існують і статеві відмінності — жінки частіше хворіють на хворобу Альцгеймера, особливо після 85 років[17].
Поширеність хвороби в популяції залежить від різних факторів, у тому числі від захворюваності та смертності. Оскільки захворюваність зростає з віком, необхідно неодмінно враховувати середній вік населення у досліджуваній місцевості. У США станом на 2000 рік близько 1,6 % населення, як в цілому, так і в групі 65-74 років, мали хворобу Альцгеймера. У групі 75-84 років цей показник становив уже 19 %, а серед громадян, чий вік перевищив 84 роки, поширеність хвороби становила 42 %[18]. У менш розвинених країнах поширеність хвороби нижча[19]. За даними ВООЗ, 2005 року деменцією страждали 0,379 % світового населення, а прогноз на 2015 рік досягає значення 0,441 % і ще більший відсоток населення 0,556 % може бути уражених хворобою до 2030 року[20].
Інше дослідження свідчить про те, що 2006 року поширеність хвороби у світі становила 0,40 % (розкид 0.17-0.89 %, абсолютна кількість — 26 600 тисяч осіб з розкидом 11.4-59.4 млн.) і передбачає, що пайовий показник зросте втричі, а от абсолютна кількість хворих — вчетверо до 2050 року[21].
Стадії розвитку захворювання
Розвиток хвороби поділяють на чотири стадії з прогресуючою картиною когнітивних і функціональних порушень.
Предеменція
Перші симптоми часто плутають з проявами старіння або реакцією на стрес[22]. Найбільш ранні когнітивні труднощі виявляються у деяких людей при детальному нейрокогнітивному діагностуванні за вісім років до встановлення діагнозу[23]. Ці початкові симптоми можуть позначатися на виконанні найскладніших повсякденних завдань[24]. Найпомітніші розлади короткочасної пам'яті, що виявляються в ускладненні при спробі згадати недавно завчені факти і в нездатності засвоїти нову інформацію[25][26]. Малопомітні проблеми виконавчих функцій: зосередженості, планування, когнітивної гнучкості і абстрактного мислення, порушення семантичної пам'яті (пам'ять про значення слів, про взаємовідносини концепцій), також можуть бути симптомом ранніх стадій хвороби Альцгеймера[27][28].
На цій стадії може відзначатися апатія, яка залишається найстійкішим нейропсихіатричним симптомом протягом всього захворювання[29][30][31]. Також є поширеними є депресивні симптоми, дратівливість і зниження уваги до незначних ускладнень пам'яті.[32] Доклінічну стадію називають «м'яким когнітивним порушенням»[33] (МКП, англ. MCI), але ведуться суперечки про те, чи використовувати останню назву для позначення першої стадії хвороби Альцгеймера або виділити в окрему діагностичну одиницю[34]. МКП може бути разом з багатьма симптомами, коли втрата пам'яті є переважаючим симптомом, тоді кажуть про «амнестичну МКП», яка здебільшого розглядається як продромальний період хвороби Альцгеймера.[35]
Рання деменція
Прогресуюче зниження пам'яті і агнозія при хворобі Альцгеймера рано чи пізно ведуть діагноз до підтвердження. У невеликої кількості пацієнтів при цьому на перший план виступають не розлади пам'яті, а порушення мови, виконавчих функцій, сприйняття або рухові порушення (апраксія)[36]. Хвороба по-різному відбивається на різних аспектах пам'яті. Старі спогади про власне життя (епізодична пам'ять), давно завчені факти (семантична пам'ять), імпліцитна пам'ять (неусвідомлена «пам'ять тіла» про послідовність дій, наприклад, про те, як використовувати столові прилади) у меншій мірі схильні до розладу в порівнянні з новими фактами або спогадами[37][38].
Порушення мови загалом характеризується збіднінням словникового запасу і зниженою побіжністю мови, що в цілому послаблює здатність до словесного та письмового вираження думок. На цій стадії хвороби людина зазвичай здатна адекватно оперувати простими поняттями при мовному спілкуванні[39][40][41]. При малюванні, письмі, надяганні одягу та інших задачах з використанням дрібної моторики, людина може здаватися незграбною через певні проблеми з координацією і плануванням рухів[42]. У міру розвитку хвороби людина найчастіше цілком здатна виконувати багато завдань незалежно, проте їй можуть знадобитися допомога або догляд при спробі провести маніпуляції, що вимагають особливих когнітивних зусиль[36].
Помірна деменція
Здатність до незалежних дій знижується через прогресуюче погіршення стану[36]. Розлади мови стають очевидними, тому що з втратою доступу до словникового запасу людина все частіше підбирає неправильні слова на заміну забутим (парафраз). Також відбувається втрата навичок читання та письма[39][43]. З часом все більше порушується координація рухів при виконанні складних послідовностей рухів, що знижує здатність людини справлятися з більшістю повсякденних завдань[44]. На цьому етапі посилюються проблеми з пам'яттю, і хворий може не впізнавати близьких родичів[45]. Тепер довготривала пам'ять також порушується[46] і відхилення у поведінці стають помітнішими. Звичайними є такі нейропсихіатричні прояви як блукання, вечірнє загострення (англ. sundowning)[47], дратівливість і емоційна лабільність, що виявляється в плачі, спонтанній агресії або в спротиві догляду. Синдром помилкової ідентифікації та інші симптоми марення розвиваються приблизно у 30 % пацієнтів[29][48]. У родичів хворого і осіб, що його доглядають, ці прояви породжують стрес, який може бути пом'якшений переміщенням пацієнта з-під домашнього догляду в стаціонарний заклад[36][49].
Тяжка деменція
На останній стадії хвороби Альцгеймера пацієнт повністю залежить від сторонньої допомоги. Володіння мовою скорочується до використання одиничних фраз і навіть окремих слів, і в підсумку мовлення повністю втрачається[39]. Незважаючи на втрату вербальних навичок, пацієнти часто здатні розуміти і відповідати взаємністю на емоційні звертання до них[50]. Хоча на цьому етапі все ще можуть бути прояви агресії, набагато частіше стан хворого характеризується апатією і виснаженням[36], і з якогось моменту він не в стані здійснити навіть найпростішу дію без зовнішньої допомоги. Хворий втрачає м'язову масу, пересувається насилу і на певному етапі виявляється не в силах залишити ліжко[51], а потім і самостійно харчуватися[52]. Смерть зазвичай настає внаслідок стороннього чинника, такого як пролежнева виразка або пневмонія, а не з вини власне хвороби Альцгеймера[53][54].
Патогенез
_presenile_onset.jpg.webp)
Нейрологічні ураження
Хвороба характеризується втратою нейронів і синаптичних зв'язків в корі головного мозку і певних субкортікальних областях. Загибель клітин призводить до вираженої атрофії уражених ділянок, у тому числі до дегенерації скроневих і тім'яної часток, ділянок фронтальної кори і поясної звивини[55].
Як амілоїдні бляшки, так і нейрофібриллярні клубки добре помітні під мікроскопом при посмертному аналізі зразків мозку хворих[56]. Бляшки являють собою щільні, в більшості випадків нерозчинні відкладення бета-амілоїду і клітинного матеріалу всередині і зовні нейронів. Усередині нервових клітин вони ростуть, утворюючи нерозчинні закручені сплетіння волокон, часто звані клубками. У багатьох літніх людей у мозку утворюється деяка кількість бляшок і клубків, однак при хворобі Альцгеймера їх більше в певних ділянках мозку, таких як скроневі частки[57].
Біохімія
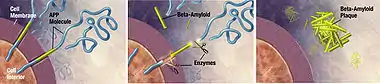
Встановлено, що хвороба Альцгеймера — протеїнопатія, захворювання, пов'язане з накопиченням у тканинах мозку ненормально згорнутих білків — бета-амілоїду і тау-білка[58]. Бляшки утворюються з малих пептидів завдовжки 39-43 амінокислоти, іменованих бета-амілоїд (також A-beta, Aβ). Бета-амілоїд — фрагмент більш великого білка-попередника — APP. Цей трансмембранний білок відіграє важливу роль у зростанні нейрона, його виживання та відновлення після ушкоджень[59][60].
При хворобі Альцгеймера з невідомих поки що причин APP піддається протеолізу — поділяється на пептиди під впливом ферментів[61]. Бета-амілоїдні нитки, утворені одним з пептидів, злипаються в міжклітинному просторі в щільні утворення, відомі як сенільні бляшки[56][62].
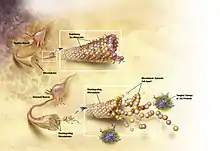
Більш специфічно, хворобу Альцгеймера відносять також до таупатій — хвороб, пов'язаних з ненормальною агрегацією тау-білка. Кожен нейрон містить цитоскелет, почасти складений з мікротрубочок, які діють подібно рейкам, направляючи поживні речовини та інші молекули з центру на периферію клітини, до закінчення аксона, — і назад. Тау-білок, поряд з кількома іншими білками, асоційованими з мікротрубочками, зокрема, після фосфоризації, він їх стабілізує. При хворобі Альцгеймера тау-білок піддається надлишковому фосфорилюванню, через що нитки білка починають зв'язуватися одна з іншою, злипатися в нейрофібрилярні клубки і руйнувати транспортну систему нейрона[63].
Безпосередній патологічний механізм
Невідомо, як саме порушення синтезу і подальше скупчення бета-амілоїдних пептидів спричинює патологічні відхилення при хворобі Альцгеймера[64]. Амілоїдна гіпотеза традиційно вказувала на скупчення бета-амілоїду як на основну подію, що запускає процес нейронної дегенерації.
Вважається, що відкладення порушують гомеостаз іонів кальцію в клітині і провокують апоптоз[65]. Відомо, що місцем скупчення Aβ в нейронах пацієнтів є мітохондрії, також цей пептид інгібує роботу деяких ферментів і впливає на використання глюкози[66].
Запальні процеси і цитокіни можуть відігравати роль у патофізіології. Оскільки запалення є ознакою ушкодження тканин при будь-якому захворюванні, при хворобі Альцгеймера воно може грати вторинну роль по відношенню до основної патології або представляти собою маркер імунної реакції[67].
Генетика
Відомі три гени, мутації яких в основному дозволяють пояснити походження рідкісної ранньої форми, проте поширена форма хвороби Альцгеймера поки не вкладається в рамки виключно генетичної моделі. Найбільш вираженим генетичним фактором ризику тепер вважається APOE, але варіації цього гена асоційовані лише з деякими випадками хвороби[68].
Менше 10 % випадків хвороби у віці до 60 років пов'язані з аутосомно-домінантними (сімейними) мутаціями, які в загальному масиві складають менше 0,01 %[68][69][70]. Мутації виявлені в генах APP (хромосома 21), пресеніліну 1 і пресеніліну 2[68], більшість з них посилюють синтез малого білка Abeta42, основного компонента сенільних бляшок[71].
У родинах більшості хворих не відзначається схильності до захворювання, проте гени можуть частково обумовлювати ризик. Найвідоміший генетичний фактор ризику — успадковується алель E4 гена APOE, з якою може бути пов'язано до половини випадків пізньої спорадичної хвороби Альцгеймера[72]. Генетики погоджуються на тому, що багато інших генів можуть в якійсь мірі сприяти або перешкоджати розвитку пізньої хвороби Альцгеймера. Всього з цим поширеним типом хвороби підтверджено асоціацію понад з 400 генами. Один з недавніх прикладів — варіація гена RELN, пов'язана з підвищеною захворюваністю у жінок[73].
Діагностика
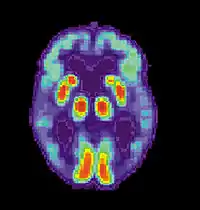
Клінічний діагноз хвороби Альцгеймера звичайно заснований на історії пацієнта (анамнезі життя), історії його родичів і клінічних спостережень (спадковому анамнезі), при цьому враховуються характерні неврологічні та нейропсихологічні ознаки і виключаються альтернативні діагнози[74][75].
Для того, щоб відрізнити хворобу від інших нозологій і різновидів деменції, використовуються складні методи медичної візуалізації — комп'ютерна томографія, магнітно-резонансна томографія, Однофотонна емісійна комп'ютерна томографія або позитрон-емісійна томографія[76].
Для точнішої оцінки стану проводиться тестування інтелектуальних функцій, в тому числі пам'яті[22]. Медичні організації розробляють діагностичні критерії з метою полегшити діагностику практикуючому лікарю і стандартизувати процес постановки діагнозу. Іноді діагноз підтверджується або встановлюється посмертно при гістологічному аналізі тканин мозку[77].
Діагностичні критерії
У США Національний інститут неврологічних і комунікативних розладів та інсульту (NINDS) та Асоціація хвороби Альцгеймера склали найбільш часто використовуваний набір критеріїв для діагностики хвороби Альцгеймера[78].
Згідно з критеріями, для постановки клінічного діагнозу можливої хвороби Альцгеймера потрібно підтвердити наявність когнітивних порушень і можливого синдрому деменції в ході нейропсихологічного тестування. Для остаточного підтвердження діагнозу необхідний гістопатологічних аналіз тканин мозку, і в ході звірки прижиттєвих діагнозів за критеріями з посмертним аналізом були відзначені висока статистична надійність і верифікація[79].
Найчастіше порушення при хворобі Альцгеймера зачіпають вісім доменів: пам'ять, мовні навички, здатність сприймати навколишнє, конструктивні здібності, орієнтування в просторі, часі й власній особистості, навички вирішення проблем, функціонування, самозабезпечення. Ці домени еквівалентні критеріям NINCDS-ADRDA, перерахованим в DSM-IV-TR[80][81].
Діагностичні інструменти
Нейропсихологічні тести, наприклад, MMSE, широко застосовуються для оцінки когнітивних порушень, які повинні розвиватися при захворюванні. Для отримання надійних результатів потрібні більш розгорнуті набори тестів, особливо на ранніх стадіях хвороби[82][83]. На початкових стадіях хвороби неврологічний огляд звичайно не показує нічого незвичайного, за винятком явних когнітивних відхилень, які можуть нагадувати звичайну деменцію. Зважаючи на це, для диференціальної діагностики хвороби Альцгеймера та інших захворювань важливе розширене неврологічне дослідження[22]. Бесіда з членами родини також використовується при оцінці перебігу хвороби, оскільки близькі родичі можуть надати важливу інформацію про рівень повсякденної активності людини і про поступове зниженні його розумових здібностей[84]. Оскільки сам пацієнт зазвичай не помічає порушень, точка зору людей, які доглядають за ним, особливо важлива[85]. Водночас у багатьох випадках ранні прояви деменції залишаються непоміченими в сім'ї, і лікар отримує від родичів неточну інформацію[86]. Додаткові тести збагачують картину інформацією про деякі аспекти хвороби або дозволяють виключити інші діагнози. Дослідження крові може виявити альтернативні причини деменції, які іноді навіть піддаються терапії, здатній повернути симптоми назад[87]. Також застосовуються психологічні тести для виявлення депресії, яка може як супроводжувати хворобу Альцгеймера, так і бути причиною когнітивного зниження[88][89].
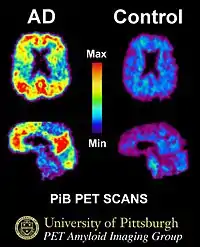
Апаратуру SPECT- і PET-візуалізації при її доступності використовують для підтвердження діагнозу спільно з іншими методами оцінки, що включають аналіз ментального статусу[90]. У людей, які вже страждають від деменції, SPECT дозволяє більш ефективно диференціювати хворобу Альцгеймера від інших причин, у порівнянні зі стандартним тестуванням і вивченням анамнезу[91]. Можливість спостерігати відкладення бета-амілоїду в мозку живих людей з'явилася завдяки створенню в Піттсбурзькому університеті Піттсбурзького розчину B, що зв'язується з амілоїдними відкладеннями при введенні в організм. Короткоживучий радіоактивний ізотоп вуглець-11 у поєднанні дозволяє визначати розподіл цієї речовини в організмі і отримувати картину амілоїдних відкладень у мозку хворого за допомогою ПЕТ-сканера[92]. Показано також, що об'єктивним маркером хвороби може бути утримання бета-амілоїду або тау-білка у спинномозковій рідині[93]. Ці два нові методи активували пропозиції про розробку нових діагностичних критеріїв[22][78].
В 2019 році у Медичній школі Вашингтонського Університету розробили аналіз крові, що може розпізнати хворобу на ранній стадії або попередити її виникнення. Дослідники вимірюють рівень бета-амілоїду у крові та прогнозують, скільки його накопичилося у мозку. При поєднанні критичного рівня амілоїду в крові з певним віком та наявністю генетичної варіації APOE4 — людей, які знаходяться у зоні ризику, можна ідентифікувати з точністю до 94 %. Новий метод діагностування проходить випробування та очікується у лікарнях протягом декількох років.[94]
Фармакотерапія

Регулюючими агентствами, такими як FDA і EMEA, в наш час [коли?] схвалені чотири препарати для терапії когнітивних порушень при хворобі Альцгеймера — три інгібітори холінестерази і мемантин, NMDA-антагоніста. При цьому немає таких ліків, серед дій яких було б вказано уповільнення або припинення розвитку хвороби Альцгеймера.
Відомою ознакою хвороби Альцгеймера є зниження активності холінергічних нейронів[99]. Інгібітори холінестерази знижують швидкість руйнування ацетилхоліна (ACh), підвищуючи його концентрацію в мозку і компенсуючи втрату ACh, яку спричинює втрата холінергічних нейронів[100]. Станом на 2008 рік, лікарями використовувалися такі АЧ-інгібітори як донепезил[101], галантамін[102] і ривастигмін (у формі таблеток[103] та пластиря[104]. Є свідчення ефективності цих препаратів на початковій та помірній стадіях[105], а також деякі підстави для їх застосування на пізній стадії. Тільки донепезил схвалений до застосування при настанні тяжкої деменції[106]. Використання цих препаратів при м'якому когнітивному порушенні не уповільнювало настання хвороби Альцгеймера[107].
Серед побічних дій препаратів найпоширенішими є відчуття нудоти і блювання, пов'язані з надлишком холінергічної активності, вони виникають у 1-10 % пацієнтів і можуть бути слабо- або помірновираженними. Рідше зустрічаються спазми м'язів, брадикардія, зниження апетиту, втрата ваги, збільшення кислотності шлункового соку[108].
Збудливий нейротрансміттер глутамат відіграє важливу роль в роботі нервової системи, але його надлишок веде до надмірної активації глутаматних рецепторів і може вспричинити загибель клітин. Цей процес, званий ексайтотоксичністю, відзначається не тільки при хворобі Альцгеймера але і при інших станах, наприклад, при хворобі Паркінсона і розсіяному склерозі[109]. Препарат під назвою Мемантин[110], який первісно застосовувався при лікуванні грипу, інгібує активацію глутаматних NMDA-рецепторів[109]. Показана помірна ефективність Мемантину при хворобі Альцгеймера помірної і значної тяжкості, але невідомо, як він діє на ранній стадії[111]. Рідко відзначаються слабко виражені побічні ефекти, серед них — галюцинації, замішання, запаморочення, головний біль і втома[112]. У комбінації з донепезилом Мемантин демонструє «статистично значиму, але клінічно ледь помітну ефективність» у дії на когнітивні показники[113]. У пацієнтів, чия поведінка становить проблему, антипсихотичні препарати можуть певною мірою знизити агресію і впливати на психоз. У той самий час ці препарати викликають серйозні побічні ефекти, зокрема, цереброваскулярні ускладнення, рухові порушення та зниження когнітивних здібностей, що виключає їх повсякденне використання[114][115]. При тривалому призначенні антипсихотиків при хворобі Альцгеймера відзначається підвищена смертність[115].
Профілактика хвороби Альцгеймера

Міжнародні дослідження, покликані оцінити, наскільки той чи інший захід здатні уповільнити або запобігти настанню хвороби, нерідко дають суперечливі результати. Досі немає твердих свідоцтв превентивної дії будь-якого з розглянутих факторів[116]. Разом з тим, епідеміологічні дослідження свідчать про те, що деякі чинники, що піддаються корекції, — дієта, ризик серцево-судинних захворювань, прийом ліків, розумова активність та інші — асоційовані з імовірністю розвитку хвороби. Проте реальні докази їхньої здатності запобігти хворобі можуть бути отримані лише в ході додаткового вивчення, в яке будуть входити клінічні дослідження[117]. Інгредієнти середземноморської дієти, в тому числі фрукти і овочі, хліб, пшениця та інші круп'яні культури, оливкова олія, риба і червоне вино, можливо, здатні окремо або разом знижувати ризик і пом'якшувати перебіг хвороби Альцгеймера[118]. Прийом деяких вітамінів, у їх числі В12, B3, С і фолієвої кислоти, під час деяких досліджень був пов'язаний зі зниженим ризиком розвитку хвороби[119], проте інші роботи свідчать про відсутність значущого впливу на початок і перебіг хвороби і про вірогідність побічних ефектів[120]. Куркумін, що міститься у куркумі, при дослідженні на мишах показав деяку здатність запобігати певним патологічним змінам в мозку[121].
Фактори ризику серцево-судинних захворювань, такі як високий рівень холестерину і артеріальна гіпертензія, цукровий діабет, куріння, асоційовані з підвищеним ризиком і більш важким перебігом хвороби Альцгеймера[122][123], але препарати, що знижують холестерин (статини) не показали ефективності у запобіганні або поліпшенні стану хворих[124][125]. Довготривале застосування нестероїдних протизапальних засобів асоційоване зі зниженою ймовірністю розвитку хвороби у деяких людей[126]. Інші ліки, наприклад, гормонозамінна терапія у жінок, більше не вважаються ефективними в запобіганні деменції[127][128]. Систематичний огляд гінкго білоба, проведений 2007 року, свідчить про непослідовний і непереконливий характер представлених підтверджень впливу препарату на когнітивні порушення[129], а ще одне дослідження свідчить про відсутність дії на захворюваність[130].
Інтелектуальні заняття, такі як читання, настільні ігри, розгадування кросвордів, гра на музичних інструментах, регулярне спілкування, можливо, здатні уповільнити наступ хвороби або пом'якшити її розвиток[131][132]. Володіння двома мовами асоційоване з пізнішим початком хвороби Альцгеймера[133]. Деякі дослідження свідчать про підвищений ризик розвитку хвороби Альцгеймера у тих людей, чия робота пов'язана з впливом магнітних полів[134][135], попаданням в організм металів, особливо алюмінію (в тому числі приготування або вживання їжі із алюмінієвого посуду чи алюмінієвими столовими приборами)[136][137], або використанням розчинників[138]. Деякі з цих публікацій піддані критиці за низьку якість роботи[139], до того ж в інших дослідженнях не виявлено зв'язку факторів зовнішнього середовища з розвитком хвороби Альцгеймера[140][141][142][143].
Примітки
- Bednařík J., Ambler Z., Růžička E. Klinická neurologie: část speciální — ISBN 978-80-7387-389-9
- Чеська Вікіпедія — 2002.
- Drug Indications Extracted from FAERS — doi:10.5281/ZENODO.1435999
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Alistair Burns, Steve Iliffe. (February 2009). Alzheimer's disease. BMJ 338: b158. PMID 19196745. doi:10.1136/bmj.b158.
- Auguste D.:
- Alzheimer Alois (1907). Über eine eigenartige Erkrankung der Hirnrinde [About a peculiar disease of the cerebral cortex]. Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich Medizin ((нім.)) 64 (1–2): 146–148.
- Alzheimer Alois (1987). About a peculiar disease of the cerebral cortex. By Alois Alzheimer, 1907 (Translated by L. Jarvik and H. Greenson). Alzheimer Dis Assoc Disord 1 (1): 3–8. PMID 3331112.
- Maurer Ulrike, Maurer Konrad (2003). Alzheimer: the life of a physician and the career of a disease. New York: Columbia University Press. с. 270. ISBN 0-231-11896-1.
- Berchtold NC, Cotman CW (1998). Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s. Neurobiology of Aging 19 (3): 173–189. PMID 9661992. doi:10.1016/S0197-4580(98)00052-9.
- Kraepelin Emil, Diefendorf A. Ross (translated by) (17 січня 2007). Clinical Psychiatry: A Textbook For Students And Physicians (Reprint). Kessinger Publishing. с. 568. ISBN 1-4325-0833-4.
- Katzman Robert, Terry Robert D, Bick Katherine L (editors) (1978). Alzheimer's disease: senile dementia and related disorders. New York: Raven Press. с. 595. ISBN 0-89004-225-X.
- Boller F, Forbes MM (June 1998). History of dementia and dementia in history: an overview. J. Neurol. Sci. 158 (2): 125–33. PMID 9702682.
- Amaducci LA, Rocca WA, Schoenberg BS (November 1986). Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosology. Neurology 36 (11): 1497–9. PMID 3531918.
- Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (January 2008). Incidence and subtypes of dementia in three elderly populations of central Spain. J. Neurol. Sci. 264 (1–2): 63–72. PMID 17727890. doi:10.1016/j.jns.2007.07.021.
- Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (January 2008). «Incidence and subtypes of dementia in three elderly populations of central Spain». Journal of the Neurological Sciences. 264 (1–2): 63–72. doi:10.1016/j.jns.2007.07.021. PMID 17727890.
- Di Carlo A, Baldereschi M, Amaducci L, et al (January 2002). Incidence of dementia, Alzheimer's disease, and vascular dementia in Italy. The ILSA Study. J Am Geriatr Soc 50 (1): 41–8. PMID 12028245.
- Andersen K, Launer LJ, Dewey ME, et al (December 1999). Gender differences in the incidence of AD and vascular dementia: The EURODEM Studies. EURODEM Incidence Research Group. Neurology 53 (9): 1992–7. PMID 10599770.
-
2000 U.S. estimates:
- Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (August 2003). Alzheimer disease in the US population: prevalence estimates using the 2000 census. Arch. Neurol. 60 (8): 1119–22. PMID 12925369. doi:10.1001/archneur.60.8.1119.
- Profiles of general demographic characteristics, 2000 census of population and housing, United States (PDF). U.S. Census Bureau (Бюро перепису населення США). 2001. Архів оригіналу за 25 серпня 2011. Процитовано 27 серпня 2008.
- Ferri CP, Prince M, Brayne C, et al (December 2005). Global prevalence of dementia: a Delphi consensus study (PDF). Lancet 366 (9503): 2112–7. PMID 16360788. doi:10.1016/S0140-6736(05)67889-0. Архів оригіналу за 29 жовтня 2006. Процитовано 13 червня 2008.
- World Health Organization (2006). Neurological Disorders: Public Health Challenges. Switzerland: World Health Organization. с. 204–207. ISBN 978-92-4-156336-9.
- 2006 prevalence estimate:
- Brookmeyer R, Johnson E, Ziegler-Graham K, MH Arrighi (July 2007). Forecasting the global burden of Alzheimer’s disease. Alzheimer's and Dementia 3 (3): 186–91. doi:10.1016/j.jalz.2007.04.381. Процитовано 18 червня 2008.
- World population prospects: the 2006 revision, highlights (PDF). — Population Division, Department of Economic and Social Affairs, United Nations, 2007. Архівовано з джерела 19 серпня 2008. Процитовано 2008-08-27.
- Waldemar G, Dubois B, Emre M, et al (January 2007). Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline. Eur. J. Neurol. 14 (1): e1–26. PMID 17222085. doi:10.1111/j.1468-1331.2006.01605.x.
- Preclinical: *Linn RT, Wolf PA, Bachman DL, et al (May 1995). The 'preclinical phase' of probable Alzheimer's disease. A 13-year prospective study of the Framingham cohort. Arch. Neurol. 52 (5): 485–90. PMID 7733843.
- Saxton J, Lopez OL, Ratcliff G, et al (December 2004). Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset. Neurology 63 (12): 2341–7. PMID 15623697.
- Twamley EW, Ropacki SA, Bondi MW (September 2006). Neuropsychological and neuroimaging changes in preclinical Alzheimer's disease. J Int Neuropsychol Soc 12 (5): 707–35. PMC 1621044. PMID 16961952. doi:10.1017/S1355617706060863.
- Perneczky R, Pohl C, Sorg C, Hartmann J, Komossa K, Alexopoulos P, Wagenpfeil S, Kurz A (2006). Complex activities of daily living in mild cognitive impairment: conceptual and diagnostic issues. Age Ageing 35 (3): 240–245. PMID 16513677. doi:10.1093/ageing/afj054.
- Arnáiz E, Almkvist O (2003). Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease. Acta Neurol. Scand., Suppl. 179: 34–41. PMID 12603249. doi:10.1034/j.1600-0404.107.s179.7.x.
- Kazui H, Matsuda A, Hirono N, et al (2005). Everyday memory impairment of patients with mild cognitive impairment. Dement Geriatr Cogn Disord 19 (5–6): 331–7. PMID 15785034. doi:10.1159/000084559. Процитовано 12 червня 2008.
- Rapp MA, Reischies FM (2005). Attention and executive control predict Alzheimer disease in late life: results from the Berlin Aging Study (BASE). American Journal of Geriatric Psychiatry 13 (2): 134–141. PMID 15703322. doi:10.1176/appi.ajgp.13.2.134.
- Spaan PE, Raaijmakers JG, Jonker C (2003). Alzheimer's disease versus normal ageing: a review of the efficiency of clinical and experimental memory measures. Journal of Clinical Experimental Neuropsychology 25 (2): 216–233. PMID 12754679.
- Craig D, Mirakhur A, Hart DJ, McIlroy SP, Passmore AP (2005). A cross-sectional study of neuropsychiatric symptoms in 435 patients with Alzheimer's disease. American Journal of Geriatric Psychiatry 13 (6): 460–468. PMID 15956265. doi:10.1176/appi.ajgp.13.6.460.
- Robert PH, Berr C, Volteau M, Bertogliati C, Benoit M, Sarazin M, Legrain S, Dubois B (2006). Apathy in patients with mild cognitive impairment and the risk of developing dementia of Alzheimer's disease: a one-year follow-up study. Clin Neurol Neurosurg 108 (8): 733–736. PMID 16567037. doi:10.1016/j.clineuro.2006.02.003.
- Palmer K, Berger AK, Monastero R, Winblad B, Bäckman L, Fratiglioni L (2007). Predictors of progression from mild cognitive impairment to Alzheimer disease. Neurology 68 (19): 1596–1602. PMID 17485646. doi:10.1212/01.wnl.0000260968.92345.3f.
- Murray ED, Buttner N, Price BH (2012). Depression and Psychosis in Neurological Practice. У Bradley WG, Daroff RB, Fenichel GM, Jankovic J. Bradley's neurology in clinical practice (вид. 6th). Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-0434-1.
- Small BJ, Gagnon E, Robinson B (April 2007). Early identification of cognitive deficits: preclinical Alzheimer's disease and mild cognitive impairment. Geriatrics 62 (4): 19–23. PMID 17408315.
- Petersen RC (February 2007). The current status of mild cognitive impairment—what do we tell our patients?. Nat Clin Pract Neurol 3 (2): 60–1. PMID 17279076. doi:10.1038/ncpneuro0402.
- Grundman M, Petersen RC, Ferris SH, Thomas RG, Aisen PS, Bennett DA, Foster NL, Jack CR, Galasko DR, Doody R, Kaye J, Sano M, Mohs R, Gauthier S, Kim HT, Jin S, Schultz AN, Schafer K, Mulnard R, van Dyck CH, Mintzer J, Zamrini EY, Cahn-Weiner D, Thal LJ (January 2004). Mild cognitive impairment can be distinguished from Alzheimer disease and normal aging for clinical trials. Archives of Neurology 61 (1): 59–66. PMID 14732621. doi:10.1001/archneur.61.1.59.
- Förstl H, Kurz A (1999). Clinical features of Alzheimer's disease. European Archives of Psychiatry and Clinical Neuroscience 249 (6): 288–290. PMID 10653284.
- Carlesimo GA, Oscar-Berman M (June 1992). Memory deficits in Alzheimer's patients: a comprehensive review. Neuropsychol Rev 3 (2): 119–69. PMID 1300219.
- Jelicic M, Bonebakker AE, Bonke B (1995). Implicit memory performance of patients with Alzheimer's disease: a brief review. International Psychogeriatrics 7 (3): 385–392. PMID 8821346. doi:10.1017/S1041610295002134.
- Frank EM (September 1994). Effect of Alzheimer's disease on communication function. J S C Med Assoc 90 (9): 417–23. PMID 7967534.
- Becker JT, Overman AA (2002). [The semantic memory deficit in Alzheimer's disease]. Rev Neurol (Spanish; Castilian) 35 (8): 777–83. PMID 12402233.
- Hodges JR, Patterson K (April 1995). Is semantic memory consistently impaired early in the course of Alzheimer's disease? Neuroanatomical and diagnostic implications. Neuropsychologia 33 (4): 441–59. PMID 7617154.
- Benke T (December 1993). Two forms of apraxia in Alzheimer's disease. Cortex 29 (4): 715–25. PMID 8124945.
- Forbes KE, Shanks MF, Venneri A (March 2004). The evolution of dysgraphia in Alzheimer's disease. Brain Res. Bull. 63 (1): 19–24. PMID 15121235. doi:10.1016/j.brainresbull.2003.11.005.
- Galasko D, Schmitt F, Thomas R, Jin S, Bennett D (2005). Detailed assessment of activities of daily living in moderate to severe Alzheimer's disease. Journal of the International Neuropsychology Society 11 (4): 446–453. PMID 16209425.
- Galasko D, Schmitt F, Thomas R, Jin S, Bennett D (July 2005). Detailed assessment of activities of daily living in moderate to severe Alzheimer's disease. J Int Neuropsychol Soc 11 (4): 446–53. PMID 16209425.
- Sartori G, Snitz BE, Sorcinelli L, Daum I (September 2004). Remote memory in advanced Alzheimer's disease. Arch Clin Neuropsychol 19 (6): 779–89. PMID 15288331. doi:10.1016/j.acn.2003.09.007.
- Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (May 2001). Sundowning and circadian rhythms in Alzheimer's disease. Am J Psychiatry 158 (5): 704–11. PMID 11329390. Процитовано 27 серпня 2008.
- Neuropsychiatric symptoms: *Scarmeas N, Brandt J, Blacker D, et al (December 2007). Disruptive behavior as a predictor in Alzheimer disease. Arch. Neurol. 64 (12): 1755–61. PMID 18071039. doi:10.1001/archneur.64.12.1755. *Tatsch MF, Bottino CM, Azevedo D, et al (May 2006). Neuropsychiatric symptoms in Alzheimer disease and cognitively impaired, nondemented elderly from a community-based sample in Brazil: prevalence and relationship with dementia severity. Am J Geriatr Psychiatry 14 (5): 438–45. PMID 16670248. doi:10.1097/01.JGP.0000218218.47279.db. *Volicer L, Bass EA, Luther SL (October 2007). Agitation and resistiveness to care are two separate behavioral syndromes of dementia. J Am Med Dir Assoc 8 (8): 527–32. PMID 17931577. doi:10.1016/j.jamda.2007.05.005.
- Gold DP, Reis MF, Markiewicz D, Andres D (January 1995). When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia. J Am Geriatr Soc 43 (1): 10–6. PMID 7806732.
- Bär M, Kruse A, Re S (December 2003). [Situations of emotional significance in residents suffering from dementia]. Z Gerontol Geriatr (German) 36 (6): 454–62. PMID 14685735. doi:10.1007/s00391-003-0191-0.
- Souren LE, Franssen EH, Reisberg B (June 1995). Contractures and loss of function in patients with Alzheimer's disease. J Am Geriatr Soc 43 (6): 650–5. PMID 7775724.
- Berkhout AM, Cools HJ, van Houwelingen HC (September 1998). The relationship between difficulties in feeding oneself and loss of weight in nursing-home patients with dementia. Age Ageing 27 (5): 637–41. PMID 12675103.
- Wada H, Nakajoh K, Satoh-Nakagawa T, et al (2001). Risk factors of aspiration pneumonia in Alzheimer's disease patients. Gerontology 47 (5): 271–6. PMID 11490146.
- Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (July 1999). Predictors of mortality in patients with Alzheimer's disease living in nursing homes. J. Neurol. Neurosurg. Psychiatr. 67 (1): 59–65. PMC 1736445. PMID 10369823.
- Wenk GL (2003). Neuropathologic changes in Alzheimer's disease. J Clin Psychiatry. 64 Suppl 9: 7–10. PMID 12934968.
- Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (June 2004). The importance of neuritic plaques and tangles to the development and evolution of AD. Neurology 62 (11): 1984–9. PMID 15184601.
- Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital. Cereb. Cortex 4 (2): 138–50. PMID 8038565.
- Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer's and Parkinson's diseases. Neuromolecular Med. 4 (1–2): 21–36. PMID 14528050. doi:10.1385/NMM:4:1-2:21.
- Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (July 2006). Synapse formation and function is modulated by the amyloid precursor protein. J. Neurosci. 26 (27): 7212–21. PMID 16822978. doi:10.1523/JNEUROSCI.1450-06.2006.
- Turner PR, O'Connor K, Tate WP, Abraham WC (May 2003). Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory. Prog. Neurobiol. 70 (1): 1–32. PMID 12927332.
- Hooper NM (April 2005). Roles of proteolysis and lipid rafts in the processing of the amyloid precursor protein and prion protein. Biochem. Soc. Trans. 33 (Pt 2): 335–8. PMID 15787600. doi:10.1042/BST0330335.
- Ohnishi S, Takano K (March 2004). Amyloid fibrils from the viewpoint of protein folding. Cell. Mol. Life Sci. 61 (5): 511–24. PMID 15004691. doi:10.1007/s00018-003-3264-8.
- Hernández F, Avila J (September 2007). Tauopathies. Cell. Mol. Life Sci. 64 (17): 2219–33. PMID 17604998. doi:10.1007/s00018-007-7220-x.
- Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). Current insights into molecular mechanisms of Alzheimer disease and their implications for therapeutic approaches. Neurodegener Dis 4 (5): 349–65. PMID 17622778. doi:10.1159/000105156.
- Yankner BA, Duffy LK, Kirschner DA (October 1990). Neurotrophic and neurotoxic effects of amyloid beta protein: reversal by tachykinin neuropeptides. Science (journal) 250 (4978): 279–82. PMID 2218531.
- Chen X, Yan SD (December 2006). Mitochondrial Abeta: a potential cause of metabolic dysfunction in Alzheimer's disease. IUBMB Life 58 (12): 686–94. PMID 17424907. doi:10.1080/15216540601047767.
- Greig NH, Mattson MP, Perry T, et al (December 2004). New therapeutic strategies and drug candidates for neurodegenerative diseases: p53 and TNF-alpha inhibitors, and GLP-1 receptor agonists. Ann. N. Y. Acad. Sci. 1035: 290–315. PMID 15681814. doi:10.1196/annals.1332.018.
- Waring SC, Rosenberg RN (March 2008). Genome-wide association studies in Alzheimer disease. Arch. Neurol. 65 (3): 329–34. PMID 18332245. doi:10.1001/archneur.65.3.329.
- Hoenicka J (2006 March 1–15). Genes in Alzheimer's disease. Rev Neurol 42 (5): 302–05. PMID 16538594.
- Campion D, Dumanchin C, Hannequin D, et al (September 1999). Early-onset autosomal dominant Alzheimer disease: prevalence, genetic heterogeneity, and mutation spectrum. Am. J. Hum. Genet. 65 (3): 664–70. PMC 1377972. PMID 10441572. doi:10.1086/302553.
- Selkoe DJ (June 1999). Translating cell biology into therapeutic advances in Alzheimer's disease. Nature 399 (6738 Suppl): A23–31. PMID 10392577.
- Strittmatter WJ, Saunders AM, Schmechel D, et al (March 1993). Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease. Proc. Natl. Acad. Sci. USA 90 (5): 1977–81. PMC 46003. PMID 8446617.
- Seripa D, Matera MG, Franceschi M, et al (July 2008). The RELN locus in Alzheimer's disease. J Alzheimers Dis. 14 (3): 335–44. PMID 18599960.
- Mendez MF (2006). The accurate diagnosis of early-onset dementia. International Journal of Psychiatry Medicine 36 (4): 401–412. PMID 17407994.
- Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (November 2006). Therapeutic approaches to Alzheimer's disease. Brain 129 (Pt 11): 2840–55. PMID 17018549. doi:10.1093/brain/awl280.
- Dementia: Quick reference guide (PDF). London: (UK) National Institute for Health and Clinical Excellence. November 2006. ISBN 1-84629-312-X. Архів оригіналу за 25 серпня 2011. Процитовано 22 лютого 2008.
- McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (July 1984). Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology 34 (7): 939–44. PMID 6610841.
- Dubois B, Feldman HH, Jacova C, et al (August 2007). Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria. Lancet Neurol 6 (8): 734–46. PMID 17616482. doi:10.1016/S1474-4422(07)70178-3.
- Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (December 1994). Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative. Arch. Neurol. 51 (12): 1198–204. PMID 7986174.
- American Psychiatric Association (2000). Diagnostic and statistical manual of mental disorders: DSM-IV-TR (вид. 4th Edition Text Revision). Washington DC: American Psychiatric Association. ISBN 0890420254.
- Ito N (May 1996). [Clinical aspects of dementia]. Hokkaido Igaku Zasshi (Japanese) 71 (3): 315–20. PMID 8752526.
- Tombaugh TN, McIntyre NJ (September 1992). The mini-mental state examination: a comprehensive review. J Am Geriatr Soc 40 (9): 922–35. PMID 1512391.
- Pasquier F (January 1999). Early diagnosis of dementia: neuropsychology. J. Neurol. 246 (1): 6–15. PMID 9987708.
- Harvey PD, Moriarty PJ, Kleinman L, et al (2005). The validation of a caregiver assessment of dementia: the Dementia Severity Scale. Alzheimer Dis Assoc Disord 19 (4): 186–94. PMID 16327345.
- Antoine C, Antoine P, Guermonprez P, Frigard B (2004). [Awareness of deficits and anosognosia in Alzheimer's disease.]. Encephale (French) 30 (6): 570–7. PMID 15738860.
- Cruz VT, Pais J, Teixeira A, Nunes B (2004). [The initial symptoms of Alzheimer disease: caregiver perception]. Acta Med Port (Portuguese) 17 (6): 435–44. PMID 16197855.
- Clarfield AM (October 2003). The decreasing prevalence of reversible dementias: an updated meta-analysis. Arch. Intern. Med. 163 (18): 2219–29. PMID 14557220. doi:10.1001/archinte.163.18.2219.
- Geldmacher DS, Whitehouse PJ (May 1997). Differential diagnosis of Alzheimer's disease. Neurology 48 (5 Suppl 6): S2–9. PMID 9153154.
- Potter GG, Steffens DC (May 2007). Contribution of depression to cognitive impairment and dementia in older adults. Neurologist 13 (3): 105–17. PMID 17495754. doi:10.1097/01.nrl.0000252947.15389.a9.
- Bonte FJ, Harris TS, Hynan LS, Bigio EH, White CL (July 2006). Tc-99m HMPAO SPECT in the differential diagnosis of the dementias with histopathologic confirmation. Clin Nucl Med 31 (7): 376–8. PMID 16785801. doi:10.1097/01.rlu.0000222736.81365.63.
- Dougall NJ, Bruggink S, Ebmeier KP (2004). Systematic review of the diagnostic accuracy of 99mTc-HMPAO-SPECT in dementia. Am J Geriatr Psychiatry 12 (6): 554–70. PMID 15545324. doi:10.1176/appi.ajgp.12.6.554.
- PiB PET:
- Kemppainen NM, Aalto S, Karrasch M, et al (January 2008). Cognitive reserve hypothesis: Pittsburgh Compound B and fluorodeoxyglucose positron emission tomography in relation to education in mild Alzheimer's disease. Ann. Neurol. 63 (1): 112–8. PMID 18023012. doi:10.1002/ana.21212.
- Ikonomovic MD, Klunk WE, Abrahamson EE, et al (June 2008). Post-mortem correlates of in vivo PiB-PET amyloid imaging in a typical case of Alzheimer's disease. Brain 131 (Pt 6): 1630–45. PMC 2408940. PMID 18339640. doi:10.1093/brain/awn016.
- Jack CR, Lowe VJ, Senjem ML, et al (March 2008). 11C PiB and structural MRI provide complementary information in imaging of Alzheimer's disease and amnestic mild cognitive impairment. Brain 131 (Pt 3): 665–80. PMID 18263627. doi:10.1093/brain/awm336.
- Marksteiner J, Hinterhuber H, Humpel C (June 2007). Cerebrospinal fluid biomarkers for diagnosis of Alzheimer's disease: beta-amyloid(1-42), tau, phospho-tau-181 and total protein. Drugs Today 43 (6): 423–31. PMID 17612711. doi:10.1358/dot.2007.43.6.1067341.
- Новий аналіз крові виявляє хворобу Альцгеймера за 20 років до перших симптомів. Tokar.ua. 8 серпня 2019. Процитовано 9 серпня 2019.
- Bruce A. Kimball, Donald A. Wilson & Daniel W. Wesson. Alterations of the volatile metabolome in mouse models of Alzheimer's disease // Scientific Reports 6. Article number: 19495 (2016). Received: 23 June 2015. Published online: 14 January 2016
- How the smell of your urine could help diagnose dementia: Unique odor 'appears before Alzheimer's disease sets in' // Daily Mail Online, By Lisa Ryan. Published: 18:48 GMT, 14 January 2016
- Болезнь Альцгеймера научились определять по запаху // Наука, N+1 nplus1.ru, 10:38 15 Янв. 2016
- Медики разработали уникальный тест, выявляющий болезнь Альцгеймера // MEDdaily — новости медицины и медицинских технологий. Комментарии специалистов. Архив материалов. 15 января 2016
- Geula C, Mesulam MM (1995). Cholinesterases and the pathology of Alzheimer disease. Alzheimer Dis Assoc Disord. 9 Suppl 2: 23–28. PMID 8534419.
- Stahl SM (2000). The new cholinesterase inhibitors for Alzheimer's disease, Part 2: illustrating their mechanisms of action. J Clin Psychiatry 61 (11): 813–814. PMID 11105732.
- Donepezil. US National Library of Medicine (Medline Plus). 8 січня 2007. Архів оригіналу за 25 серпня 2011. Процитовано 20 березня 2008.
- Galantamine. US National Library of Medicine (Medline Plus). 8 січня 2007. Архів оригіналу за 25 серпня 2011. Процитовано 20 березня 2008.
- Rivastigmine. US National Library of Medicine (Medline Plus). 8 січня 2007. Архів оригіналу за 25 серпня 2011. Процитовано 20 березня 2008.
- Rivastigmine Transdermal. US National Library of Medicine (Medline Plus). 8 січня 2007. Архів оригіналу за 25 серпня 2011. Процитовано 20 березня 2008.
- Birks J (2006). Cholinesterase inhibitors for Alzheimer's disease. Cochrane Database Syst Rev (1): CD005593. PMID 16437532. doi:10.1002/14651858.CD005593.
- Birks J, Harvey RJ (2006). Donepezil for dementia due to Alzheimer's disease. Cochrane Database Syst Rev (1): CD001190. PMID 16437430. doi:10.1002/14651858.CD001190.pub2.
- Raschetti R, Albanese E, Vanacore N, Maggini M (2007). Cholinesterase inhibitors in mild cognitive impairment: a systematic review of randomised trials. PLoS Med 4 (11): e338. PMID 18044984. doi:10.1371/journal.pmed.0040338.
- Acetylcholinesterase inhibitors prescribing information:
- Aricept Prescribing information (PDF). Eisai and Pfizer. Архів оригіналу за 10 вересня 2008. Процитовано 18 серпня 2008.
- Razadyne ER U.S. Full Prescribing Information (PDF). Ortho-McNeil Neurologics. Архів оригіналу за 27 лютого 2008. Процитовано 19 лютого 2008.
- Exelon ER U.S. Prescribing Information (PDF). Novartis Pharmaceuticals. Архів оригіналу за 25 серпня 2011. Процитовано 19 лютого 2008.
- Exelon U.S. Prescribing Information (PDF). Novartis Pharmaceuticals. Архів оригіналу за 10 липня 2007. Процитовано 21 лютого 2008.
- Exelon Warning Letter (PDF). FDA. Архів оригіналу за 10 вересня 2008. Процитовано 5 квітня 2011.
- Lipton SA (2006). Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond. Nat Rev Drug Discov 5 (2): 160–170. PMID 16424917. doi:10.1038/nrd1958.
- Memantine. US National Library of Medicine (Medline). 4 січня 2004. Архів оригіналу за 25 серпня 2011. Процитовано 22 березня 2008.
- Areosa Sastre A, McShane R, Sherriff F (2004). Memantine for dementia. Cochrane Database Syst Rev (4): CD003154. PMID 15495043. doi:10.1002/14651858.CD003154.pub2.
- Namenda Prescribing Information (PDF). Forest Pharmaceuticals. Архів оригіналу за 25 серпня 2011. Процитовано 19 лютого 2008.
- Raina P, Santaguida P, Ismaila A, et al (2008). Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline. Annals of Internal Medicine 148 (5): 379–397. PMID 18316756.
- Antipsychotics use:
- Ballard C, Waite J (2006). The effectiveness of atypical antipsychotics for the treatment of aggression and psychosis in Alzheimer's disease. Cochrane Database Syst Rev (1): CD003476. PMID 16437455. doi:10.1002/14651858.CD003476.pub2.
- Ballard C, Lana MM, Theodoulou M, et al (2008). A Randomised, Blinded, Placebo-Controlled Trial in Dementia Patients Continuing or Stopping Neuroleptics (The DART-AD Trial). PLoS Med. 5 (4): e76. PMID 18384230. doi:10.1371/journal.pmed.0050076.
- Sink KM, Holden KF, Yaffe K (2005). Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence. JAMA 293 (5): 596–608. PMID 15687315. doi:10.1001/jama.293.5.596.
- Ballard C, Hanney ML, Theodoulou M, Douglas S, McShane R, Kossakowski K, Gill R, Juszczak E, Yu L-M, Jacoby R (9 січня 2009). The dementia antipsychotic withdrawal trial (DART-AD): long-term follow-up of a randomised placebo-controlled trial. Lancet Neurology. PMID 19138567. doi:10.1016/S1474-4422(08)70295-3. Загальний огляд.
- Prevention recommendations not supported:
- Kawas CH (2006). Medications and diet: protective factors for AD?. Alzheimer Dis Assoc Disord 20 (3 Suppl 2): S89–96. PMID 16917203.
- Luchsinger JA, Mayeux R (2004). Dietary factors and Alzheimer's disease. Lancet Neurol 3 (10): 579–87. PMID 15380154. doi:10.1016/S1474-4422(04)00878-6.
- Luchsinger JA, Noble JM, Scarmeas N (2007). Diet and Alzheimer's disease. Curr Neurol Neurosci Rep 7 (5): 366–72. PMID 17764625. doi:10.1007/s11910-007-0057-8.
- Szekely CA, Breitner JC, Zandi PP (2007). Prevention of Alzheimer's disease. Int Rev Psychiatry 19 (6): 693–706. PMID 18092245. doi:10.1080/09540260701797944.
- Mediterranean diet:
- Scarmeas N, Stern Y, Mayeux R, Luchsinger JA (2006). Mediterranean diet, Alzheimer disease, and vascular mediation. Arch. Neurol. 63 (12): 1709–1717. PMID 17030648. doi:10.1001/archneur.63.12.noc60109.
- Scarmeas N, Luchsinger JA, Mayeux R, Stern Y (2007). Mediterranean diet and Alzheimer disease mortality. Neurology 69 (11): 1084–93. PMID 17846408. doi:10.1212/01.wnl.0000277320.50685.7c.
- Barberger-Gateau P, Raffaitin C, Letenneur L, Berr C, Tzourio C, Dartigues JF, Alpérovitch A (2007). Dietary patterns and risk of dementia: the Three-City cohort study. Neurology 69 (20): 1921–1930. PMID 17998483. doi:10.1212/01.wnl.0000278116.37320.52.
- Dai Q, Borenstein AR, Wu Y, Jackson JC, Larson EB (2006). Fruit and vegetable juices and Alzheimer's disease: the Kame Project. American Journal of Medicine 119 (9): 751–759. PMID 16945610. doi:10.1016/j.amjmed.2006.03.045.
- Savaskan E, Olivieri G, Meier F, Seifritz E, Wirz-Justice A, Müller-Spahn F (2003). Red wine ingredient resveratrol protects from beta-amyloid neurotoxicity. Gerontology 49 (6): 380–383. PMID 14624067. doi:10.1159/000073766.
- Vitamins prevent:
- Morris MC, Schneider JA, Tangney CC (2006). Thoughts on B-vitamins and dementia. J. Alzheimers Dis. 9 (4): 429–33. PMID 16917152.
- Landmark K (2006). [Could intake of vitamins C and E inhibit development of Alzheimer dementia?]. Tidsskr. Nor. Laegeforen. (Norwegian) 126 (2): 159–61. PMID 16415937.
- Luchsinger JA, Tang MX, Miller J, Green R, Mayeux R (2007). Relation of higher folate intake to lower risk of Alzheimer disease in the elderly. Arch. Neurol. 64 (1): 86–92. PMID 17210813. doi:10.1001/archneur.64.1.86.
- Morris MC, Evans DA, Bienias JL, et al (August 2004). Dietary niacin and the risk of incident Alzheimer's disease and of cognitive decline. J. Neurol. Neurosurg. Psychiatr. 75 (8): 1093–9. PMC 1739176. PMID 15258207. doi:10.1136/jnnp.2003.025858.
- Vitamins do not prevent:
- Morris MC, Evans DA, Schneider JA, Tangney CC, Bienias JL, Aggarwal NT (2006). Dietary folate and vitamins B-12 and B-6 not associated with incident Alzheimer's disease. J. Alzheimers Dis. 9 (4): 435–43. PMID 16917153.
- Malouf M, Grimley EJ, Areosa SA (2003). Folic acid with or without vitamin B12 for cognition and dementia. Cochrane Database Syst Rev (4): CD004514. PMID 14584018. doi:10.1002/14651858.CD004514.
- Sun Y, Lu CJ, Chien KL, Chen ST, Chen RC (2007). Efficacy of multivitamin supplementation containing vitamins B6 and B12 and folic acid as adjunctive treatment with a cholinesterase inhibitor in Alzheimer's disease: a 26-week, randomised, double-blind, placebo-controlled study in Taiwanese patients. Clin Ther 29 (10): 2204–14. PMID 18042476. doi:10.1016/j.clinthera.2007.10.012.
- Boothby LA, Doering PL (2005). Vitamin C and vitamin E for Alzheimer's disease. Ann Pharmacother 39 (12): 2073–80. PMID 16227450. doi:10.1345/aph.1E495.
- Gray SL, Anderson ML, Crane PK, Breitner JC, McCormick W, Bowen JD, Teri L, Larson E (2008). Antioxidant vitamin supplement use and risk of dementia or Alzheimer's disease in older adults. J Am Geriatr Soc 56 (2): 291–295. PMID 18047492. doi:10.1111/j.1532-5415.2007.01531.x.
- Curcumin in diet:
- Garcia-Alloza M, Borrelli LA, Rozkalne A, Hyman BT, Bacskai BJ (2007). Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model. Journal of Neurochemistry 102 (4): 1095–1104. PMID 17472706. doi:10.1111/j.1471-4159.2007.04613.x.
- Lim GP, Chu T, Yang F, Beech W, Frautschy SA, Cole GM (2001). The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse. Journal of Neuroscience 21 (21): 8370–8377. PMID 11606625.
- Rosendorff C, Beeri MS, Silverman JM (2007). Cardiovascular risk factors for Alzheimer's disease. Am J Geriatr Cardiol 16 (3): 143–9. PMID 17483665.
- Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD (February 2008). Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease. CMAJ 178 (5): 548–56. PMC 2244657. PMID 18299540. doi:10.1503/cmaj.070796.
- Reiss AB, Wirkowski E (2007). Role of HMG-CoA reductase inhibitors in neurological disorders : progress to date. Drugs 67 (15): 2111–20. PMID 17927279.
- Kuller LH (August 2007). Statins and dementia. Curr Atheroscler Rep 9 (2): 154–61. PMID 17877925.
- Szekely CA, Breitner JC, Fitzpatrick AL, et al (January 2008). NSAID use and dementia risk in the Cardiovascular Health Study: role of APOE and NSAID type. Neurology 70 (1): 17–24. PMID 18003940. doi:10.1212/01.wnl.0000284596.95156.48.
- Craig MC, Murphy DG (October 2007). Estrogen: effects on normal brain function and neuropsychiatric disorders. Climacteric. 10 Suppl 2: 97–104. PMID 17882683. doi:10.1080/13697130701598746.
- Mori K, Takeda M (September 2007). [Hormone replacement Up-to-date. Hormone replacement therapy and brain function]. Clin Calcium (Japanese) 17 (9): 1349–54. PMID 17767023.
- Birks J, Grimley Evans J (2007). Ginkgo biloba for cognitive impairment and dementia. Cochrane Database Syst Rev (2): CD003120. PMID 17443523. doi:10.1002/14651858.CD003120.pub2. Процитовано 22 лютого 2008.[недоступне посилання з травня 2019]
- DeKosky ST, Williamson JD, Fitzpatrick AL et al. (2008). Ginkgo biloba for Prevention of Dementia. Journal of the American Medical Association 300 (19): 2253–2262. Процитовано 18 листопада 2008.
- Verghese J, Lipton RB, Katz MJ, et al (June 2003). Leisure activities and the risk of dementia in the elderly. N. Engl. J. Med. 348 (25): 2508–16. PMID 12815136. doi:10.1056/NEJMoa022252.
- Bennett DA, Schneider JA, Tang Y, Arnold SE, Wilson RS (2006). The effect of social networks on the relation between Alzheimer's disease pathology and level of cognitive function in old people: a longitudinal cohort study. Lancet Neurol 5 (5): 406–412. PMID 16632311. doi:10.1016/S1474-4422(06)70417-3.
- Bialystok E, Craik FIM, Freedman M (2007). Bilingualism as a protection against the onset of symptoms of dementia. Neuropsychologia 42 (2): 459–464. doi:10.1016/j.neuropsychologia.2006.10.009.
- Davanipour Z, Tseng CC, Lee PJ, Sobel E (2007). A case-control study of occupational magnetic field exposure and Alzheimer's disease: results from the California Alzheimer's Disease Diagnosis and Treatment Centers. BMC Neurol 7: 13. PMC 1906833. PMID 17559686. doi:10.1186/1471-2377-7-13.
- Qiu C, Fratiglioni L, Karp A, Winblad B, Bellander T (November 2004). Occupational exposure to electromagnetic fields and risk of Alzheimer's disease. Epidemiology 15 (6): 687–94. PMID 15475717. Архів оригіналу за 24 травня 2013. Процитовано 22 вересня 2008.
- Shcherbatykh I, Carpenter DO (May 2007). The role of metals in the etiology of Alzheimer's disease. J. Alzheimers Dis. 11 (2): 191–205. PMID 17522444.
- Rondeau V, Commenges D, Jacqmin-Gadda H, Dartigues JF (July 2000). Relation between aluminum concentrations in drinking water and Alzheimer's disease: an 8-year follow-up study. Am. J. Epidemiol. 152 (1): 59–66. PMC 2215380. PMID 10901330.
- Kukull WA, Larson EB, Bowen JD, et al (June 1995). Solvent exposure as a risk factor for Alzheimer's disease: a case-control study. Am. J. Epidemiol. 141 (11): 1059–71; discussion 1072–9. PMID 7771442.
- Santibáñez M, Bolumar F, García AM (2007). Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies. Occupational and Environmental Medicine 64 (11): 723–732. PMID 17525096. doi:10.1136/oem.2006.028209.
- Seidler A, Geller P, Nienhaus A, et al (February 2007). Occupational exposure to low frequency magnetic fields and dementia: a case-control study. Occup Environ Med 64 (2): 108–14. PMID 17043077. doi:10.1136/oem.2005.024190.
- Rondeau V (2002). A review of epidemiologic studies on aluminum and silica in relation to Alzheimer's disease and associated disorders. Rev Environ Health 17 (2): 107–21. PMID 12222737.
- Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF (May 1997). Aluminum concentrations in drinking water and risk of Alzheimer's disease. Epidemiology 8 (3): 281–6. PMID 9115023.
- Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB (September 1998). Occupational exposures to solvents and aluminium and estimated risk of Alzheimer's disease. Occup Environ Med 55 (9): 627–33. PMC 1757634. PMID 9861186.
Джерела
- Ю. Г. Каминский, Е. А. Косенко Популярно и не очень о болезни Альцгеймера. Либроком, 2009 г., 136 стр. ISBN 978-5-397-00194-6
- Билл Грант. Старческое слабоумие. Болезнь Альцгеймера и другие формы. Alzheimer's Disease. A Carer's Guide Серия: Советы врача Норинт, 2003 г., 80 стр. ISBN 5-7711-0161-3
- Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B (2002). Guidelines for managing Alzheimer's disease: Part I. Assessment. American Family Physician 65 (11): 2263–2272. PMID 12074525.
- Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B (2002). Guidelines for managing Alzheimer's disease: Part II. Treatment. American Family Physician 65 (12): 2525–2534. PMID 12086242.
- Genes, lifestyles, and crossword puzzles: Can Alzheimer's disease be prevented? (PDF). US Department of Health and Human Services, National Institute on Aging. Архів оригіналу за 25 серпня 2011. Процитовано 29 лютого 2008.
- Russell D, Barston S, White M (19 грудня 2007). Alzheimer’s Behavior Management: Learn to manage common behavior problems. helpguide.org. Архів оригіналу за 25 серпня 2011. Процитовано 29 лютого 2008.
- Rodgers AB (2003). Alzheimer's Disease: Unraveling the Mystery. National Institute on Aging. Архів оригіналу за 1 жовтня 2008. Процитовано 22 серпня 2008.
Література
- Альцгеймер — не вирок! ReCODE: перша програма лікування й профілактики спаду когнітивних функцій / Д. Бредесен ; з англ. пер. О. Бершадська. — Київ: BookChef: Форс Україна, 2018. — 320 с. + 16 с. Додатки. — ISBN 617-7559-29-9.
