Адалімумаб
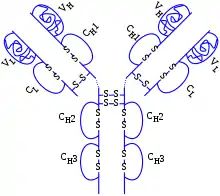
Адалімумаб (англ. Adalimumab, лат. Adalimumabum) — синтетичний препарат, який є генно-інженерним моноклональним антитілом проти фактору некрозу пухлини, який за своєю хімічною структурою повністю ідентичний до людського імуноглобуліну IgG1.[1][2] Адалімумаб застосовується підшкірно[3], рідше внутрішньовенно.
 | |
|---|---|
Адалімумаб
| |
| Систематизована назва за IUPAC | |
| рекомбінантні IgG1 моноклональні антитіла до фактору некрозу пухлини | |
| Класифікація | |
| ATC-код | L04 |
| PubChem | |
| CAS | |
| DrugBank | |
| Хімічна структура | |
| Формула | C6428H9912N1694O1987S46 |
| Мол. маса | 40000 г/моль |
| Фармакокінетика | |
| Біодоступність | 64% |
| Метаболізм | НД |
| Період напіввиведення | 14 діб |
| Екскреція | НД |
| Реєстрація лікарського засобу в Україні | |
| Назва, фірма-виробник, країна, номер реєстрації, дата | Хуміра®, «Веттер Фарма-Фертігунг ГмбХ і Ко. КГ»/«Еббві Дойчленд ГмбХ і Ко. КГ»/«Еббві Біотекнолоджі ГмбХ», Німеччина UA/13612/01/01 29.04.2014-29/04/2019 |
Історія
Адалімумаб став першим людським моноклональним антитілом, який розпочав використовуватися у клінічній практиці. Він був розроблений методом фагового дисплею[4], та досліджувався у співпраці між «BASF Bioresearch Corporation» (підрозділ корпорації BASF, розміщений у Вустері, штат Массачусетс) та британською компанією «Cambridge Antibody Technology», і початково мав назву D2E7.[5] Дослідження препарату розпочались у 1993 році. Пізніше дослідження препарату проводила самостійно «BASF Bioresearch Corporation» та її підрозділ «BASF Knoll» (пізніше «BASF Pharma»), надалі права на адалімумаб передані компанії «Abbott Laboratories», підрозділ якої «AbbVie» і розпочав випуск адалімумабу під торговою назвою «Гуміра». Торгова назва походить від перших літер у англійських словах «human monoclonal antibody in rheumatoid arthritis» («людські моноклональні антитіла при ревматоїдному артриті»). Адалімумаб розроблений на основі виключно людських антитіл проти фактору некрозу пухлини-альфа[6], та після кількох клінічних досліджень[5][7][8][9], адалімумаб був схвалений FDA для лікування ревматоїдного артриту у 2002 році.[8] Із 2008 року він також схвалений для лікування псоріатичного артриту[10], анкілозуючого спондилоартриту[11], ювенільного артриту[12], хвороби Крона[13] та неспецифічного виразкового коліту.[14] У 2014 році індійська фармацевтична компанія «Cadila Healthcare» вивела на фармацевтичний ринок США біологічний аналог адалімумабу[15][16], пізніше на фармацевтичний ринок вийшли біоаналоги адалімумабу компаній «Torrent Pharmaceuticals»[17], «Amgen»[18][19] та «Boehringer Ingelheim».[20]
Фармакологічні властивості
Адалімумаб — синтетичний лікарський препарат, який є генно-інженерним моноклональним антитілом проти фактору некрозу пухлини-альфа, який за своєю хімічною структурою повністю ідентичний людському імуноглобуліну IgG1.[2][3] Механізм дії препарату полягає у зв'язуванні адалімумабу як із розчинними, так і з мембраноасоційованими формами фактору некрозу пухлини, що призводить до зниження його функціональної активності.[1] Оскільки ФНП може спричинити запуск хронічного запального процесу, та сприяє розвитку різноманітних автоімунних захворювань, то застосування адалімумабу блокує активність фактору некрозу пухлини та спричинює розрив ланцюга реакцій хронічного запалення, що призводить до зупинки розвитку патологічного процесу та покращення стану хворого.[2][3] Адалімумаб також знижує концентрацію в крові інтерлейкіну−6, С-реактивного білку, матриксних металопротеїназ, та інших індукторів запалення, а також знижує ШОЕ.[1][2] Адалімумаб застосовується при системних та автоімунних захворюваннях: ревматоїдному артриті[3][1] (у тому числі у вигляді монотерапії, без використання метотрексату)[2], анкілозуючому спондилоартриті[21], псоріатичному артриті[10], хворобі Крона[22], неспецифічному виразковому коліті[14] та при ювенільному артриті.[23] Досліджуються нові показання препарату — при гнійному гідраденіті при неефективності стандартної терапії[24], та при увеїті.[25] Хоча адалімумаб і не рекомендований при застосуванні під час вагітності, при його застосуванні у вагітних не спостерігається збільшення несприятливих результатів вагітності або виникнення вад розвитку в дітей.[26] Застосування адалімумаба, щоправда, може супроводжуватися реактивацією латентної туберкульозної інфекції, тому перед початком його застосування необхідно ретельне обстеження хворих на наявність туберкульозної інфекції.[3][23]
Фармакокінетика
Адалімумаб повільно всмоктується та розподіляється в організмі після підшкірного застосування, біодоступність препарату становить 64 %. Максимальна концентрація препарату в крові досягається протягом 5 діб після ін'єкції. Найвищі концентрації препарату спостерігаються у синовіальній рідині (від 31 до 96 % концентрації адалімумабу в сироватці крові). Шляхи метаболізму та виведення препаратуу з організму не визначені. Період напіввиведення адалімумабу з організму становить у середньому 14 діб, і цей час не змінюється при печінковій та нирковій недостатності, а також у хворих різних вікових груп.[1]
Показання до застосування
Адалімумаб застосовується при ревматоїдному артриті (як у комбінації з метотрексатом, так і у вигляді монотерапії), анкілозуючому спондилоартриті, хронічному бляшечному псоріазі та псоріатичному артриті, ювенільному артриті, хворобі Крона та неспецифічному виразковому коліті.[1]
Побічна дія
При застосуванні адалімумабу побічні ефекти спостерігаються часто, найчастішими з них є реакції у місці введення препарату. Серед інших побічних ефектів препарату найчастішими є[1]:
- Алергічні реакції та з боку шкірних покривів — висипання на шкірі, свербіж шкіри, гіпергідроз, еритема або знебарвлення шкіри, зміни з боку нігтів, крововиливи на шкірі, дерматит, грибковий дерматит, кропив'янка, сезонна алергія.
- З боку травної системи — нудота, блювання, біль у животі, сухість у роті, холецистит, панкреатит, шлунково-кишкові кровотечі, порушення функції печінки, гастроезофагеальний рефлюкс, стеатоз печінки.
- З боку нервової системи — головний біль, запаморочення, парестезії, мігрень, тремор, нервозність, сонливість, невралгія сідничного нерва, тривожність, амнезія, депресія, розсіяний склероз, кон'юнктивіт, порушення зору.
- З боку серцево-судинної системи — артеріальна гіпертензія, ціаноз, аритмії, тахікардія, периферичні набряки, тромбофлебіт, аневризма аорти, припливи крові, серцева недостатність
- З боку опорно-рухового апарату — артралгії, міалгії, рабдоміоліз, розвиток системного червоного вовчака.
- З боку дихальної системи — часто кашель, загострення бронхіальної астми, диспное, гострі захворювання верхніх дихальних шляхів; рідше загострення хронічних обструктивних захворювань легень та інтерстиційних хвороб легень.
- З боку сечостатевої системи — гематурія, ніктурія, ниркова недостатність, еректильна дисфункція.
- Інфекційні ускладнення — сепсис, кандидоз, реактивація опортуністичних інфекцій, туберкульоз та інші мікобактеріальні інфекції, герпетичні інфекції та інші бактеріальні, грибкові, вірусні та протозойні інфекції), інфекції верхніх та нижніх дихальних шляхів, абсцеси, пароніхій, целюліт, імпетиго, некротизуючий фасціїт.
- Зміни в лабораторних аналізах — анемія, тромбоцитопенія, лейкоцитоз, лейкопенія, нейтропенія, лімфоцитоз, лімфопенія, агранулоцитоз, панцитопенія, підвищення рівня білірубіну, підвищення активності ферментів печінки.
- Інші побічні ефекти — лімфопроліферативні захворювання, злоякісні пухлини (у тому числі шкіри, щитоподібної залози та молочної залози), утворення аутоантитіл, реакції в місці введення препарату.
Протипокази
Адалімумаб протипоказаний при застосуванні при підвищеній чутливості до препарату, при важких інфекційних процесах (у тому числі туберкульозі), вагітності, годуванні грудьми та застосуванні інших генно-інженерних протиревматичних препаратів (у тому числі анакінра, абатацепт та інші антагоністи фактору некрозу пухлини).[1]
Форми випуску
Адалімумаб випускається у вигляді розчину для підшкірного введення у флаконах по 0,8 мл.[27]
Примітки
- http://www.vidal.ru/drugs/molecule/1785 (рос.)
- Адалимумаб в терапии раннего ревматоидного артрита (рос.)
- Первый опыт применения адалимумаба в России: предварительные результаты 24-недельного открытого исследования (рос.)
- Brekke OH; Sandlie I (Січень 2003). Therapeutic antibodies for human diseases at the dawn of the twenty-first century. Nat Rev Drug Discov 2 (1): 52–62. PMID 12509759. doi:10.1038/nrd984. (англ.)
- Kempeni J (Січень 1999). Preliminary results of early clinical trials with the fully human anti-TNFα monoclonal antibody D2E7. Ann Rheum Dis 58 (suppl 1): I70–2. PMC 1766582. PMID 10577977. doi:10.1136/ard.58.2008.i70. (англ.)
- Jespers LS, Roberts A, Mahler SM, Winter G, Hoogenboom HR (Вересень 1994). Guiding the selection of human antibodies from phage display repertoires to a single epitope of an antigen. Biotechnology (N.Y.) 12 (9): 899–903. PMID 7521646. doi:10.1038/nbt0994-899. (англ.)
- http://www.prnewswire.com/cgi-bin/stories.pl?ACCT=104&STORY=/www/story/11-12-2001/0001613559&EDATE= (англ.)
- Archived copy. Архів оригіналу за 13 січня 2008. Процитовано 27 липня 2009. (англ.)
- Rau R (January 2002). Adalimumab (a fully human anti-tumour necrosis factor α monoclonal antibody) in the treatment of active rheumatoid arthritis: the initial results of five trials. Ann Rheum Dis 61 (Suppl 2): ii70–3. PMC 1766697. PMID 12379628. doi:10.1136/ard.61.suppl_2.ii70. (англ.)
- Клинико-экономический анализ эффективности применения биологических препаратов для лечения псориаза Архівовано 3 лютого 2017 у Wayback Machine. (рос.)
- Maxwell, LJ; Zochling, J; Boonen, A; Singh, JA; Veras, MM; Tanjong Ghogomu, E; Benkhalti Jandu, M; Tugwell, P та ін. (18 квітня 2015). TNF-alpha inhibitors for ankylosing spondylitis.. The Cochrane database of systematic reviews 4: CD005468. PMID 25887212. doi:10.1002/14651858.CD005468.pub2. (англ.)
- В США расширили показания к применению препарата Хумира для лечения полиартикулярного ювенильного идиопатического артрита (рос.)
- В России разрешено использование биопрепарата адалимумаб для лечения болезни Крона у детей (рос.)
- FDA approves Humira to treat ulcerative colitis. U.S. Food and Drug Administration. 28 вересня 2012. (англ.)
- India's Cadila launches first cheaper copy of world's top-selling drug. Reuters. (англ.)
- Exemptia - Adalimumab - Adalimumab Biosimilar - Autoimmune - Rheumatoid Arthritis. exemptia.com. (англ.)
- Torrent launches world's second biosimilar of generic auto-immune drug (англ.)
- В FDA рассмотрят заявку компании Амген на одобрение биоаналога препарата Хумира (англ.)
- FDA approves Amjevita, a biosimilar to Humira. 23 вересня 2016. Процитовано 27 вересня 2016. (англ.)
- Биоаналог компании Берингер Ингельхайм продемонстрировал фармакокинетическую эквивалентность адалимумабу (рос.)
- Анкілозивний спондилоартрит (укр.). lib4.net. Архів оригіналу за 13 травня 2012. Процитовано 13 травня 2012 року.
- Podolsky, Daniel K. (August 2002). Inflammatory bowel disease. N Engl J Med 347 (6): 417–29. PMID 12167685. doi:10.1056/NEJMra020831. (англ.)
- АДАЛИМУМАБ: НОВЫЕ ВОЗМОЖНОСТИ ЛЕЧЕНИЯ ЮВЕНИЛЬНОГО АРТРИТА (рос.)
- Препарат Хумира (адалимумаб) одобрен в Европе для лечения гнойного гидраденита[недоступне посилання з червня 2019] (рос.)
- Адалимумаб эффективен при увеите (рос.)
- АДАЛІМУМАБ
- http://www.vidal.ru/drugs/molecule-in/1785 (рос.)