Акалабрутиніб
Акалабрутиніб англ. Acalabrutinib, лат. Acalabrutinibum) — синтетичний лікарський препарат, який належить до групи інгібіторів інгібіторів протеїнтирозинкінази, та поширюється під торговою назвою «Калькуенс», який застосовується для лікування неходжкінської лімфоми та мантійноклітинної лімфоми.[1] Цей препарат переважно застосовується у хворих, які до цього лікувались іншими препаратами.[2] Станом на 2019 рік не було даних, чи лікування акалабрутинібом було більш ефективним за інші методи лікування.[1]
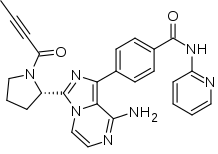 | |
| Систематична назва (IUPAC) | |
| 4-{8-Amino-3-[(2S)-1-(2-butynoyl)-2-pyrrolidinyl]imidazo[1,5-a]pyrazin-1-yl}-N-(2-pyridinyl)benzamide | |
| Ідентифікатори | |
| Номер CAS | |
| Код ATC | L01 |
| PubChem | |
| DrugBank | |
| Хімічні дані | |
| Формула | C26H23N7O2 |
| Мол. маса | 465,517 г/моль |
| SMILES | & |
| Фармакокінетичні дані | |
| Біодоступність | ? |
| Метаболізм | ? |
| Період напіврозпаду | ? |
| Виділення | ? |
| Терапевтичні застереження | |
| Кат. вагітності | |
| Лег. статус | |
| Використання | перорально |
Найчастішими побічними ефектами акалабрутинібу є головний біль, втомлюваність, анемія, тромбоцитопенія і лейкопенія.[1] Акалабрутиніб є інгібітором тирозинкінази Брутона другого покоління.[3][4] Акалабрутиніб інгібує тирозинкіназу Брутона, який приймає участь у рості та підтриманні життєздатності B-лімфоцитів. Інгібування цього ферменту при застосуванні акалабрутинібу може сповільнити збільшення кількості пухлинних В-лімфоцитів, що спричинить сповільнення прогресування злоякісної пухлини.[5]
Акалабрутиніб схвалений до застосування в США в 2017 році[1], та в ЄС у листопаді 2020 року.[5]
Застосування
У ЄС акалабрутиніб застосовується у лікуванні раніше не лікованого хронічного лімфолейкозу в дорослих хворих як у вигляді монотерапії, так і в комбінації з обінітузумабом. Він також застосовується для лікування хронічного лімфолейкозу в дорослих, які отримували принаймні один попередній курс лікування іншими препаратами.[5] У США акалабрутиніб застосовується для лікування мантійноклітинної лімфоми в дорослих хворих, які отримували принаймні одну попередню терапію, та для лікування дорослих з хронічним лімфолейкозом або малою лімфоцитарною лімфомою.[6]
Побічні ефекти
Найпоширенішими побічними ефектами при застосуванні акалабрутинібу є головний біль, діарея та збільшення ваги. Незважаючи на те, що при застосуванні акалабрутинібу частіше спостерігається короткотривалий головний біль, дані клінічних досліджень свідчать про перевагу акалабрутинібу перед ібрутинібом у зв'язку із меншою частотою інших побічних явищ, зокрема шкірного висипу, вираженої діареї та ризику кровотечі.[4]
Суспільство та культура
Правовий статус
Акалабрутиніб схвалений для медичного використання в США в 2017 році[1], та в Європейському Союзі в листопаді 2020 року.[5]
Станом на лютий 2016 року акалабрутиніб отримав статус орфанного препарату в США для лікування мантійноклітинної лімфоми та хронічного лімфолейкозу[7][8], статус орфанного препарату також наданий Європейським агентством з лікарських засобів. Комітет з орфанних лікарських засобів схвалив застосування акалабрутинібу для лікування трьох хвороб: хронічний лімфолейкоз або мала лімфоцитарна лімфома, мантійноклітинна лімфома та макроглобулінемія Вальденстрема.[9][10][11][12] Це схвалення надасть акалабрутинібу 10-річний період ринкової ексклюзивності для зазначених показань у Європі.[13]
Історія створення
Акалабрутиніб уперше синтезований у лабораторії компанії «Acerta Pharma».[14] Після обнадійливих результатів перших клінічних досліджень із застосування препарату при хронічному лімфолейкозі компанія «AstraZeneca» у грудні 2015 року придбала 55 % акцій «Acerta Pharma» за 4 мільярди доларів з можливістю викупу решти 45 % акцій за додаткові 3 мільярди доларів, за умови схвалення препарату як у США, так і в Європі, та появи комерційної вигоди від препарату.[15]
Клінічні дослідження
Порівняно з ібрутинібом, акалабрутиніб продемонстрував вищу селективність та інгібування цільової активності тирозинкінази Брутона, маючи набагато більшу IC50, або практично не пригнічував кіназну активність ITK, EGFR, ERBB2, ERBB4, JAK3, BLK, FGR, FYN, HCK, LCK, LYN, SRC та ТАК1. Крім того, у тромбоцитах, оброблених ібрутинібом, спостерігалось пригнічення утворення тромбу, тоді як у контрольній групі хворих, які отримували акалабрутиніб, не було виявлено ніякого впливу на утворення тромбу. Ці дані настійно вказують на покращений профіль безпеки акалабрутинібу з меншими несприятливими ефектами у порівнянні з ібрутинібом.[4] У доклінічних дослідженнях було показано, що акалабрутиніб є більш потужним і селективним, ніж ібрутиніб, перший у класі інгібіторів тирозинкінази Брутона.[3][4][16]
Проміжні результати триваючого першого клінічного дослідження I та II фази на людях (NCT02029443) акалабрутинібу за участю 61 хворого в лікуванні рецидиву хронічного лімфолейкозу є обнадійливим, із загальним рівнем відповіді 95 %, що дає можливість акалабрутинібу стати найкращим у своєму класі препаратів у лікуванні хронічного лімфолейкозу.[3] Слід зазначити, що 100 % відповідь спостерігалось у тих хворих, які були позитивними щодо делеції гена 17p13.1, підгрупи хворих, у якій зазвичай спостерігається погана реакція на терапію та гірші результати лікування.[4]
Експериментальне застосування при коронавірусній хворобі 2019
У червні 2020 року повідомлено, що проводиться клінічне дослідження щодо можливості застосування препарату для лікування коронавірусної хвороби 2019. За початковими даними дослідження, акалабрутиніб, у зв'язку з тим, що він інгібує тирозинкіназу Брутона, яка може ініціювати так званий цитокіновий шторм, може знизити вираженість запального процесу при коронавірусній хворобі, та зможе запобігти розвитку цитокінового шторму. Попередні результати дослідження у хворих важкою формою коронавірусної хвороби показали зниження рівня інтерлейкіну-6 та C-реактивного білка при застосуванні акалабрутинібу, а також у більшості випадків спостерігалось покращення стану хворих, у тому числі зменшувалась потреба у штучній вентиляції легень.[17][18]
Примітки
- Acalabrutinib Monograph for Professionals. Drugs.com (англ.). Процитовано 16 березня 2019.
- FDA approves new treatment for adults with mantle cell lymphoma. U.S. Food and Drug Administration (прес-реліз). 31 жовтня 2017. Процитовано 28 березня 2020. (англ.)
- Byrd JC, Harrington B, O'Brien S, Jones JA, Schuh A, Devereux S, Chaves J, Wierda WG, Awan FT, Brown JR, Hillmen P, Stephens DM, Ghia P, Barrientos JC, Pagel JM, Woyach J, Johnson D, Huang J, Wang X, Kaptein A, Lannutti BJ, Covey T, Fardis M, McGreivy J, Hamdy A, Rothbaum W, Izumi R, Diacovo TG, Johnson AJ, Furman RR (Січень 2016). Acalabrutinib (ACP-196) in Relapsed Chronic Lymphocytic Leukemia. The New England Journal of Medicine 374 (4): 323–32. PMC 4862586. PMID 26641137. doi:10.1056/NEJMoa1509981. (англ.)
- Wu J, Zhang M, Liu D (Березень 2016). Acalabrutinib (ACP-196): a selective second-generation BTK inhibitor. Journal of Hematology & Oncology 9: 21. PMC 4784459. PMID 26957112. doi:10.1186/s13045-016-0250-9. (англ.)
- Calquence EPAR. European Medicines Agency. 20 липня 2020. Процитовано 11 листопада 2020. (англ.)
- Calquence- acalabrutinib capsule, gelatin coated. DailyMed. 22 листопада 2019. Процитовано 11 листопада 2020. (англ.)
- Acalabrutinib Orphan Drug Designation and Approval. U.S. Food and Drug Administration (FDA). Процитовано 15 квітня 2020. (англ.)
- Acalabrutinib Orphan Drug Designation and Approval. U.S. Food and Drug Administration (FDA). Процитовано 15 квітня 2020. (англ.)
- EU/3/16/1624. European Medicines Agency (EMA). 2 травня 2016. Процитовано 15 квітня 2020. (англ.)
- EU/3/16/1625. European Medicines Agency (EMA). 4 травня 2016. Процитовано 15 квітня 2020. (англ.)
- EU/3/16/1626. European Medicines Agency (EMA). 4 травня 2016. Процитовано 15 квітня 2020. (англ.)
- azn201602256k.htm. www.sec.gov. Процитовано 21 листопада 2016. (англ.)
- House, Douglas W. (25 лютого 2016). AstraZeneca and Acerta Pharma's acalabrutinib tagged an Orphan Drug in Europe for three indications. Seeking Alpha. Процитовано 21 листопада 2016. (англ.)
- AstraZeneca to buy Acerta for blood cancer drug. www.rsc.org. Chemistry World - Royal Society of Chemistry. Процитовано 24 грудня 2015. (англ.)
- Walker, Ian; Roland, Denise (17 грудня 2015). AstraZeneca to Buy Stake in Acerta Pharma. Wall Street Journal. ISSN 0099-9660. Процитовано 19 листопада 2016. (англ.)
- Wu J, Zhang M, Liu D (Березень 2016). Acalabrutinib (ACP-196): a selective second-generation BTK inhibitor. Journal of Hematology & Oncology (англ.) 9 (1): 21. PMC 4784459. PMID 26957112. doi:10.1186/s13045-016-0250-9.
- COVID-19: протираковий лікарський засіб може зменшити запалення у тяжкохворих пацієнтів
- Вчені знайшли ліки від важкої форми коронавірусу
Посилання
- Acalabrutinib. Drug Information Portal. U.S. National Library of Medicine. (англ.)
- Acalabrutinib. NCI Drug Dictionary. National Cancer Institute. (англ.)
- Acalabrutinib. National Cancer Institute. (англ.)