Ацетооцтовий естер
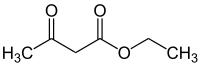
Ацетооцтовим естером зазвичай називають етиловий естер ацетооцтової кислоти, етил 3-оксобутилат, хоча інші її естери також є ацетооцтовими. Етил 3-оксобутилат — хімічна сполука з формулою CH3–CO–CH2–CO–OC2H5 (для кетонної форми)[1]. Це безбарвна рідина[1] з приємним запахом[2], існує у двох таутомерних формах: кетонній та енольній (кето-енольна таутомерія)[3][2].
| Ацетооцтовий естер | |
|---|---|
 | |
 | |
| Назва за IUPAC | етил 3-оксобутанат |
| Інші назви | етиловий естер ацетооцтової кислоти, етилацетоацетат, ацетооцтовий ефір |
| Ідентифікатори | |
| Номер CAS | [1] 141-97-9 [1] |
| Номер EINECS | 205-516-1 |
| Номер EC | [1] 205-516-1 [1] |
| KEGG | C03500 |
| ChEBI | 4893 |
| RTECS | AK5250000 [1] |
| SMILES |
CCOC(=O)CC(=O)C [1] |
| InChI |
1S/C6H10O3/c1-3-9-6(8)4-5(2)7/h3-4H2,1-2H3 [1] |
| Властивості | |
| Молекулярна формула | C6H10O3 [1] |
| Молярна маса | 130,062994 г/моль [1] |
| Молекулярна маса | 130,14 а.о.м. [1] |
| Зовнішній вигляд | безбарвна рідина [1] |
| Густина | 1,0368 (10°C) [1] |
| Тпл | -45°C [1] |
| Ткип | 180,8°C [1] |
| Розчинність (вода) | 2,86 г/100мл (20°C) [1] |
| Розчинність (хлороформ) | розчинний (20°C) |
| Небезпеки | |
| ЛД50 | 3980 мг/кг (орально, щури), 5105 мг/кг (орально, миші) [1] |
| ГГС піктограми | 
|
| ГГС формулювання небезпек | H315, H318, H319, H335 |
| ГГС запобіжних заходів | P261, P264, P271, P280, P302+P352, P304+P340, P305+P351+P338, P310
,P312, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 [1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Хімічні властивості
Для ацетооцтового естеру характерна кето-енольна таутомерія. За температури 35 °С, вміст енолу коливається від 0,4 % у воді до 31% у тетрахлорметані.[4] Загалом, у неполярних розчинниках вміст енолу зростає, а в полярних зменшується[3]: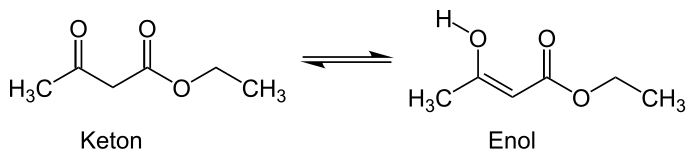
Реакції кетонів
Може взаємодіяти з речовинами, які реагують з кетонами. Наприклад, приєднує гідросульфіт натрію, синильну кислоту або водень[3]:
Також взаємодіє з гідроксиламіном, утворюючи оксим[3]:
Розщеплення
Під дією лугів може розщеплюватися. Якщо луг концентрований, відбувається кислотне розщеплення, а якщо розведений — кетонне[3]:
(луг концентрований, кислотне розщеплення, бо утворюється сіль оцтової кислоти)
(луг розведений, кетонне розщеплення, бо ацетооцтова кислота, яка утворюється, нестійка і дуже легко декарбоксилюється)
Приєднання дієнофілів
У присутності основ може приєднувати дієнофіли[3]:
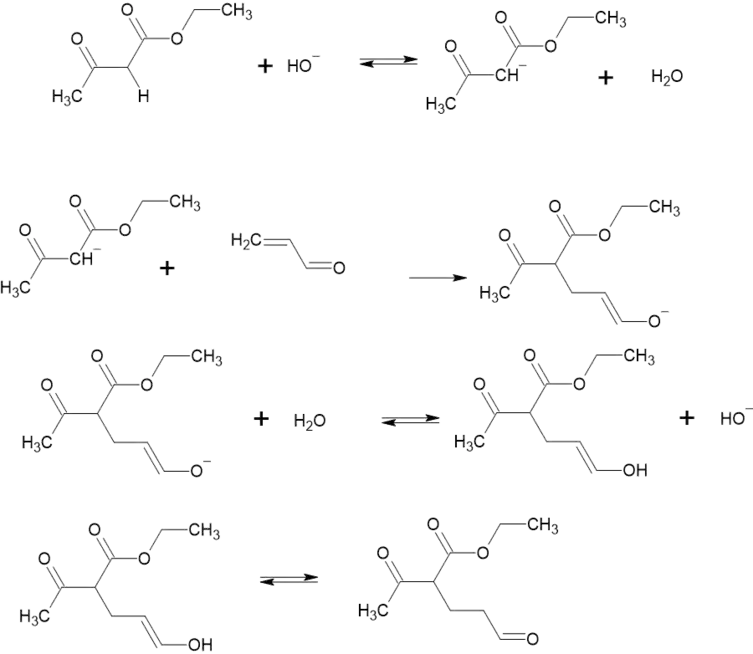
Реакція йде поетапно:
- Спочатку гідроксид-іон (або алкоголят-іон) відщеплює від молекули протон:
- Далі приєднується дієнофіл (наприклад, акролеїн). При цьому негативний заряд переходить до атома оксигену:
- Потім від молекули води (або спирту, якщо каталізатор — алкоголят-іон) відщеплюється протон, повертаючи каталізатор — гідроксид-іон:
- У продукті реакції є дві карбонільні групи, які були спочатку, та одна енольна, і внаслідок кето-енольної таутомерії енольна частково перетворюється на карбонільну:
Отриманий естер може гідролізуватися, а кислота — декарбоксилюватися. В кінці буде отримано 5-оксогексаналь:
Реакції енольної форми
В енольній формі ацетооцтовий естер має циклічну форму внаслідок утворення водневого зв'язу між атомом гідрогену з гідроксильної групи та оксигену з карбонільної. При від'єднанні протону від молекули негативний заряд делокалізується через утворення спряженої системи. Тому ацетооцтовий естер може взаємодіяти з натрієм як кислота з утворенням натрійацетооцтового естеру[3].
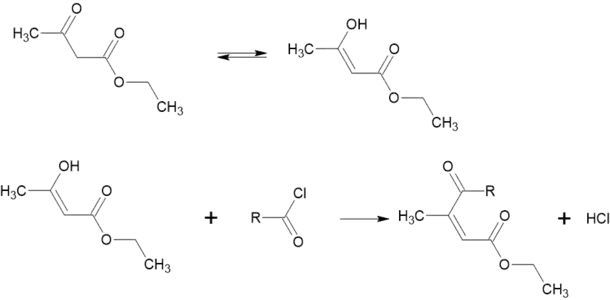
При взаємодії з пентахлоридом фосфору утворює естер β-хлорбут-2-енової кислоти[3]:
При метилюванні діазометаном утворюється етиловий естер 3-метоксикротонової кислоти[3]:
При взаємодії з хлорангідридами утворює естери 3-ацилкротонової кислоти[3]:
Гідрування
При гідруванні воднем в момент утворення утворюється етиловий естер 3-гідроксибутанової кислоти[5]. Це можна розглянути як гідрування кетону з перетворенням карбонільної групи на гідроксильну, чи як гідрування ненасиченого зв'язку в енольній формі, тому ця реакція спільна для обох форм.
Отримання
З дикетену
Ацетооцтовий естер отримують приєднанням етанолу до дикетену[3]. Цей процес аналогічний гідратації дикетену, в якій утворюється ацетооцтова кислота:
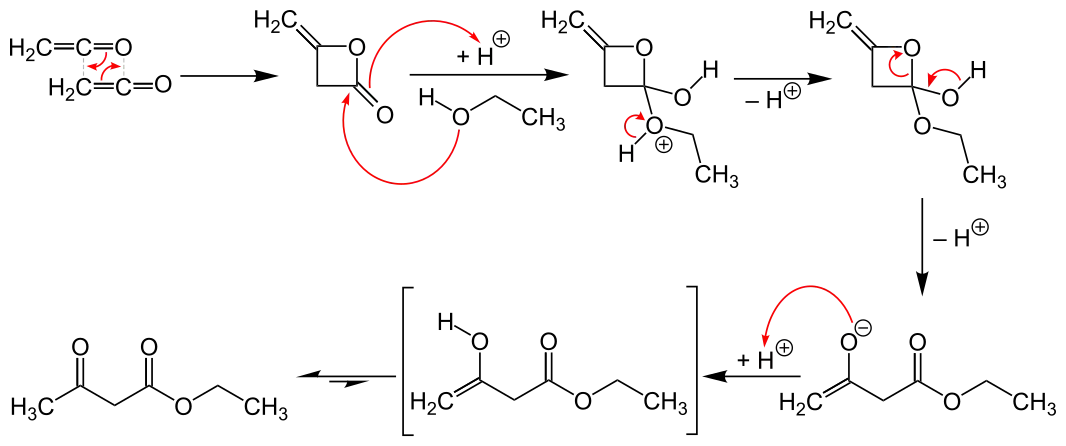
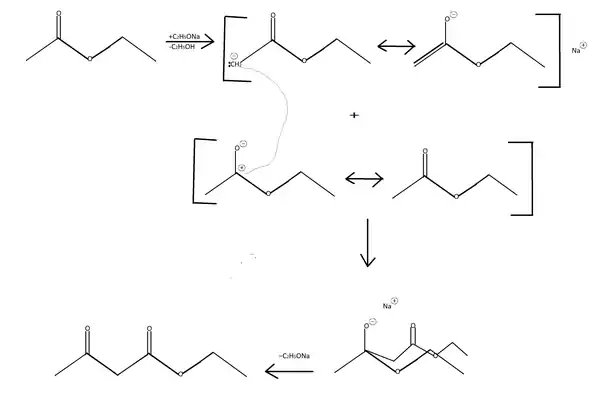
З етилацетату
Ацетооцтовий естер можна отримати і з етилацетату. Каталізатором у цій реакції є етанолят натрію[3]:
Ця реакція є конденсацією Кляйзена. Спочатку від молекули етилацетату під дією етаноляту натрію, сильного лугу, відщеплюється протон, роблячи атом карбону у α-положенні до естерної групи нуклеофільним:
Далі приєднується інша молекула етилацетату. При цьому до негативно зарядженого атома карбону приєднуєднується електрофільний атом карбону естерної групи з другої молекули:
Внаслідок -I-ефекту етоксигрупи та карбонільної групи протон поблизу цих груп є рухливим. Тому етоксигрупа може відщеплюватись разом з протоном, залищаючи натрійацетооцтовий естер:
А натрійацетооцтовий естер вже може взаємодіяти зі спиртом, утворюючи ацетооцтову кислоту та залишаючи каталізатор:
Примітки
- Ethyl acetoacetate | C6H10O3 - PubChem. pubchem.ncbi.nlm.nih.gov.
- Нейланд (1990). Органическая химия (російська). с. 636. ISBN 5-06-001471-1.
- Ластухін, Воронов (2006). Органічна Хімія. Львів: Центр Європи. с. 497-506. ISBN 966-7022-19-6.
- Grande, Karen D.; Rosenfeld, Stuart M. (1980-04). Tautomeric equilibriums in acetoacetic acid. The Journal of Organic Chemistry (англ.) 45 (9). с. 1626–1628. ISSN 0022-3263. doi:10.1021/jo01297a017. Процитовано 4 листопада 2021.
- АЦЕТООЦТОВИЙ ЕФІР. Фармацевтична енциклопедія (укр.). Процитовано 28 листопада 2020.
