Кількість речовини
Кі́лькість речови́ни — фізична величина, що характеризує кількість специфічних однотипних структурних одиниць-елементів (частинок), з котрих складається речовина. Під структурними одиницями розуміються будь-які частинки, з яких складається речовина (атоми, молекули, іони, електрони, протони, нейтрони або будь-які інші частинки).
| Фізична величина | |||
|---|---|---|---|
| Назва | Кількість речовини | ||
| Позначення величини | лат. n[1] | ||
| Позначення для розмірності | N | ||
| Системи величин і одиниць | Одиниця | Розмірність | |
| SI | {{{SI}}} |
{{{SI-розмірність}}} | |
В Міжнародній системі одиниць SI кількість речовини поряд з масою (яка теж фактично корелює з кількістю частинок) належить до основних одиниць окремого типу[2]. Таким чином, кількість речовини в системі SI не може бути виражена через інші базові одиниці. Одиниця кількості речовини називається моль. 1 моль — це кількість речовини, що містить 6.02214076×1023 (Число Авогадро) структурних формульних одиниць — реальних часток, таких як атоми, молекули, йони, електрони або протони (це визначення[3] було прийнято в листопаді 2018 року[4]; старе визначення виходило з кількості атомів у 12 грамах ізотопу вуглецю-12 — 126C).
Основні співвідношення
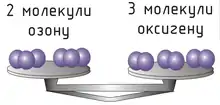
Відношення числа молекул N речовини до кількості речовини n називається сталою Авогадро NA:
Стала Авогадро дорівнює[5] NA = 6.02214076×1023 моль−1, вона показує, скільки атомів або молекул міститься в одному молі речовини.
Кількість речовини n можна знайти як відношення числа N атомів або молекул речовини до сталої Авогадро NA:
Застосовуючи одиницю кількості речовини моль, слід завжди визначати, про які саме структурні елементи системи йдеться.
Рекомендовано такі кратні й частинні одиниці моля: кмоль, ммоль, мкмоль.
На основі моля утворено велику кількість питомих (молярних) величин, зокрема — молярна маса і молярний об'єм.
Між кількістю речовини nX, масою mX порції хімічно чистої речовини X та її молярною масою MX є залежність:
До застосування рекомендовано частинну одиницю молярної маси г/моль (у SI кг/моль).
Молярний об'єм дорівнює відношенню об'єму однорідної системи V до кількості речовини n цієї системи:
До застосування рекомендовано такі частинні одиниці молярного об'єму: дм3/моль, см3/моль, допущено — позасистемну одиницю літр на моль (l/mol, L/mol; л/моль): 1 л/моль = 10−3 м3/моль.
Молярний об'єм ідеального газу за нормальних умов Т = 273,15 К; p = 101325 Па дорівнює 0,02241410 м3/моль. Цю сталу часто застосовують у розрахунках.
Використання
Ця фізична величина використовується для вимірювання макроскопічних кількостей речовин в тих випадках, коли для чисельного опису процесів, що вивчаються, необхідно приймати до уваги мікроскопічну будову речовини, наприклад, в хімії, при вивченні процесів електролізу тощо.
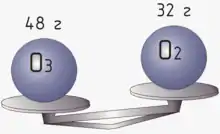
При описі хімічних реакцій, кількість речовини є зручнішою величиною, ніж маса, оскільки взаємодіють молекули, які можуть мати масу, що сильно розрізняється. В той же час, використовувати в розрахунках безпосередньо кількість молекул незручно, оскільки це число дуже велике.
Наприклад для спалювання водню:
- 2H2 + O2 → 2H2O
потрібна в два рази більша кількість речовини водню, у порівнянні з киснем. При цьому маса водню, що бере участь в реакції, приблизно в 8 разів менша від маси кисню (оскільки атомна маса водню приблизно в 16 разів менша від атомної маси кисню). Таким чином, використання кількості речовини полегшує інтерпретацію рівнянь реакцій (співвідношення між кількостями реагуючих речовин дорівнює відношенню коефіцієнтів у рівнянні).
Історичні відомості
Поняття «кількість речовини» було введене в науку давно. Проте вважалося, що кількість речовини не є особливою самостійною величиною, принципово відмінною від маси. Хоча після припущення Авогадро (1813 р.) про те, що рівні об'єми різних газів при однаковому тиску містять одне і те ж число молекул, кількість речовини і трактувалася як число молекул, але будучи пропорційною масі, вона тотожна їй. Уявлення про тотожність кількості речовини і маси багато в чому спиралося на переконання, що всі молекули (атоми) даної речовини в усіх відношеннях тотожні, що їх маса постійна і, отже, маса тіла або системи пропорційна числу молекул, що містяться в них. Власне, і про число молекул можна було судити тільки по масі тіла, оскільки не існувало прямих способів визначення числа молекул. Відкриття в області фізики в першій половині XX століття похитнули переконання в тотожності маси і кількості речовини.
Одиниця кількості речовини — моль також була відома ще в XIX ст. Але до недавнього часу моль розглядався як індивідуальна одиниця маси. Індивідуальна в тому сенсі, що розмір цієї одиниці для кожної речовини був особливий. Слово «моль» походить від латинського слова «moles» і означає кількість, масу або рахункову множину. З цих трьох понять остання — рахункова множина найточніше виражає сучасне розуміння моля. У визначенні моля не вказується точне число структур елементів, що містяться в ньому. Прийнято вважати його рівним числовому значенню сталої Авогадро NA.
Основні етапи
Алхіміки та особливо ранні металурги, ймовірно, мали певне уявлення про кількість речовини, але не збереглося жодних записів якихось узагальнень цієї ідеї. У 1758 р. М. В. Ломоносов поставив під сумнів ідею, що маса є єдиною мірою кількості матерії[6], але він зробив це лише по відношенню до його теорії гравітації. Розвиток поняття про кількість речовини збігся із народженням сучасної хімії, і був вкрай важливим для неї.
- 1777: Карл Фрідріх Венцель публікує «Уроки про спорідненість», в яких він показує, що пропорції «базового компонента» та «кислотного компонента» (катіона і аніона в сучасній термінології) залишаються незмінними в ході реакції двох нейтральних солей.[7]
- 1789: Лавуазьє публікує трактат з елементарної хімії, в якому вводить поняття хімічного елементу та уточнює Закону збереження маси для хімічних реакцій.[8]
- 1792: Ріхтер видає перший том Стехіометрії чи мистецтва вимірювання хімічних елементів (видання наступних томів триває до 1802 року). Термін «стехіометрія» використовується вперше. Перші таблиці еквівалентних ваг публікуються для кислотно–основних реакцій. Ріхтер також зазначає, що для даної кислоти, еквівалентна маса кислоти пропорційна масі кисню в основі.[7]
- 1794: Закон сталості складу Пруста поширює поняття еквівалентних ваг на всі типи хімічних реакцій, а не лише на кислотно–лужні.[7]
- 1805: Дальтон публікує свою першу статтю про атомну теорію, у тому числі «таблицю відносних ваг найдрібніших частинок газоподібних та інших тіл».[9]
- Концепція атомів поставила питання їх ваги. Хоча багато хто скептично поставився до реальності атомів, хіміки швидко знайшли атомні ваги, що стали безцінним інструментом у вираженні стехіометричного відношення.
- 1808: Публікація Нової системи хімічної філософії Дальтона, що містить першу таблицю атомних ваг (на основі H = 1).[10]
- 1809: Закон об'ємних відносин Гей-Люссака, що свідчить про цілісний взаємозв'язок між обсягами реагентів і продуктів в хімічних реакціях газів.[11]
- 1811: Амедео Авогадро висуває гіпотезу про те, що однакові обсяги різних газів (за однакової температури та тиску) містять однакове число часток, відому наразі як Закон Авогадро.[12]
- 1813/1814: Єнс Якоб Берцеліус публікує першу з декількох таблиць атомних ваг на основі масштабу O = 100.[7][13][14]
- 1815: Прут публікує свою гіпотезу про те, що всі атомні ваги цілі та кратні атомній вазі водню.[15] Гіпотезу пізніше відкинуто, враховуючи спостережувану атомну вагу хлору (приблизно 35,5 відносно водню).
- 1819: Закон Дюлонга — Пті, що стосується співвідношення атомної ваги твердого елемента та його питомої теплоємності.[16]
- 1819: Робота Ейльгард Мітчерліх про кристалічний ізоморфізм дозволяє прояснити багато хімічних формул, та вирішує кілька неоднозначностей при розрахунку атомних ваг.[7]
- 1834: Клапейрон встановлює закон про ідеальний газ.[17]
- Рівняння стану ідеального газу було першим з багатьох виявлених закономірностей у співвідношеннях між кількістю атомів або молекул в системі та іншими фізичними властивостями системи, незалежно від своєї маси. Проте, цього було недостатньо, щоб переконати всіх вчених про існування атомів і молекул, багато хто вважав це просто корисним інструментом для розрахунку.
- 1834: Faraday формулює свої Закони електролізу, зокрема, про те, що «хімічна дію струму постійна для постійної кількості електрики».
- 1856: Krьоніг виводить з кінетичної теорії закон про ідеальний газ. Клаузіус наступного року публікує незалежний висновок.
- 1860: Міжнародний хімічний конгрес у Карлсруе дебатує відношення між «фізичними молекулами», «хімічними молекулами» та атомами, не досягаючи консенсусу.[18]
- 1865: Лошмідт робить першу оцінку величини молекул газу і, отже, кількості молекул у заданому обсязі газу, відому тепер як Стала Лошмідта.
- 1886: Вант-Гофф демонструє схожість поведінки між розбавленими розчинами та ідеальними газами.
- 1886: Євген Гольдштейн спостерігає анодні промені в газових розрядах, закладаючи основу мас-спектрометрії, інструменту, який згодом використовувався для встановлення мас атомів і молекул.
- 1887: Арреніус описує дисоціацію електроліту в розчині, вирішуючи одну з проблем дослідження колігативних властивостей.
- 1893: Вперше зафіксовано використання терміну моль для опису одиниці кількості речовини — Оствальдом в університетському підручнику.[19]
- 1897: Вперше зафіксовано використання терміну моль англійською.[20]
- На межі ХХ століття, поняття атомних та молекулярних утворень стало загальноприйнятим, але залишалося багато питань, зокрема про великі розміри атомів та їх кількість в даному зразку. Паралельний розвиток мас-спектрометрії, починаючи з 1886 р., підтримує поняття атомної та молекулярної маси і забезпечує інструментарій прямого відносного вимірювання.
- 1905: Стаття Ейнштейна про броунівський рух розсіює будь-які останні сумніви щодо фізичної дійсності атомів і відкриває шлях для точного визначення їхньої маси.
- 1909: Перрен вводить поняття сталої Авогадро і визначає її значення.
- 1913: Відкриття ізотопів нерадіоактивних елементів Содді та Томсоном.
- 1914: Річардс отримує Нобелівську премію з хімії за «визначення атомної ваги великої кількості елементів».[21]
- 1920: Астон пропонує правило цілого числа — оновлену версію гіпотези Прута.
- 1921: Содді отримує Нобелівську премію з хімії «за роботу з хімії радіоактивних речовин та досліджень ізотопів».[22]
- 1922: Астон отримує Нобелівську премію з хімії «за його відкриття ізотопів у великій кількості нерадіоактивних елементів і за його правило цілих чисел». Presentation Speech for the 1922 Nobel Prize in Chemistry.</ref>
- 1926: Перрін отримує Нобелівську премію з фізики — частково за його роботу з вимірювання константи Авогадро.[23]
- 1959/1960: Уніфікована шкала атомних ваг на основі 12C = 12 прийнята IUPAP та IUPAC.
- 1968: Моль рекомендований для включення до Міжнародної системи одиниць (SI) Міжнародним комітетом мір і ваг (CIPM).
- 1972: Моль визнається як основна одиниця SI для кількості речовини.
- 2018: IUPAC затвердив[4] нове визначення[3] молю. Уточнене значення сталої Авогадро набрало чинності 20.05.2019[5].
Примітки
- Кількість речовини не рекомендовано позначати грецькою літерою ν (ню), бо цією літерою в хімічній термодинаміці позначають стехіометричний коефіцієнт речовини у реакції.
- Рішенням XIV Генеральної конференції з мір і вагів (1971 р.) одиниця кількості речовини «моль» була затверджена як сьома основна одиниця Міжнародної системи.
- IUPAC: "A new definition of the mole has arrived."
- IUPAC: "On the revision of the International system of units."
- https://www.bipm.org/utils/en/pdf/CGPM/Convocation-2018.pdf#page=25
- Lomonosov, Mikhail (1970). On the Relation of the Amount of Material and Weight. У Leicester, Henry M. Mikhail Vasil'evich Lomonosov on the Corpuscular Theory. Cambridge, MA: Harvard University Press. с. 224–33 — через Internet Archive.
- Atome. Grand dictionnaire universel du XIXe siècle (Paris: Pierre Larousse) 1: 868–73. 1866.. (фр.)
- Lavoisier, Antoine (1789). Traité élémentaire de chimie, présenté dans un ordre nouveau et d'après les découvertes modernes. Paris: Chez Cuchet.. (фр.)
- Dalton, John (1805). On the Absorption of Gases by Water and Other Liquids. Memoirs of the Literary and Philosophical Society of Manchester, 2nd Series 1: 271–87.
- Dalton, John (1808). A New System of Chemical Philosophy. Manchester.
- Gay-Lussac, Joseph Louis (1809). Memoire sur la combinaison des substances gazeuses, les unes avec les autres. Mémoires de la Société d'Arcueil 2: 207. English translation.
- Avogadro, Amedeo (1811). Essai d'une maniere de determiner les masses relatives des molecules elementaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons. Journal de Physique 73: 58–76. English translation.
- Excerpts from Berzelius' essay: Part II; Part III.
- Berzelius' first atomic weight measurements were published in Swedish in 1810: Hisinger, W.; Berzelius, J.J. (1810). Forsok rorande de bestamda proportioner, havari den oorganiska naturens bestandsdelar finnas forenada. Afh. Fys., Kemi Mineral. 3: 162.
- Prout, William (1815). On the relation between the specific gravities of bodies in their gaseous state and the weights of their atoms. Annals of Philosophy 6: 321–30.
- Petit, Alexis Thérèse; Dulong, Pierre-Louis (1819). Recherches sur quelques points importants de la Théorie de la Chaleur. Annales de Chimie et de Physique 10: 395–413. English translation
- Clapeyron, Émile (1834). Puissance motrice de la chaleur. Journal de l'École Royale Polytechnique 14 (23): 153–90.
- Wurtz's Account of the Sessions of the International Congress of Chemists in Karlsruhe, on 3, 4, and 5 September 1860.
- Ostwald, Wilhelm (1893). Hand- und Hilfsbuch zur ausführung physiko-chemischer Messungen. Leipzig.
- Helm, Georg (1897). The Principles of Mathematical Chemistry: The Energetics of Chemical Phenomena. New York: Wiley. с. 6.
- Söderbaum, H.G. (November 11, 1915). Statement regarding the 1914 Nobel Prize in Chemistry.
- Söderbaum, H.G. (December 10, 1921). Presentation Speech for the 1921 Nobel Prize in Chemistry.
- Oseen, C.W. (December 10, 1926). Presentation Speech for the 1926 Nobel Prize in Physics.
Тематичні ресурси
- Величини фізичної хімії і молекулярної фізики та їхні одиниці
- Practical realization of unit definitions: Amount of substance
- Кількість речовини. Моль. Молярна маса (грам-моль) (рос.)
- Кількісні розрахунки в хімії (рос.)
|
|
Ця стаття належить до добрих статей української Вікіпедії. |
