Йодоформ
Йодофо́рм (трийодметан) — жовта кристалічна речовина з сильним характерним запахом, практично нерозчинна у воді. Важко розчинний у спирті, добре розчиняється в етері, хлороформі.
| Йодоформ | |
|---|---|
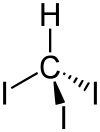 Stereo, skeletal formula of iodoform with the explicit hydrogen added | |
 Spacefill model of iodoform | |
 Sample of crystalline iodoform | |
| Назва за IUPAC | Triiodomethane[джерело?] |
| Інші назви |
|
| Ідентифікатори | |
| Номер CAS | 75-47-8 |
| PubChem | 6374 |
| Номер EINECS | 200-874-5 |
| DrugBank | 13813 |
| KEGG | D01910 |
| Назва MeSH | iodoform |
| ChEBI | 37758 |
| RTECS | PB7000000 |
| Код ATC | D09AA13 |
| SMILES |
IC(I)I |
| InChI |
InChI=1S/CHI3/c2-1(3)4/h1H |
| Номер Бельштейна | 1697010 |
| Властивості | |
| Молекулярна формула | CHI3 |
| Молярна маса | 393,73 г/моль |
| Молекулярна маса | 393,721230292 г/моль |
| Зовнішній вигляд | блідий, світло-жовтий, непрозорий кристал |
| Густина | 4,008 г/мл |
| Тпл | 394.25 |
| Розчинність (вода) | 100 мг/л (за 20 °C) |
| Розчинність (діетиловий ефір) | 136 г/л |
| Розчинність (ацетон) | 120 г/л |
| Розчинність (етанол) | 78 г/л |
| Структура | |
| Кристалічна структура | Гексагональна |
| Геометрія | Тетраедрична |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
180,1—182,1 кДж/моль |
| Ст. ентальпія згоряння ΔcH |
-716,9...-718,1 кДж/моль |
| Теплоємність, c |
157,5 Дж/(K·моль) |
| Небезпеки | |
| ЛД50 | 1,184 г/кг (шкірно, пацюки) 355 мг/кг (орально, пацюки |
| ГГС піктограми |  |
| ГГС формулювання небезпек | 315, 319, 335 |
| ГГС запобіжних заходів | 261, 280, 305+351+338 |
| Класифікація ЄС | |
| R-фрази | Шаблон:R20/21/22, R36/37/38 |
| S-фрази | S26, S36/37 |
| NFPA 704 |
 0
2
1
|
| Температура спалаху | 204 °C |
| Пов'язані речовини | |
| Інші (алкани) | Метан, Йодометан, Дийодометан, тетрайодометан, Етан, йодоетан |
| Пов'язані речовини | Гуанідин |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Отримання
Йодоформ отримують з етанолу або ацетону, дією йоду та лугів або карбонатів лужних металів :
- 6NaHCO3 + 4I2 + C2H5OH → CHI3↓ + HCOONa + 5NaI + 5H2O + 6CO2↑
Реакція йде за наступною схемою:
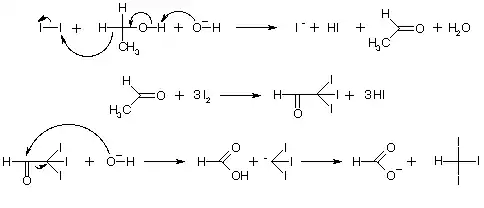
Йодоформ також можна отримати електролізом йодиду калію або натрію в спиртовому розчині. При електролізі утворюються йод та луг, необхідні для процесу. Утворений при реакції йодид калію (натрію) знову піддається електролізу, і, таким чином, весь йод солі йде на утворення йодоформу.
Застосування
В медицині йодоформ застосовують як антисептик. Зокрема, використовується для полоскання горла.
Джерела
- ЙОДОФОРМ //Фармацевтична енциклопедія
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.?)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.