Карфілзоміб
Карфілзоміб - це протираковий препарат, що продається під торговою маркою "Кіпроліс". Діє як селективний інгібітор протеасом. За своїм хімічним складом є тетрапептидним епоксикетоном та аналогом і одним з похідних епоксоміцину[1]. Був розроблений американською біофармацевтичною компанією Onyx Pharmaceuticals. Можна зустріти абревіатуру CFZ, яка зазвичай використовується для позначення карфілзоміба, проте скорочення назв препаратів не є широкою практикою в медицині.
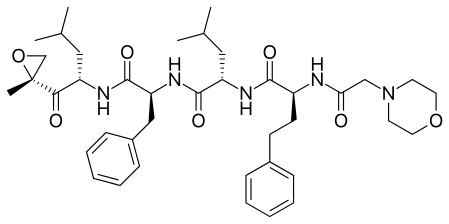
Управління з продовольства і медикаментів США (FDA) схвалило препарат 20 липня 2012 року для використання людьми з множинною мієломою, які перед цим вже отримували як мінімум два лікування, включаючи лікування бортезомібом та імуномодулюючу терапію (наприклад, леналідомід), та продемонстрували прогресування захворювання впродовж 60 днів після завершення останньої терапії. Першопочаткове схвалення препарату базувалося на кількості відгуків[2]. Дані, які демонструють загальне виживання пацієнтів, були продемонстровані пізніше в дослідженні ENDEAVOR та схвалені FDA[3] . Наразі даний препарат призначається для використання в якості єдиного агента пацієнтам з рецидивною чи рефрактерною множинною мієломою, які отримали одну чи декілька ліній терапії. У липні 2015 року FDA схвалило використання карфілзомібу у якості компоненту комбінованої терапії[4].
Цей новий препарат показав позитивні результати ефективності та безпеки в II та III фазах клінічних випробувань, незважаючи на те, що хвороба не піддається лікуванню такими агентами, як бортезоміб та леналідомід. Хоча результати з перевірки ефективності залишаються об’єктивно низькими, але вони все одно вражають, беручи до уваги той факт, що рецидивна множинна мієлома – дуже важке для лікування та смертельне захворювання, з низьким загальним показником виживання. У якості надійного варіанту терапії карфілзоміб забезпечує покращені показники виживання та мінімізує ризики для пацієнтів[4].
Вартість терапії з використанням карфілзомібу тривалістю 72 тижні складає близько 214 464$, тоді як середня оптова ціна препарату складає 2 234$. Карфілзоміб постачається у вигляді флакону на 60 мг для одноразового використання, який при розчиненні дає концентрацію 2 мг/мл[5].
Історія
Карфілзоміб є похідним епоксоміцину – натуральної сполуки, яка, як показала лабораторія Крейга Крюса у Єльському університеті, інгібує функціонування протеасом[6]. Лабораторія Крюса згодом винайшла більш специфічне похідне епоксоміцину під назвою YU101[7], яке було ліцензовано американською біотехнологічною компанією Proteolix, Inc. Вчені з компанії Proteolix винайшли нову, відмінну від інших сполуку, яка може бути використана у якості лікарського препарату для хворих, відому під назвою карфілзоміб. Proteolix спрямував карфілзоміб в декілька клінічних випробувань I та II фази, включаючи ключове клінічне випробування II фази, призначене для отримання прискореного схвалення препарату. Клінічні випробування препарату продовжують проводитися компанією Onyx Pharmaceuticals, яка придбала Proteolix у 2009 році[8].
У січні 2001 року FDA надало карфілзомібу «fast track» статус – призначення досліджуваного лікарського засобу для прискореного огляду з метою сприяння розробці препаратів, які лікують важкі та небезпечні хвороби та задовольняють необхідні медичні потреби. Це дозволило компанії Onyx ініціювати неперервне подання заявки на новий препарат карфілзоміб[9]. У грудні 2011 року FDA, на основі дослідження 003-А1, надало статус «standard review designation»[10][11] для подачі заявки на новий препарат – такий статус надається заявкам на препарати, що не відповідають критеріям пріоритетного розгляду. У зазначеному випробуванні брало участь 266 пацієнтів з рецидивною та рефрактерною множинною мієломою, які раніше лікувались щонайменше двома способами, включаючи лікування бортезомібом та талідомідом чи леналідомідом[12].
Механізм дії
Карфілзоміб являє собою модифікований епоксикетон та є похідним епоксоміцину з потенційною протипухлинною активністю. Препарат вибірково впливає на протеасомні ферменти всередині клітини. Він ковалентно[13] необоротно зв’язується та інгібує хімотрипсинподібну активність протеасоми 20S – протеазного комплексу, що відповідає за руйнування великої кількості клітинних білків. Окрім цього, препарат зв’язується також і з основним компонентом протеасоми 26S, оскільки остання є комплексом, що містить протеасоми 20S та 19S[4]. Інгібування протеолізу, опосередкованого протеасомами, призводить до накопичення поліубіквітинованих білків, що, в свою чергу, може призвести до зупинки клітинного циклу, індукції апоптозу та інгібування росту пухлини[1].
Карфілзоміб мінімально взаємодіє з непротеасомними мішенями, що покращує його профілі безпечності порівняно з бортезомібом[13].
Фармакокінетика
При внутрішньовенному введенні карфілзомібу в рекомендованій початковій дозі 20 мг/м2, максимальна концентрація в плазмі досягається впродовж декількох хвилин, а системний вплив досягається менше ніж за годину. Було виявлено, що концентрація препарату в плазмі залежить від дози, що було помічено при збільшенні рекомендованої дози карфілзомібу. Карфілзоміб широко проникає у всі тканини, окрім тканин мозку. Доза 20 мг/м2 в перший день продемонструвала середній об’єм розподілення 28 л. Карфілзоміб має високий ступінь зв’язування з білками, що складає приблизно 97%[14][15].
Препарат швидко та широко метаболізується за межами печінки. Двома основними шляхами метаболізму є розщеплення пептидазою та епоксидний гідроліз. Карфілзоміб швидко виводиться нирками та з жовчю з періодом напіввиведення менше однієї години у перший день застосування рекомендованої дози, у результаті чого менше 1% препарату залишається інтактним. Упродовж 24 годин 25% карфілзоміба виводиться у вигляді неактивних метаболітів[14][15][16].
Клінічні дослідження та побічні ефекти
Одноетапне випробовування II фази (003-А1) карфілзомібу у пацієнтів з рецидивною та рефрактерною множинною мієломою показало, що монотерапія даним препаратом продемонструвала клінічну ефективність, що склала 36% у 266 обстежених пацієнтів. При цьому препарат мав загальний рівень реакції 22,9% та середню тривалість відповіді 7.8 місяців. FDA схвалив карфілзоміб на основі результатів випробовування 003-А1[17].
У випробовуванні II фази (004) карфілзоміб показав 53% від загального рівня реакції серед пацієнтів з рецидивною та/або рефрактерною множинною мієломою, які раніше не лікувались бортезомібом. Це дослідження також включало когорту пацієнтів, які лікувались бортезомібом. Результати були представлені окремо[18]. Дане дослідження також показало, що пролонговане лікування карфілзамібом цілком допустимо: близько 22% пацієнтів продовжували лікування довше одного року. Дослідження 004 було менш об’ємним, оскільки першопочатково воно розроблялось для дослідження впливу лікування карфілзомібом на процес лікування бортезомібом у пацієнтів з менш інтенсивним попереднім лікуванням (1-3 попередніх лікувальних режими)[19].
Випробовування II фази (005), в якому оцінювали безпечність, фармакокінетику, фармакодинаміку та ефективність карфілзомібу у пацієнтів з множинною мієломою та різним ступенем ниркової недостатності, де майже 50% пацієнтів не лікувались бортезомібом та леналідомідом, продемонстрували, що фармакокінетика та безпечність не залежали від ступеня ниркової недостатності – карфілзоміб сприймався організмом та показав свою ефективність[20].
В іншому випробовуванні II фази (006) за участю пацієнтів з рецидивною та/або рефрактерною множинною мієломою карфілзоміб у комбінації з леналідомідом і дексаметазоном продемонстрував загальний рівень відповіді 69%[21].
Випробовування II фази (007) з пацієнтами з множинною мієломою та солідними пухлинами показало перспективні результати[22][23].
У випробуваннях II фази карфілзомібу найбільш частими побічними ефектами, що проявлялись при лікуванні, були гематологічна токсичність[24] з тромбоцитопенією, анемією, лімфопенією, нейтропенією, пневмонією, гіпонатріємією та втомою[25].
У випробовуванні I/II фази комбінація карфілзоміба, леналідоміду та дезоксиметазону в низьких дозах була високоактивною та добре переносилась пацієнтами, що дозволяло використовувати повні дози упродовж тривалого часу хворим з вперше діагностованою множинною мієломою. При цьому потреба у певній зміні дози була обмежена. Реакції були швидкими та з часом покращувались, досягаючи 100% дуже доброї часткової відповіді[26].
Крім цього, шлунково-кишкові розлади, включаючи діарею та нудоту, є негематологічною групою побічних ефектів, що зазвичай спостерігаються при використанні інгібіторів протеасом. Також, кардіоваскулярна токсичність може бути результатом лікування карфілзомібом через вплив на протесоми в міокарді[24]. Таким чином, оцінка стану пацієнта та оцінка ризиків до початку терапії карфілзомібом мають вирішальне значення та є дуже важливими[27].
Підтверджувальне клінічне випробування III фази, відоме як випробовування ASPIRE, порівнювало лікування карфілзомібом, леналідомідом та дексаметазоном (KRd) з лікуванням лише леналідомідом та дексаметазоном (Rd) у хворих на множинну мієлому і демонструвало покращення показників виживання без прогресування (PFS) та показників загального виживання. Припинення лікування через побічні ефекти відбувалось рідше у групі KRd, ніж у групи Rd. Ці побічні ефекти включали тромбоцитопенію, серцеву недостатність та артеріальну гіпертензію[28][29].
Джерела інформації
- "NCI Drug Dictionary". www.cancer.gov (англ.). 2 лютого 2011. Процитовано 11 червня 2021.
- "FDA Approves Kyprolis for Some Patients with Multiple Myeloma". FDA. 20 липня 2012. Процитовано 23 липня 2013.
- FDA Approves Carfilzomib Label Update in Myeloma | OncLive |.
- Carfilzomib (Kyprolis): A Novel Proteasome Inhibitor for Relapsed And/or Refractory Multiple Myeloma.
- Red Book Online. Ann Arbor, Michigan: Truven Health Analytics; Accessed April 8, 2016.
- Meng L, Mohan R, Kwok BH, Elofsson M, Sin N, Crews CM (August 1999). "Epoxomicin, a potent and selective proteasome inhibitor, exhibits in vivo antiinflammatory activity".
- Myung, Jayhyuk; Kim, Kyung Bo; Lindsten, Kristina; Dantuma, Nico P; Crews, Craig M (2001-02). Lack of Proteasome Active Site Allostery as Revealed by Subunit-Specific Inhibitors. Molecular Cell (англ.) 7 (2). с. 411–420. doi:10.1016/S1097-2765(01)00188-5. Процитовано 11 червня 2021.
- "Carfilzomib: From Discovery To Drug". Chemical & Engineering News.
- "Onyx multiple myeloma drug wins FDA fast-track status". San Francisco Business Times.
- "Beacon Breaking News – Carfilzomib to Get Standard, Not Priority, FDA Review". The Myeloma Beacon.
- "Fast Track, Accelerated Approval and Priority Review; Accelerating Availability of New Drugs for Patients with Serious Diseases". FDA.
- "PX-171-003-A1, an open-label, single-arm, phase (Ph) II study of carfilzomib (CFZ) in patients (pts) with relapsed and refractory multiple myeloma (R/R MM): Long-term follow-up and subgroup analysis". ASCO 2011; Abstract 8027. 2011.
- Park, Ji Eun; Park, Joonyoung; Jun, Yearin; Oh, Yunseok; Ryoo, Gongmi; Jeong, Yoo-Seong; Gadalla, Hytham H.; Min, Jee Sun та ін. (2019-05). Expanding therapeutic utility of carfilzomib for breast cancer therapy by novel albumin-coated nanocrystal formulation. Journal of Controlled Release (англ.) 302. с. 148–159. PMC PMC6638563. PMID 30954620. doi:10.1016/j.jconrel.2019.04.006. Процитовано 11 червня 2021.
- Kyprolis (carfilozomib) prescribing information.
- Carfilzomib . Lexi-Drugs Online. Lexi-Comp, Inc. Updated October 19, 2015.
- Kortuem, K. Martin; Stewart, A. Keith (7 лютого 2013). Carfilzomib. Blood (англ.) 121 (6). с. 893–897. ISSN 0006-4971. doi:10.1182/blood-2012-10-459883. Процитовано 13 червня 2021.
- "Kyprolis- carfilzomib injection, powder, lyophilized, for solution". DailyMed. 26 серпня 2020.
- Vij, Ravi; Siegel, David S.; Jagannath, Sundar; Jakubowiak, Andrzej J.; Stewart, Alexander Keith; McDonagh, Kevin; Bahlis, Nizar; Belch, Andrew та ін. (2012-09). An open-label, single-arm, phase 2 study of single-agent carfilzomib in patients with relapsed and/or refractory multiple myeloma who have been previously treated with bortezomib. British Journal of Haematology (англ.) 158 (6). с. 739–748. PMC PMC5818209. PMID 22845873. doi:10.1111/j.1365-2141.2012.09232.x. Процитовано 13 червня 2021.
- Vij, Ravi; Wang, Michael; Kaufman, Jonathan L.; Lonial, Sagar; Jakubowiak, Andrzej J.; Stewart, A. Keith; Kukreti, Vishal; Jagannath, Sundar та ін. (14 червня 2012). An open-label, single-arm, phase 2 (PX-171-004) study of single-agent carfilzomib in bortezomib-naive patients with relapsed and/or refractory multiple myeloma. Blood (англ.) 119 (24). с. 5661–5670. ISSN 0006-4971. PMC PMC4123327. PMID 22555973. doi:10.1182/blood-2012-03-414359. Процитовано 13 червня 2021.
- Badros, A Z; Vij, R; Martin, T; Zonder, J A; Kunkel, L; Wang, Z; Lee, S; Wong, A F та ін. (2013-08). Carfilzomib in multiple myeloma patients with renal impairment: pharmacokinetics and safety. Leukemia (англ.) 27 (8). с. 1707–1714. ISSN 0887-6924. PMC PMC3740399. PMID 23364621. doi:10.1038/leu.2013.29. Процитовано 13 червня 2021.
- "European Hematology Association (EHA) 18th Congress. June 13-16, 2013". The Myeloma Beacon. 2013.
- "Nikoletta Lendval, MD PhD et al. Phase II Study of Infusional Carfilzomib in Patients with Relapsed or Refractory Multiple Myeloma". Presented at: 54th ASH Annual Meeting and Exposition. December 2012.
- "Phase II results of Study PX-171-007: A phase Ib/II study of carfilzomib (CFZ), a selective proteasome inhibitor, in patients with selected advanced metastatic solid tumors". Abstract 3515: ASCO 2009.
- Guerrero-Garcia, Thomas A.; Gandolfi, Sara; Laubach, Jacob P.; Hideshima, Teru; Chauhan, Dharminder; Mitsiades, Constantine; Anderson, Kenneth C.; Richardson, Paul G. (2 грудня 2018). The power of proteasome inhibition in multiple myeloma. Expert Review of Proteomics (англ.) 15 (12). с. 1033–1052. ISSN 1478-9450. doi:10.1080/14789450.2018.1543595. Процитовано 13 червня 2021.
- Siegel DS, Martin T, Wang M, et al. (2011-03-09). "Results of PX-171- 003-A1, an open-label, single-arm, phase 2 study of carfilzomib in patients with relapsed and refractory multiple myeloma. Presented at: 52nd ASH Annual Meeting and Exposition; December 4-7, 2010; Orlando, Florida". OncLive.com.
- "Final Results of a Frontline Phase 1/2 Study of Carfilzomib Lenalidomide, and Low-Dose Dexamethasone (CRd) in Multiple Myeloma (MM)". ASH 20111; Abstract 631. Процитовано 27 лютого 2012.
- Efentakis, Panagiotis; Kremastiotis, Georgios; Varela, Aimilia; Nikolaou, Panagiota-Efstathia; Papanagnou, Eleni-Dimitra; Davos, Constantinos H.; Tsoumani, Maria; Agrogiannis, Georgios та ін. (14 лютого 2019). Molecular mechanisms of carfilzomib-induced cardiotoxicity in mice and the emerging cardioprotective role of metformin. Blood (англ.) 133 (7). с. 710–723. ISSN 0006-4971. doi:10.1182/blood-2018-06-858415. Процитовано 13 червня 2021.
- "Phase 3 Study Comparing Carfilzomib, Lenalidomide, and Dexamethasone (CRd) Versus Lenalidomide and Dexamethasone (Rd) in Subjects With Relapsed Multiple Myeloma". ClinicalTrials.gov. 4 серпня 2011.
- Stenger, Matthew (January 31, 2018). "ASPIRE Trial: Final Overall Survival Results in Relapsed or Refractory Multiple Myeloma".. The ASCO Post.
