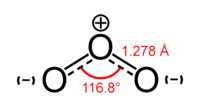
Озон
Загальна характеристика
В нижніх шарах атмосфери його вміст незначний. Найбільша його концентрація в стратосфері між висотами 10 і 40 км. Озон значно поглинає ультрафіолетове випромінювання з довжиною хвилі в інтервалі 200—300 нм.
Проста речовина, алотропна видозміна кисню. Назва походить від грецького слова «озеін», що означає «пахучий». Озон відкритий в 1840 р. Шенбейном. Хімічно-активний газ синього кольору з різким запахом, сильний окиснювач. При великих концентраціях розкладається з вибухом. Утворюється з кисню при електричному розряді (наприклад, під час грози). Основна маса озону знаходиться у верхньому шарі атмосфери — озоносфері, на висоті від 10 до 50 км із максимумом концентрації на висоті 20-25 км. Цей шар охороняє живі організми Землі від шкідливого впливу короткохвильової ультрафіолетової радіації Сонця (може викликати рак шкіри). Зараз під впливом різних агресивних факторів, як-от польоти космічних ракет, висотних літаків, викидання в атмосферу хлорфторвуглеців тощо, цей шар руйнується, що може негативно вплинути на жителів Землі. У багатьох країнах використання таких речовин, що входять у різні аерозолі, заборонено. Тим часом озоновому шару притаманна і властивість самовідновлення[1].
Температура кипіння озону −112 °C; вага 1 л — 2,14 г. Утворює озоніди (сполуки лужних металів і амонію, які містять аніони О–3). Легко розкладається (О3 → О + О2). Вміст у повітрі: влітку — до 7·10−6% об'ємних, взимку — 2·10−6%. Бактерицидний засіб. Є мутагеном. Гранично допустима концентрація у повітрі — 0,1-0,16 мг/м3.
Історія відкриття
Вперше озон виявив у 1785 році голландський фізик Мартін ван Марум за характерним запахом і окислювальним властивостям, яких набуває повітря після пропускання через нього електричних іскор, а також за здатністю діяти на ртуть за звичайної температури, внаслідок чого вона втрачає свій блиск і починає прилипати до скла[2]. Однак як нова речовина він описаний не був, ван Марум вважав, що утворюється особлива «електрична матерія».
Термін озон був запропонований німецьким хіміком К. Ф. Шенбейном у 1840 році за його пахучість, увійшов до словників наприкінці XIX століття. Багато джерел саме йому віддають пріоритет відкриття озону в 1839 році. У 1840 році Шенбейн показав здатність озону витісняти йод з йодиду калію[2]:
Цю реакцію використовують для якісного виявлення озону за допомогою фільтрувального паперу, просоченого сумішшю розчинів крохмалю і йодиду калію (йодокрахмального паперу) — він в озоні синіє завдяки взаємодії виділеного йоду з крохмалем[3].
Факт зменшення об'єму газу при перетворенні кисню на озон експериментально довели в 1860 році Ендрюс і Тет за допомогою скляної трубки з манометром, наповненої киснем, з упаяними в неї платиновими провідниками для отримання електричного розряду[2].
Фізичні властивості
- Молекулярна маса — 48 а.о.м.
- Густина газу за нормальних умов 2,1445 г/дм3. Відносна густина газу за киснем 1,5; за повітрям 1,62 (1,658[4]).
- Густина рідини при -188 °C (85,2 К) становить 1,59(7) г/см3.
- Густина твердого озону при -195,7 °С (77,4 К) дорівнює 1,73(2) г/см3.
- Температура кипіння -111,8(3) °C (161,3 К). Рідкий озон — темно-фіолетового кольору.
- Температура плавлення -197,2(2) °С (75,9 К). Значення -251,4 °C (21,7 К), яке іноді наводять, є хибним, оскільки при його отриманні не враховувалася велика здатність озону до переохолодження[5]. За іншими даними Tпл = −192,5(4) °С (80,6 К). У твердому стані чорного кольору з фіолетовим відблиском.
- Критична температура -12,0 °С (261,1 К).
- Критичний тиск 51,6 атм.
- Коефіцієнт дифузії (при 300 К, 1 атм) 0,157 см2/с.
- Теплота плавлення 2,1 кДж/моль.
- Теплота випаровування при температурі кипіння в різних джерелах вказується від 11,17 до 15,19 кДж/моль; при 90 К від 15,27 до 16,6 кДж/моль.
- Розчинність у воді при 0 °С — 0,394 кг/м3 (0,494 л/кг), вона в 10 разів вища в порівнянні з киснем. Позірна розчинність сильно залежить від чистоти води, оскільки домішки каталізують розпад озону.
- Рідкий озон змішується у всіх відношеннях з рідкими аргоном, азотом, фтором, метаном, вуглекислотою, тетрахлорвуглецем. Змішується з рідким киснем у всіх відношеннях за температури вище від 93 К, нижче від цієї температури розчин розшаровується на дві фази.
- Добре розчиняється у фреонах, утворюючи стабільні розчини (використовується для зберігання та перевезення).
- Потенціал іонізації молекули 12,52 еВ.
- В газоподібному стані озон діамагнітний, в рідкому — слабопарамагнітний.
- Запах різкий, специфічний «металевий» (за Менделєєвим — «запах раків»). За великих концентрацій нагадує запах хлору. Запах відчувається навіть при розведенні 1:100000.
Хімічні властивості
Утворення озону відбувається за оборотною реакцією:
Молекула O3 нестійка і за достатніх концентрацій у повітрі за нормальних умов мимовільно за кілька десятків хвилин[6] перетворюється на O2 з виділенням тепла. Підвищення температури і зниження тиску збільшують швидкість переходу в двоатомний стан. За великих концентрацій перехід може мати вибуховий характер. Контакт озону навіть з малими кількостями органічних речовин, деяких металів або їх оксидів різко прискорює перетворення.
У присутності невеликих кількостей HNO3 озон стабілізується, а в герметичних посудинах зі скла, деяких пластмас або чистих металів озон за низьких температур (-78 °С) практично не розкладається.
Озон — потужний окислювач, набагато більш реакційноздатний, ніж двоатомний кисень. Окислює майже всі метали (за винятком золота, платини[7] та іридію) до вищих ступенів окислення. Окиснює багато неметалів. Продуктом реакції в основному є кисень.
Озон підвищує ступінь окислення оксидів:
Ця реакція супроводжується хемілюмінесценцією. Діоксид азоту може бути окислений до азотного ангідриду:
Озон не реагує з молекулярним азотом за кімнатної температури, але при 295°С вступає з ним у реакцію:
Озон реагує з вуглецем за нормальної температури з утворенням діоксиду вуглецю:
Озон не реагує з амонієвими солями, але реагує з аміаком з утворенням нітрату амонію:
Озон реагує з воднем з утворенням води і кисню:
Озон реагує з сульфідами з утворенням сульфатів:
За допомогою озону можна отримати сірчану кислоту як з елементарної сірки, так і з діоксиду сірки і сірководню:
У газовій фазі озон взаємодіє з сірководнем з утворенням діоксиду сірки:
У водному розчині проходять дві конкурентні реакції з сірководнем, одна з утворенням елементарної сірки, інша з утворенням сірчаної кислоти:
Всі три атоми кисню в озоні можуть реагувати окремо в реакції хлориду олова з соляною кислотою і озоном:
Обробкою озоном розчину йоду в холодній безводній хлорній кислоті може бути отриманий перхлорат йоду(III):
Твердий перхлорат нітронію може бути отриманий реакцією газоподібних NO2, ClO2 і O3:
Озон може брати участь у реакціях горіння, при цьому температури горіння вищі, ніж з двоатомним киснем:
Озон може вступати в хімічні реакції і за низьких температур. При 77 K (-196 °C, температура кипіння рідкого азоту), атомарний водень взаємодіє з озоном з утворенням гідропероксидного радикала з димеризацією останнього[8]:
Озон може утворювати неорганічні озоніди, що містять аніон O3−. Ці сполуки вибухонебезпечні і можуть зберігатися тільки за низьких температур. Відомі озоніди всіх лужних металів (крім францію). KO3, RbO3 і CsO3 можуть бути отримані з відповідних супероксидів:
Озонід калію може бути отриманий іншим шляхом з гідроксиду калію[9]:
NaO3 і LiO3 можуть бути отримані дією CsO3 в рідкому аміаку NH3 на іонообмінні смоли, що містять іони Na+ або Li+[10]:
Обробка озоном розчину кальцію в аміаку призводить до утворення озоніду амонію, а не кальцію[8]:
Озон може бути використаний для видалення заліза і марганцю з води з утворенням осаду (відповідно гідроксиду заліза(III) і диоксигідрату марганцю), який може бути відокремлений фільтруванням:
У кислих середовищах окислення марганцю може йти до перманганату.
Озон перетворює токсичні ціаніди в менш небезпечні ціанати:
Озон може повністю розкладати сечовину[11] :
Взаємодія озону з органічними сполуками з активованим чи третинним атомом вуглецю за низьких температур призводить до утворення відповідних гидротриоксидів.
Отримання озону
В лабораторії озон можна одержати взаємодією охолодженої концентрованої сірчаної кислоти з пероксидом барію[3]:
Озон, як у промисловості, так і в лабораторії, виробляють з кисню за допомогою електричного розряду, в спеціальних приладах — озонаторах. Об'ємний вміст озону на виході із озонатора — 5-8 % при озонуванні кисню, 1-1,5 % при озонуванні повітря. Озон вищої концентрації (до 50 %) можна добути електролізом концентрованих розчинів HClO4, H3PO4, H2SO4 на охолоджуваному аноді з Pt чи PbO2.
Застосування озону
Використовується у хімічному синтезі, для стерилізації води, для дезінфекції й дезодорації повітря, вибілювання тканин, паперу, мінеральних масел тощо…
Медичне застосування
Застосування озону ґрунтується на його сильній окиснювальній дії і стерилізаційній дії. Під його впливом гинуть не лише бактерії, а й грибки та віруси. Дослідження властивостей озону також показали, що озон можна використовувати в медицині для лікування та профілактики багатьох захворювань. Цей метод називається озонотерапією.
Застосування рідкого озону
Давно розглядається застосування озону в якості високоенергетичного і разом з тим екологічно чистого окислювача в ракетній техніці[12]. Загальна хімічна енергія, що вивільняється під час реакції згоряння за участі озону, більша, ніж для простого кисню, приблизно на одну чверть (719 ккал/кг). Більшим буде, відповідно, і питомий імпульс. У рідкого озону більша густина, ніж у рідкого кисню (1,35 і 1,14 г/см3 відповідно), а його температура кипіння вища (-112 °C і -183 °C відповідно), тому в цьому відношенні перевага в якості окислювача в ракетній техніці більша у рідкого озону. Однак перешкодою є хімічна нестійкість і вибухонебезпечність рідкого озону з розкладанням його на O і O2, при якому виникає детонаційна хвиля, рухається зі швидкістю близько 2 км/с, і розвивається руйнівний детонаційний тиск більше 3·107 дин/см2 (3 МПа), що робить застосування рідкого озону неможливим при нинішньому рівні техніки, за винятком використання стійких кисень-озонових сумішей (до 24 % озону). Перевагою такої суміші також є більший питомий імпульс (ПІ) для водневих двигунів, порівняно з озон-водневими[13]. На сьогоднішній день такі високоефективні двигуни, як РД-170, РД-180, РД-191, а також розгінні вакуумні двигуни вийшли з ПІ на близькі до граничних параметрів і для підвищення ПІ залишилося можливим перейти на нові види палива.
Біологічна дія
Серед біологічних ефектів озону перші місця займають біоцидна, а також бактеріо-, фунгі- і вірусоцидний ефекти, що призводить до втрати життєдіяльності бактеріальної клітини і здатності її до розмноження. Озон вбиває всі відомі види грам-позитивних та грам-негативних бактерій, синьогнійну паличку, всі ліпо- і гідрофільні віруси, в тому числі віруси гепатиту А, В, С, спори і вегетативні форми всіх відомих патогенних грибів та простіших, імуномодулююча дія озону проявляється в активації клітинного та гуморального імунітету.[джерело?]
Протизапальний ефект озону ґрунтується на його можливості окислювати (розщепляти) арахідонову кислоту та її похідні — простагландини — біологічно активні речовини, які беруть участь в розвитку і підтримці запального процесу. Відновлення гомеостазу проявляється в стимуляції кровотворення, оптимізації метаболізму (біоенергетичні, біосинтетичні ефекти).
Доведено, що озон підсилює дію інших лікарських препаратів за рахунок того, що він покращує доступ ліків до клітин, за рахунок розпушення їхніх мембран.
Озон позитивно впливає на еритроцити, збільшує еластичність їхніх мембран, тим самим покращується прохідність останніх в спазмованих та звужених внаслідок хвороби судинах та капілярах. Це дає змогу більшій кількості еритроцитів проникнути в ті ділянки хворого організму, де є гіпоксія (недостатня кількість кисню), і збагатити її киснем. Озон також підвищує проникливість кліткових мембран для глюкози, і це знижує рівень цукру в кров'яному руслі за рахунок кращого надходження глюкози в тканини.
Шкідливість озону
Озон у верхніх шарах атмосфери дійсно захищає нас від згубного впливу ультрафіолетових променів, поглинаючи їх і значно знижуючи їх шкідливі властивості. Однак так званий приземний озон в нижніх шарах атмосфери дуже шкідливий, що й довели співробітники спеціалізованого дослідного центру Агентства з охорони навколишнього середовища США (U.S. Environmental Protection Agency — EPA).
Висока окислювальна здатність озону і утворення у багатьох реакціях за його участі вільних радикалів кисню визначають його високу токсичність. Вплив озону на організм є загальнотоксичним, подразнювальним, канцерогенним і мутагенним, а також може призводити до передчасної смерті[14].
Найбільш небезпечний вплив високих концентрацій озону в повітрі на органи дихання прямим подразненням.
Озон в атмосфері
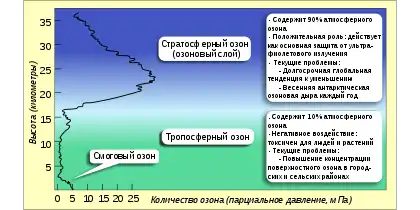
Атмосферний (стратосферний) озон є продуктом впливу сонячного випромінювання на атмосферний (О2) кисень. Однак тропосферний озон є забруднювачем, який може загрожувати здоров'ю людей і тварин, а також пошкоджує рослини.
Вважається, що блискавки Кататумбо є найбільшим одиничним генератором тропосферного озону на Землі.
Див. також
Примітки
- Звіт Всесвітньої метеорологічної організації за 2014 р. (англ.). Архів оригіналу за 8 липня 2016. Процитовано 11 серпня 2016.
- С. С. Колотов, Д. И. Менделеев. Озон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп. т.). — СПб., 1890—1907. (рос. дореф.)
- Отримання озону та його визначення — відеодослід в Єдиній колекції цифрових освітніх ресурсів
- Довідник хіміка, т. II. Л., «Хімія», 1971.
- Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М. : Химия, 1974.
- Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion?. Архів оригіналу за 1 червня 2006. Процитовано 31 березня 2019.
- Платина не окиснюється озоном, але каталізує його розкладання.
- Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 44-49
- Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 439.
- Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 265
- Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 259, 269—270
- Перспективные окислители. Архів оригіналу за 3 листопада 2009. Процитовано 24 грудня 2009.
- The Dynamics of Unsteady Detonation in Ozone
- National Academy of Sciences: Link Between Ozone Air Pollution and Premature Death Confirmed
Література
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Озон // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Большая Рос. энцикл., 1992. — Т. 3 : Меди сульфиды — Полимерные красители. — Стб. 656. — Библиогр. в конце ст. — ISBN 5-85270-039-8.(рос.)