Пластом
Пластом - генетичний матеріал, що міститься в пластидах рослинної клітини (звичайно цей термін вживають стосовно до хлоропластів).
Існування ДНК хлоропластів було ідентифіковано біохімічним методом у 1959 році[1]. А у 1962 році було отримане мікроскопічне підтвердження виявлення пластому[2]. Це відкриття та подальші дослідження, що констатували наявність рибосом та здатність хлоропласту до синтезу власних білків, дозволили запропонувати теорію про напів автономність пластид.
Перший сиквенс повної послідовності геному хлоропластів був встановлена у 1986 році Sugiura та колегами при дослідженні Nicotiana tabacum (тютюн справжній) та Ozeki і колегами на Marchantia polymorpha (маршанція мінлива)[3]. На сьогодні розшифровано нуклеотидну послідовність сотень пластомів з різних видів рослин.
Пластомна ДНК, як і ядерна, здатна до реплікації, трансляції та транскрипції . Вона кодує всі тРНК та рРНК хлоропластів, частину рибосомних білків пластид, а також білкових комплексів мембран . Крім того, основний фермент хлоропластів – рибулозобісфосфаткарбоксілаза – наполовину кодується пластомними генами [4] .
Як правило, у рослин спостерігається успадкування пластомів за материнським типом (тобто пластиди рослина отримує цілком від материнської рослини) (наприклад, у нічної красуні), рідше - по батьківському (герань) або по обом батькам (кіпрей).
Молекулярна структура
ДНК, що міститься в хлоропластах, - кільцева, за щільністю зазвичай дещо відмінна від ядерної ДНК (наприклад, у Euglena gracilis щільність ядерної ДНК становить 1,707 г/см3, а ДНК з хлоропластів - 1,685 г/см3). Розмір пластому коливається у межах 120-170 кб, а маса близько 80-130 МДа[5][6].
Більшість пластомів представлені одним цілісним ланцюгом нуклеотидів, проте у динофлагелят пластом складається з 4 невеликих плазмід, кожна з яких 2-10 кб у довжину[7]. При цьому у кожному фрагменті закодовано по 1-3 гени. Виявлено також плазміди, що не кодують повних послідовностей генів.
Наразі з'являються і відомості, що вчення про кільцевий пластом не відповідає дійсності. При досліджені кукурудзи було виявлено, що 95% хлоропластної ДНК мало лінійну конфігурацію[7].
Інвертовані повтори
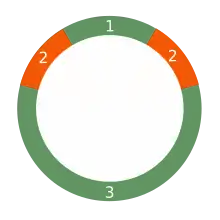
Багато пластомів містять 2 інвертованих повтори, які розділяють довгу область від короткої. Довжина цих повторів значно варіює у різних пластомах від 4 до 25 кб. При цьому генний склад теж є значно мінливим. Зазвичай інвертовані повтори містять 3 гени, що кодують рибосомальну РНК, 2 гени тРНК. Проте у природі зустрічають інвертовані повтори пластом, що містять від 4 до 150 генів[7].
Пара інвертованих повторів дуже рідко буває ідентичною, проте вони завжди значно схожі між собою, що свідчить про узгоджену еволюцію.
Інвертовані повтори висококонсервативні у різних видів рослин, про що свідчить подібність послідовностей ціанобактерій та глаукофіт і родофітових. Варто зазначити й те, що такі рослини як червоні водорості та горох втратили інвертовані повтори в пластомах у ході еволюції[8]. Більше того, є види рослин, наприклад Porphyra, які внаслідок перевертання одного з повторів набули прямі, а не інвертовані, повтори.
Функцією інвертованих повторів вважають стабілізацію пластидного геному, адже при втраті цих ділянок спостерігається більша частота перебудови пластому[9].
Нулкеоїд
Кожен хлоропласт містить близько 100 копій ДНК у молодих листках. Зі збільшенням віку у пластидах залишається лише 15-20 копій. Копії молекул ДНК часто утворюють нуклеоїди, розташовуючись дуже близько один до одного. У одному хлоропласті може перебувати декілька нуклеоїдів. Вважається, що нуклеоїди утворюються за допомогою наявності певних гістоноподібних білків, що було досліджено на прикладі червоних водоростей.
Розташування нуклеоїдів залежить від роду та виду рослини. Так у червоних водоростей ця структура знаходиться у центрі хлоропласту, а у зелених водоростей розкидана по стромі[10].
Набір генів та генна експресія
На NCBI є база даних геному органел, де знаходиться більше 5000 хлоропластних геномів. Порівняння ціанобактерій з більш еволюційно пізніми організмами дозволило припустити ендосимбіотичну теорію походження пластид. Також було показано перехід значної кількості генів з пластид у ядро.
Основними генами, що містять хлоропласти є ті, що кодують складові фотосинтетичного апарату та фактори, що сприяють їх синтезу та поєднанню. Загальними для наземних рослин є гени 4 рРНК, 30 тРНК, 21 рибосомальних білків та 4 субодиниць комплексу РНК-полімерази. Також надзвичайно важливими є гени великої субодиниці РуБісКо та 28 фотосинтетичних тилакоїдних білків[11].
Синтез білків
Синтез білків у хлоропластах відбувається завдяки функціонуванню РНК-полімерази, гени якої знаходяться в пластомі. Даний фермент дуже нагадує РНК-полімеразу бактерій. Хлоропласт також містить другу РНК-полімеразу, гени якої закодовані в ядерному геномі. Ці полімерази розпізнають та приєднуються до промоторів пластому[12]. Варто також зазначити, що пластидні рибосоми є подібними до бактеріальних рибосом, що вкотре підтверджує ендосимбіотичну теорію[13].
РНК редагування в пластидах
РНК редагування включає в себе інсерцію, делецію, заміну нуклеотидів в транскрипті мРНК перед початком трансляції. Високо оксидативне середовище, що спостерігається в стромі, збільшує частоту мутації, тому у пластидах важливу роль відіграє посттранскрипційне редагування. Хлоропластна едитосома замінює Ц на У та У на Ц в певних специфічних ділянках. Вона приєднується до цис-послідовності перед сайтом, що потребує редагування. Сотні PPR-білків задіяні в процесі редагування РНК[14].
Цікавим є те, що наземні рослини мають сотні сайтів редагування, а квітучі рослини від 30 до 40 сайтів редагування. Паразитичні ж рослини втратили здатність до редагування, що призвело до втрати фотосинтетичної активності[15].
ДНК реплікація
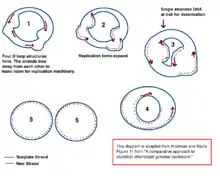
На сьогодні немає остаточно прийнятої версії щодо механізмів реплікації пластому. З 1970 років вчені намагалися дослідити цей процес за допомогою мікроскопу. Ці дослідження посприяли створенню теорії про реплікацію шляхом утворення D-кільця. Також ця теорія підтверджується даними про кількість подій дезамінування, що спостерігається в пластомі[16].
Альтернативна модель заснована на думці, що пластом є лінійною молекулою ДНК. Тоді пластом підлягає гомологічній рекомбінації та утворюються структури, подібні на структури бактеріофагу Т4[17].
Більш прийнятою теорією, все ж, вважається наявність пластому у вигляді кільцевої молекули. Лінійні варіанти, що виявляються при дослідженнях вважають за розриви у кільцевій молекулі.
Таргетинг та імпорт білків
Так як наявні відомості про перенесення деяких генів з пластому у ядерний геном, то для правильного функціонування хлоропластів потрібен механізм зворотнього транспорту синтезованих у цитозолі білків.
Цікаво, що не всі білки повертаються назад у пластиди. Багато з них набули нових функції: участь у клітинному поділі, транспортування білків та розвиток стійкості до хвороб. Кілька генів перемістилися у мітохондріальний геном і стали нефункціональними псевдогенами. Виключенням є гени тРНК, що функціонують у мітохондріях[18].
Так як при набутті хлоропластів клітина-хазяїн уже мала мітохондрій, пероксисосми та інші мембранні органели, необхідно було розробити систему націлювання та транспорту, специфічну для пластид.
Цитоплазматична трансляція та N-кінцеві транзитні послідовності
для спрямування поліпептиду до хлоропласту N-кінці поліпетидів мають транзитні пептичні послідовності, що з часом розщеплюються. N-кінцеві транзитні послідовності також називають препослідовностями, оскільки вони розташовані на «передньому» кінці поліпептиду — рибосоми синтезують поліпептиди від N-кінця до С-кінця.
Транспортні пептиди хлоропластів демонструють величезні варіації довжини та послідовності амінокислот. Вони можуть мати довжину від 20 до 150 амінокислот — надзвичайно велика довжина, що свідчить про те, що транзитні пептиди насправді є сукупністю доменів з різними функціями. Пептиди зазвичай мають позитивний заряд, багаті гідроксильованими амінокислотами такими як серин, треонін і пролін, і бідні кислими амінокислотами, такими як аспарагінова кислота і глутамінова кислота.
Проте не всі білки хлоропластів містять N-кінцевий транзитний пептид, що розщеплюється. Деякі включають транзитну послідовність всередині функціональної частини самого білка. Натомість деякі мають свою транзитну послідовність на C-кінці[19].
Фосфорилювання, шаперони та транспорт
Після того як поліпептид хлоропласту синтезується на рибосомі в цитозолі, енергія АТФ може бути використана для фосфорилювання транзитних послідовностей. Серин і треонін (обидва дуже поширені в транзитних послідовностях хлоропластів — складають 20–30% послідовності) часто є амінокислотами, які приймають фосфатну групу. Фермент, який здійснює фосфорилювання, є специфічним для поліпептидів хлоропластів і ігнорує ті, які призначені для мітохондрій або пероксисом.
Фосфорилювання змінює форму поліпептиду, полегшуючи приєднання 14-3-3 білків до поліпептиду. У рослинах 14-3-3 білки зв'язуються лише з пребілками хлоропластів. Також пребілки можуть зв'язуватися з білками теплового шоку Hsp70. Це важливо, оскільки таке зв'язування не дає білкам хлоропластів прийняти активну форму і виконувати свої функції хлоропластів у неправильному місці — цитозолі. У той же час вони повинні мати таку форму, щоб їх можна було розпізнати та імпортувати в хлоропласт.
Білок теплового шоку і білки 14-3-3 разом утворюють цитозольний направляючий комплекс, який полегшує імпорт поліпептиду хлоропласту в хлоропласт[19].
Транслокон на зовнішній мембрані хлоропласту (TOC)
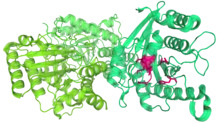
Комплекс TOC, або транслокон на зовнішній мембрані хлоропласту, являє собою сукупність білків, які імпортують препротеїни через зовнішню мембрану хлоропласту. Було ідентифіковано п’ять субодиниць комплексу TOC — два GTP-зв’язуючі білки Toc34 і Toc159, білковий тунель імпорту Toc75, а також білки Toc64 і Toc12.
Перші три білки утворюють серцевий комплекс, який складається з одного Toc159, чотирьох-п’яти Toc34 і чотирьох Toc75, які утворюють чотири отвори на площині 13 нанометрів в діаметрі. Весь коровий комплекс важить близько 500 кДа. Два інших білки, Toc64 і Toc12, пов'язані з основним комплексом, але не є його частиною[20].
Транслокон на внутрішній мембрані хлоропласту (TIC)
Комплекс TІC, або транслокон на внутрішній мембрані хлоропласту є білковим комплексом, який імпортує білки через внутрішню оболонку хлоропласту. Поліпептидні ланцюги хлоропластів, ймовірно, часто проходять через два комплекси одночасно, але комплекс TIC також може відновлювати пребілки, втрачені в міжмембранному просторі.
Як і транслокон TOC, транслокон TIC має великий серцевий комплекс, оточений деякими слабо асоційованими периферичними білками, такими як Tic110, Tic40 і Tic21. Основний комплекс важить близько мільйона дальтон і містить Tic214, Tic100, Tic56 і Tic20 I, можливо, по три субодиниці кожного з білків[21].
Примітки
- Stocking, C.R.; Gifford, E.M. (1959-09). Incorporation of thymidine into chloroplasts of Spirogyra. Biochemical and Biophysical Research Communications (англ.) 1 (3). с. 159–164. doi:10.1016/0006-291X(59)90010-5. Процитовано 2 грудня 2021.
- Ris, Hans; Plaut, Walter (1 червня 1962). ULTRASTRUCTURE OF DNA-CONTAINING AREAS IN THE CHLOROPLAST OF CHLAMYDOMONAS. Journal of Cell Biology (англ.) 13 (3). с. 383–391. ISSN 1540-8140. doi:10.1083/jcb.13.3.383. Процитовано 2 грудня 2021.
- Shinozaki, K.; Ohme, M.; Tanaka, M.; Wakasugi, T.; Hayashida, N.; Matsubayashi, T.; Zaita, N.; Chunwongse, J. та ін. (1986-09). The complete nucleotide sequence of the tobacco chloroplast genome: its gene organization and expression. The EMBO Journal (англ.) 5 (9). с. 2043–2049. doi:10.1002/j.1460-2075.1986.tb04464.x. Процитовано 2 грудня 2021.
- Пластом // Биологический энциклопедический словарь.
- Shaw, Joey; Lickey, Edgar B.; Schilling, Edward E.; Small, Randall L. (2007-03). Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: the tortoise and the hare III. American Journal of Botany (англ.) 94 (3). с. 275–288. ISSN 0002-9122. doi:10.3732/ajb.94.3.275. Процитовано 2 грудня 2021.
- Burgess, Jeremy (1985). An introduction to plant cell development. Cambridge [Cambridgeshire]: Cambridge University Press. ISBN 0-521-30273-0. OCLC 11158875.
- Sandelius, Anna Stina; Aronsson, Henrik (2009). The chloroplast : interactions with the environment. Berlin: Springer. ISBN 978-3-540-68696-5. OCLC 314183729.
- Kolodner, R.; Tewari, K. K. (1 січня 1979). Inverted repeats in chloroplast DNA from higher plants. Proceedings of the National Academy of Sciences (англ.) 76 (1). с. 41–45. ISSN 0027-8424. PMC PMC382872. PMID 16592612. doi:10.1073/pnas.76.1.41. Процитовано 2 грудня 2021.
- Palmer, Jeffrey D.; Thompson, William F. (1982-06). Chloroplast DNA rearrangements are more frequent when a large inverted repeat sequence is lost. Cell (англ.) 29 (2). с. 537–550. doi:10.1016/0092-8674(82)90170-2. Процитовано 2 грудня 2021.
- Kobayashi, Tamaki; Takahara, Manabu; Miyagishima, Shin-ya; Kuroiwa, Haruko; Sasaki, Narie; Ohta, Niji; Matsuzaki, Motomichi; Kuroiwa, Tsuneyoshi (2002-07). Detection and Localization of a Chloroplast-Encoded HU-Like Protein That Organizes Chloroplast Nucleoids. The Plant Cell (англ.) 14 (7). с. 1579–1589. ISSN 1040-4651. PMC PMC150708. PMID 12119376. doi:10.1105/tpc.002717. Процитовано 2 грудня 2021.
- Berry, James O.; Yerramsetty, Pradeep; Zielinski, Amy M.; Mure, Christopher M. (2013-11). Photosynthetic gene expression in higher plants. Photosynthesis Research (англ.) 117 (1-3). с. 91–120. ISSN 0166-8595. doi:10.1007/s11120-013-9880-8. Процитовано 2 грудня 2021.
- Hedtke, Boris; Börner, Thomas; Weihe, Andreas (8 серпня 1997). Mitochondrial and Chloroplast Phage-Type RNA Polymerases in Arabidopsis. Science (англ.) 277 (5327). с. 809–811. ISSN 0036-8075. doi:10.1126/science.277.5327.809. Процитовано 2 грудня 2021.
- Harris, E H; Boynton, J E; Gillham, N W (1994-12). Chloroplast ribosomes and protein synthesis. Microbiological Reviews (англ.) 58 (4). с. 700–754. ISSN 0146-0749. doi:10.1128/mr.58.4.700-754.1994. Процитовано 2 грудня 2021.
- Takenaka, Mizuki; Zehrmann, Anja; Verbitskiy, Daniil; Härtel, Barbara; Brennicke, Axel (23 листопада 2013). RNA Editing in Plants and Its Evolution. Annual Review of Genetics (англ.) 47 (1). с. 335–352. ISSN 0066-4197. doi:10.1146/annurev-genet-111212-133519. Процитовано 2 грудня 2021.
- Tillich, Michael; Krause, Kirsten (2010-07). The ins and outs of editing and splicing of plastid RNAs: lessons from parasitic plants. New Biotechnology (англ.) 27 (3). с. 256–266. doi:10.1016/j.nbt.2010.02.020. Процитовано 2 грудня 2021.
- Krishnan, Neeraja M; Rao, Basuthkar J (2009). A comparative approach to elucidate chloroplast genome replication. BMC Genomics (англ.) 10 (1). с. 237. ISSN 1471-2164. PMC PMC2695485. PMID 19457260. doi:10.1186/1471-2164-10-237. Процитовано 2 грудня 2021.
- Bendich, Arnold J. (2004-07). Circular Chloroplast Chromosomes: The Grand Illusion. The Plant Cell (англ.) 16 (7). с. 1661–1666. ISSN 1040-4651. PMC PMC514151. PMID 15235123. doi:10.1105/tpc.160771. Процитовано 2 грудня 2021.
- Martin, W.; Rujan, T.; Richly, E.; Hansen, A.; Cornelsen, S.; Lins, T.; Leister, D.; Stoebe, B. та ін. (17 вересня 2002). Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus. Proceedings of the National Academy of Sciences (англ.) 99 (19). с. 12246–12251. ISSN 0027-8424. PMC PMC129430. PMID 12218172. doi:10.1073/pnas.182432999. Процитовано 2 грудня 2021.
- Soll, Jürgen; Schleiff, Enrico (2004-03). Protein import into chloroplasts. Nature Reviews Molecular Cell Biology (англ.) 5 (3). с. 198–208. ISSN 1471-0072. doi:10.1038/nrm1333. Процитовано 2 грудня 2021.
- Wise, Robert R.; Hoober, J. Kenneth (2006). The structure and function of plastids. Dordrecht: Springer. ISBN 978-1-4020-4060-3. OCLC 883595937.
- Kikuchi, Shingo; Bédard, Jocelyn; Hirano, Minako; Hirabayashi, Yoshino; Oishi, Maya; Imai, Midori; Takase, Mai; Ide, Toru та ін. (2013-02). Uncovering the Protein Translocon at the Chloroplast Inner Envelope Membrane. Science (англ.) 339 (6119). с. 571–574. ISSN 0036-8075. doi:10.1126/science.1229262. Процитовано 2 грудня 2021.
Література
- С.Г. Инге-Вечтомов. Генетика с основами селекции. — Санкт-Петербург : Издательство Н-Л, 2010. — С. 270—271. — ISBN 978-5-94869-105-3.