Тофацитиніб
Тофацитиніб англ. Tofacitinib, лат. Tofacitinibum) — синтетичний лікарський препарат, який випускається під торговою назвою «Ксельянз», та застосовується для лікування ревматоїдного артриту, псоріатичного артриту та неспецифічного виразкового коліту.[1][2][3][4]
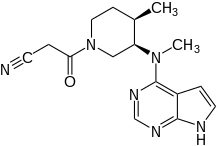 | |
| Систематична назва (IUPAC) | |
| 3-[(3R,4R)-4-Methyl-3-[methyl(7H-pyrrolo[2,3-d]pyrimidin-4-yl)amino]piperidin-1-yl]-3-oxopropanenitrile | |
| Ідентифікатори | |
| Номер CAS | |
| Код ATC | L04 |
| PubChem | |
| DrugBank | |
| Хімічні дані | |
| Формула | C16H20N6O |
| Мол. маса | 312,377 г/моль |
| SMILES | & |
| Фармакокінетичні дані | |
| Біодоступність | 74% |
| Метаболізм | гепатичний |
| Період напіврозпаду | 3 год. |
| Виділення | Нирки |
| Терапевтичні застереження | |
| Кат. вагітності | |
| Лег. статус | |
| Використання | перорально |
Найчастішими побічними ефектами препарату є діарея, головний біль та підвищення артеріального тиску.[3] Серйозними побічними ефектами препарату є також інфекції, різні види раку та тромбоемболія легеневої артерії.[5][3] У 2019 році комітет з безпеки лікарських засобів Європейського агентства з лікарських засобів розпочав перегляд клінічного дослідження тофацитинібу, і рекомендував лікарям тимчасово не призначати дозу 10 мг двічі на добу особам з високим ризиком тромбоемболії легеневої артерії.[6] У США FDA також видало попередження про ризик тромбоутворення при застосуванні тофацитинібу.[7][8][9] Важливим побічним ефектом аналогів препарату є серйозні бактеріальні, мікобактеріальні, грибкові та вірусні інфекції. У ІІІ фазі клінічного дослідження тофацитинібу серед опортуністичних інфекцій повідомлялося про 3 випадки туберкульозу легень, усі з яких спочатку мали негативні результати скринінгу на туберкульоз.[10]
Тофацитиніб відноситься до групи інгібіторів янускіназ[1][2], та розроблений сумісно Національним інститутом охорони здоров'я США та компанією «Pfizer». Тофацитиніб є невеликою молекулою, та не є природним препаратом.[11] Станом на червень 2021 року в США доступні генеричні препарати тофацитинібу.[12][13]
Медичне застосування
Ревматоїдний артрит
Тофацитиніб у вигляді цитрату схвалений для медичного застосування в США із показанням для лікування дорослих хворих із помірно важкою активністю ревматоїдного артриту, в яких спостерігалась неадекватна відповідь на лікування метотрексатом, або для хворих, які не переносять його.[14][1]
У Європейському Союзі тофацитинібу цитрат схвалений для лікування помірного та тяжкого активного ревматоїдного артриту в дорослих у комбінації з метотрексатом, які неадекватно реагують на один або кілька хворобо-модифікуючих протиревматичних препаратів, або не переносять цих препаратів. Тофацитиніб також може застосовуватися як монотерапію у разі непереносимості метотрексату або якщо лікування метотрексатом не дало ефекту.[2]
Неспецифічний виразковий коліт
У травні 2018 року FDA схвалило застосування тофацитинібу у США для лікування дорослих хворих середньою та тяжкою формою неспецифічного виразкового коліту.[4] Тофацитинібу цитрат став першим пероральним інгібітором янускіназ, дозволеним для застосування при хронічному виразковому коліті.
Побічна дія
Спочатку тофацитиніб не був схвалений європейськими регулюючими органами через побоювання щодо ефективності та безпеки[15], хоча до 2018 року Європейська комісія схвалила препарат для клінічного застосування.[16] У дослідженнях на тваринах із застосуванням тофацитинібу, проведені до досліджень на людях, виявлено низку випадків канцерогенезу, мутагенезу та зниження фертильності.[1]
Найчастішими побічними реакціями, про які повідомлялося протягом перших 3 місяців контрольованих клінічних досліджень (що виникали у 2 % або більше хворих, які отримували монотерапію тофацитинібом або в комбінації з хворобо-модифікуючими протиревматичними препаратами), були інфекції верхніх дихальних шляхів, головний біль, діарея та назофарингіт («застуда»).[1]
FDA вимагає, щоб на етикетці тофацитинібу знаходилось обрамлене застереження про можливі травми та смерть у зв'язку з імовірним розвитком таких хвороб, як інфекції, лімфоми та інших злоякісних новоутворень, які можуть виникнути внаслідок застосування цього препарату.[14] У хворих, які отримували тофацитиніб, спостерігались випадки серйозних інфекцій, що призвели до госпіталізації або смерті, включно з туберкульозом та іншими бактеріальними, інвазивними грибковими, вірусними та іншими опортуністичними інфекціями. У хворих з трансплантованою ниркою, які приймали тофацитиніб під час лікування імуносупресивними препаратами, спостерігається підвищена частота посттрансплантаційних лімфопроліферативних розладів, спричинених вірусом Епштейна-Барр. Хворим рекомендується уникати застосування тофацитинібу у випадку появи активної серйозної інфекції, включаючи локалізовані інфекції. Лікарі радять застосовувати препарат з обережністю тим хворим, у яких є підвищений ризик перфорації органів шлунково-кишкового тракту. При застосуванні тофацитинібу рекомендується лабораторний контроль у зв'язку з потенційними змінами кількості лімфоцитів, нейтрофілів, гемоглобіну, ферментів печінки та фракцій ліпідів. Стверджується, що тофацитиніб не має протипоказань до застосування, проте лікарі радять зменшити дозу хворим, які приймають препарат у поєднанні з сильними інгібіторами цитохрому Р-450, зокрема кетоконазолом, або з одним або декількома препаратами, які призводять до помірного інгібування CYP3A4 і сильного інгібування CYP2C19, зокрема флуконазолом. Крім того, хворим, які приймають тофацитиніб, слід уникати імунізації живими вакцинами.[1]
Згідно даних постмаркетингових досліджень, тофацитиніб також може підвищувати ризик тромбоемболії легеневої артерії. Перед призначенням цього препарату лікарі повинні враховувати фактори ризику розвитку тромбоемболії легеневої артерії, включаючи вік, ожиріння, куріння та іммобілізацію. У хворих, які приймають цей препарат, незалежно від показань або факторів ризику, слід проводити контроль щодо появи ознак та симптомів тромбоемболії легеневої артерії.[17]
Механізм дії
Тофацитиніб є інгібітором янускінази-1 та янускінази-3, наслідком чого є інгібування сигнального шляху JAK-STAT, який передає позаклітинну інформацію в ядро клітини, впливаючи на транскрипцію ДНК.[18] На мишачій моделі симптоматичного артриту тофацитиніб швидко покращував перебіг захворювання, пригнічуючи продукцію медіаторів запалення та пригнічуючи STAT1-залежні гени в тканині суглоба. Ця ефективність на цій моделі хвороби корелювала з пригніченням сигнальних шляхів як янускінази-1, так і янускінази-3, що свідчить про те, що тофацитиніб може спричинювати лікувальний ефект не лише через механізми, які є наслідком інгібування янускінази-3.[19]
Історія створення
Потенційне значення інгібування янускінази-3 вперше було виявлено в імунологічній лабораторії Джона О'Ші в Національному інституті артриту, кістково-м'язових і шкірних захворювань Національного інституту охорони здоров'я США. У 1994 році Національний інститут охорони здоров'я звернувся до компанії «Pfizer» з проханням створити державно-приватне партнерство для оцінки та виведення на ринок експериментальних сполук на основі цього дослідження. Спочатку «Pfizer» відмовився від партнерства, але в 1996 році погодився з цією пропозицією, після скасування політики інституту, згідно якої ринкова ціна продукту, отриманого в результаті такого партнерства, повинна бути співмірною з інвестиціями державних доходів платників податків і потребами сфери охорони здоров'я та безпеки при застосуванні.[20] Компанія «Pfizer» співпрацювала з лабораторією О'Ші у визначенні структури та функції янускінази-3 та її рецепторів, а потім займалася відкриттям лікарських препаратів, доклінічною розробкою та клінічною розробкою тофацитинібу власними силами.[21]
Під час розробки препарат отримав кодову назву «CP-690550».[22] Спочатку рекомендованою назвою згідно номенклатури МНН була «тазоцитиніб»[23], але ця назва була скасована в процесі затвердження МНН, оскільки вона не оптимально відрізнялась від інших існуючих МНН, після чого препарату було запропоновано назву «тофацитиніб», яка й була затверджена.
У листопаді 2012 року FDA схвалило тофацитиніб для лікування ревматоїдного артриту. Два ревматологи під час опитування журналу «Nature Biotechnology», поскаржилися, що були «шоковані» та «розчаровані» оптовою ціною препарату в 2055 доларів на місяць.[21]
Дослідження 2014 року показало, що застосування тофацитинібу було здатне перетворити білу жирову тканину в більш метаболічно активну буру жирову тканина, що свідчить про те, що він потенційно може застосовуватися в лікуванні ожиріння.[24]
У листопаді 2012 року FDA схвалило тофацитиніб для лікування ревматоїдного артриту з помірною та важкою активністю в дорослих, які мали неадекватну відповідь на лікування метотрексатом, або які не переносять метотрексат.[14] FDA схвалило застосування препарату в дозі лише 5 мг двічі на добу на тій підставі, що більша доза не вважалася такою, що має адекватне співвідношення ризик-користь.[25]
Клінічні дослідження
Тофацитиніб у III фазі клінічного дослідження продемонстрував ефективність у лікуванні псоріазу. У клінічних дослідженнях вивчається ефективність препарату для лікування неспецифічного виразкового коліту[26][27], та інших імунологічних захворювань, а також для профілактики реакції відторгнення трансплантату.[28][29][30][31]
Псоріаз
Тофацитиніб досліджується для лікування псоріазу. У III фазі рандомізованих контрольованих клінічних дослідженнях продемонстровано його ефективність при бляшковому псоріазі у порівнянні з плацебо та етанерцептом.[32][25][33] Зокрема, у дослідженні було показано, що доза тофацитинібу по 10 мг двічі на добу не поступається етанерцепту в дозі 50 мг підшкірно двічі на тиждень.[32] Схвалення тофацитинібу для лікування псоріазу було відхилено FDA з причин безпечності препарату.[34]
Гніздова алопеція
На основі доклінічних досліджень на мишачій моделі хвороби[35] тофацитиніб досліджувався для лікування гніздової алопеції. Початкові звіти за результами клінічних досліджень[36][37] припускали потенційну ефективність препарату, як і відкрите клінічне дослідження II фази[38], результати якого опубліковані разом із клінічним дослідженням II фази, яке показало подібні результати для руксолітинібу.[39]
Вітиліго
У звіті про випадок у червні 2015 року в 53-річної жінки з вітиліго спостерігалось помітне поліпшення після 5 місяців прийому тофацитинібу.[40]
Атопічний дерматит
У вересні 2015 року були опубліковані результати застосування тофацитинібу у 6 пацієнтів із тривало перебігаючим атопічним дерматитом. У всіх спостерігалося покращення стану без будь-яких побічних ефектів.[41]
Анкілозуючий спондилоартрит
У 2016 році проводилась II фаза клінічних досліджень застосування тофацитинібу при анкілозуючому спондилоартриті.[42]
Примітки
- Xeljanz- tofacitinib tablet, film coated Xeljanz XR- tofacitinib tablet, film coated, extended release Xeljanz- tofacitinib solution. DailyMed. 2 жовтня 2020. Процитовано 3 листопада 2020. (англ.)
- Xeljanz EPAR. European Medicines Agency (EMA). Процитовано 3 листопада 2020. (англ.)
- Tofacitinib Citrate. The American Society of Health-System Pharmacists. Процитовано 1 червня 2018. (англ.)
- FDA approves new treatment for moderately to severely active ulcerative colitis. U.S. Food and Drug Administration (FDA) (прес-реліз). 30 травня 2018. Архів оригіналу за 15 грудня 2019. Процитовано 1 червня 2018. (англ.)
- Safety Alerts for Human Medical Products - Xeljanz, Xeljanz XR (tofacitinib): Safety Communication - Safety Trial Finds Increased Risk of Blood Clots in the Lungs and Death with Higher Dose in Rheumatoid Arthritis Patients. U.S. Food and Drug Administration (FDA). Процитовано 2 березня 2019. (англ.)
- Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 13-16 May 2019, May 17, 2019. European Medicines Agency. Процитовано 17 травня 2019. (англ.)
- Xeljanz, Xeljanz XR (tofacitinib): Drug Safety Communication - Due to an Increased Risk of Blood Clots and Death with Higher Dose. U.S. Food and Drug Administration (FDA). 26 липня 2019. Архів оригіналу за 15 2019. Процитовано 10 серпня 2019. (англ.)
- FDA approves Boxed Warning about increased risk of blood clots and death with higher dose of arthritis and ulcerative colitis medicine tofacitinib (Xeljanz, Xeljanz XR). Процитовано 15 грудня 2019. (англ.)
- FDA approves Boxed Warning about increased risk of blood clots and death with higher dose of arthritis and ulcerative colitis medicine tofacitinib (Xeljanz, Xeljanz XR). U.S. Food and Drug Administration. 15 грудня 2019. Архів оригіналу за 15 грудня 2019. Процитовано 15 грудня 2019. (англ.)
- O'Shea JJ, Kontzias A, Yamaoka K, Tanaka Y, Laurence A (Квітень 2013). Janus kinase inhibitors in autoimmune diseases. Annals of the Rheumatic Diseases. 72 Suppl 2 (suppl 2): ii111–5. PMC 3616338. PMID 23532440. doi:10.1136/annrheumdis-2012-202576. (англ.)
- Marren AS (2017). Tofacitinib is not a biologic. Annals of Gastroenterology 30 (1): 134. PMC 5198242. PMID 28042254. doi:10.20524/aog.2016.0094. (англ.)
- Tofacitinib citrate: FDA-Approved Drugs. U.S. Food and Drug Administration (FDA). Процитовано 24 вересня 2021. (англ.)
- Tofacitinib: FDA-Approved Drugs. U.S. Food and Drug Administration (FDA). Процитовано 24 вересня 2021. (англ.)
- FDA approves Xeljanz for rheumatoid arthritis. U.S. Food and Drug Administration (FDA) (прес-реліз). 6 листопада 2012. Архів оригіналу за 2 квітня 2014. (англ.)
- Nordqvist C (27 квітня 2013). Pfizer's Arthritis Drug Xeljanz (tofacitinib) Receives A Negative Opinion In Europe. Medical News Today. Процитовано 2 серпня 2013. (англ.)
- McKee S (29 червня 2018). EU approves Pfizer's Xeljanz for psoriatic arthritis. PharmaTimes (англ.). Процитовано 3 червня 2019.
- FDA Warns of Risk for PE, Death With Higher Dose Tofacitinib (Xeljanz) for RA — Medscape — Feb 25, 2019. (англ.)
- Tofacitinib. Drugs in R&D 10 (4): 271–84. 2010. PMC 3585773. PMID 21171673. doi:10.2165/11588080-000000000-00000. (англ.)
- Ghoreschi K, Jesson MI, Li X, Lee JL, Ghosh S, Alsup JW, Warner JD, Tanaka M, Steward-Tharp SM, Gadina M, Thomas CJ, Minnerly JC, Storer CE, LaBranche TP, Radi ZA, Dowty ME, Head RD, Meyer DM, Kishore N, O'Shea JJ (Квітень 2011). Modulation of innate and adaptive immune responses by tofacitinib (CP-690,550). Journal of Immunology 186 (7): 4234–43. PMC 3108067. PMID 21383241. doi:10.4049/jimmunol.1003668. (англ.)
- «Seeking Profit for Taxpayers in Potential of New Drug» (англ.)
- Garber K (Січень 2013). Pfizer's first-in-class JAK inhibitor pricey for rheumatoid arthritis market. Nature Biotechnology 31 (1): 3–4. PMID 23302910. doi:10.1038/nbt0113-3. (англ.)
- Kremer JM, Bloom BJ, Breedveld FC, Coombs JH, Fletcher MP, Gruben D, Krishnaswami S, Burgos-Vargas R, Wilkinson B, Zerbini CA, Zwillich SH (Липень 2009). The safety and efficacy of a JAK inhibitor in patients with active rheumatoid arthritis: Results of a double-blind, placebo-controlled phase IIa trial of three dosage levels of CP-690,550 versus placebo. Arthritis and Rheumatism 60 (7): 1895–905. PMID 19565475. doi:10.1002/art.24567. (англ.)
- Herper M (2 березня 2011). Why Pfizer's Biggest Experimental Drug Got A Name Change. Forbes. Процитовано 3 березня 2011. (англ.)
- Moisan A (2014). White-to-brown metabolic conversion of human adipocytes by JAK inhibition. Nature Cell Biology 17 (1): 57–67. PMC 4276482. PMID 25487280. doi:10.1038/ncb3075. (англ.)
- Di Lernia V, Bardazzi F (Січень 2016). Profile of tofacitinib citrate and its potential in the treatment of moderate-to-severe chronic plaque psoriasis. Drug Design, Development and Therapy 10: 533–9. PMC 4743637. PMID 26889081. doi:10.2147/DDDT.S82599. (англ.)
- Vuitton L, Koch S, Peyrin-Biroulet L (Листопад 2013). Janus kinase inhibition with tofacitinib: changing the face of inflammatory bowel disease treatment. Current Drug Targets 14 (12): 1385–91. PMID 23627915. doi:10.2174/13894501113149990160. (англ.)
- Zand MS (Липень 2013). Tofacitinab in renal transplantation. Transplantation Reviews 27 (3): 85–9. PMC 3713609. PMID 23849222. doi:10.1016/j.trre.2013.04.001. (англ.)
- Kirk AD, Knechtle SJ, Larsen CP, Madsen JC, Pearson TC, Webber SA (21 липня 2014). Textbook of Organ Transplantation Set. John Wiley & Sons. с. 245–. ISBN 978-1-118-88962-6. (англ.)
- Wojciechowski D, Vincenti F (Вересень 2013). Tofacitinib in kidney transplantation. Expert Opinion on Investigational Drugs 22 (9): 1193–9. PMID 23841583. doi:10.1517/13543784.2013.811231. (англ.)
- Myrvang H (Червень 2012). Transplantation: Tofacitinib safe and effective in renal transplant recipients. Nature Reviews. Nephrology 8 (8): 432. PMID 22735765. doi:10.1038/nrneph.2012.120. (англ.)
- Kalluri HV, Hardinger KL (Серпень 2012). Current state of renal transplant immunosuppression: Present and future. World Journal of Transplantation 2 (4): 51–68. PMC 3782235. PMID 24175197. doi:10.5500/WJT.v2.i4.51. (англ.)
- Bachelez H, van de Kerkhof PC, Strohal R, Kubanov A, Valenzuela F, Lee JH, Yakusevich V, Chimenti S, Papacharalambous J, Proulx J, Gupta P, Tan H, Tawadrous M, Valdez H, Wolk R (Серпень 2015). Tofacitinib versus etanercept or placebo in moderate-to-severe chronic plaque psoriasis: a phase 3 randomised non-inferiority trial. Lancet 386 (9993): 552–61. PMID 26051365. doi:10.1016/S0140-6736(14)62113-9. (англ.)
- Papp KA, Menter MA, Abe M, Elewski B, Feldman SR, Gottlieb AB, Langley R, Luger T, Thaci D, Buonanno M, Gupta P, Proulx J, Lan S, Wolk R (Жовтень 2015). Tofacitinib, an oral Janus kinase inhibitor, for the treatment of chronic plaque psoriasis: results from two randomized, placebo-controlled, phase III trials. The British Journal of Dermatology 173 (4): 949–61. PMID 26149717. doi:10.1111/bjd.14018. (англ.)
- Pfizer Receives Complete Response Letter from FDA for Oral Xeljanz (tofacitinib citrate) Supplemental New Drug Application for Moderate to Severe Chronic Plaque Psoriasis (прес-реліз). Pfizer. 14 жовтня 2015. (англ.)
- Xing L, Dai Z, Jabbari A, Cerise JE, Higgins CA, Gong W, de Jong A, Harel S, DeStefano GM, Rothman L, Singh P, Petukhova L, Mackay-Wiggan J, Christiano AM, Clynes R (Вересень 2014). Alopecia areata is driven by cytotoxic T lymphocytes and is reversed by JAK inhibition. Nature Medicine 20 (9): 1043–9. PMC 4362521. PMID 25129481. doi:10.1038/nm.3645. (англ.)
- Craiglow BG, King BA (Грудень 2014). Killing two birds with one stone: oral tofacitinib reverses alopecia universalis in a patient with plaque psoriasis. The Journal of Investigative Dermatology 134 (12): 2988–2990. PMID 24940651. doi:10.1038/jid.2014.260. (англ.)
- Jabbari A, Nguyen N, Cerise JE, Ulerio G, de Jong A, Clynes R, Christiano AM, Mackay-Wiggan J (Серпень 2016). Treatment of an alopecia areata patient with tofacitinib results in regrowth of hair and changes in serum and skin biomarkers. Experimental Dermatology 25 (8): 642–3. PMC 4963264. PMID 27119625. doi:10.1111/exd.13060. (англ.)
- Kennedy Crispin M, Ko JM, Craiglow BG, Li S, Shankar G, Urban JR, Chen JC, Cerise JE, Jabbari A, Winge MC, Marinkovich MP, Christiano AM, Oro AE, King BA (Вересень 2016). Safety and efficacy of the JAK inhibitor tofacitinib citrate in patients with alopecia areata. JCI Insight 1 (15): e89776. PMC 5033755. PMID 27699252. doi:10.1172/jci.insight.89776. (англ.)
- Mackay-Wiggan J, Jabbari A, Nguyen N, Cerise JE, Clark C, Ulerio G, Furniss M, Vaughan R, Christiano AM, Clynes R (Вересень 2016). Oral ruxolitinib induces hair regrowth in patients with moderate-to-severe alopecia areata. JCI Insight 1 (15): e89790. PMC 5033756. PMID 27699253. doi:10.1172/jci.insight.89790. (англ.)
- Craiglow BG, King BA (Жовтня 2015). Tofacitinib Citrate for the Treatment of Vitiligo: A Pathogenesis-Directed Therapy. JAMA Dermatology 151 (10): 1110–2. PMID 26107994. doi:10.1001/jamadermatol.2015.1520. (англ.)
- Levy LL, Urban J, King BA (Вересень 2015). Treatment of recalcitrant atopic dermatitis with the oral Janus kinase inhibitor tofacitinib citrate. Journal of the American Academy of Dermatology 73 (3): 395–9. PMID 26194706. doi:10.1016/j.jaad.2015.06.045. (англ.)
- AS: Is Tofacitinib the Next Big Thing? Nov 2016 (англ.)
Посилання
- Tofacitinib. Drug Information Portal. U.S. National Library of Medicine. (англ.)
- Tofacitinib citrate. Drug Information Portal. U.S. National Library of Medicine. (англ.)
- Serious heart problems and cancer with Xeljanz (tofacitinib). U.S. Food and Drug Administration (FDA). 4 лютого 2021. (англ.)