Цитохром Р-450
Цитохроми Р450 — надродина монооксигеназ (офіційне скорочення CYP), являє собою важливий класс металопротеїнів, також це велика і різноманітна група ферментів, які каталізують реакції окиснення органічних речовин. Субстратами монооксигеназ виступають проміжні метаболіти, такі як ліпіди і стероїдні гормони, а також ксенобіотики, такі як фармацевтичні препарати та інших токсичних хімічних речовин. CYP є основними ферментами, що беруть участь у метаболізмі ліків. Монооксигеназні реакції складають близько 75% від загальної кількості різних метаболічних реакцій.
Сама назва цитохром P450 (скорочено P450 або CYP) походить від спектральних властивостей цього гемопротеїну. Цей термін був придуманий Омура і Сато в 1962 році.[1] У своїй відновленій (залізній) формі він зв'язує оксид вуглецю, утворюючи комплекс, який максимально поглинає світло при 450 нм.
Найбільш поширеною реакцією, що каталізується цитохромом P450 є реакцією мікросомального окиснення — включення одного атома кисню в склад аліфатичного органічного субстрату (RH), інший же атом кисню відновлюється до води:
Цитохроми Р450 (CYP) належать до білків, що містять кофактором гем і, отже, є гемопротеїнами. Загалом, ці ферменти є кінцевими ділянками в ланцюгах переносу електронів, що широкому сенсі класифікуються яко P450-вмісні системи. Термін P450 походить від спектрофотометричного піку при довжині хвилі максимуму поглинання ферменту (450 нм), коли він знаходиться у відновленому стані і в комплексі з чадним газом (СО).
Монооксигенази виявлені у всіх форм життя — тварин, рослин, грибів, найпростіших, бактерій, архей, і навіть у вірусів. Однак, цей фермент не було знайдено в E.coli. Відомо більше 18 000 різних CYP.
Більшість CYP потрібен допоміжний білок, для перенесення одного або кількох електронів для відновлення йона Заліза (а в кінцевому підсумку молекулярний кисень). На підставі характеру білків перенесення електронів, CYP можна розділити на кілька груп:
- Мікросомальні P450 системи, в яких електрони передаються від НАДФН через цитохром P450 редуктазу. Цитохром b5 (cyb5) також може сприяти зниження потужності до цієї системи після його відновлення цитохром b5 редуктазою (CYB5R).
- Мітохондріальні P450 системи задіюють адренодоксинредуктазу і адренодоксин для перенесення електронів від НАДФН в P450.
- Бактеріальні Р450 системи використовують в ферредоксинредуктазу і ферредоксин в перенесенні електронів на P450.
- CYB5R/cyb5/P450 системи, в яких обидва електрона, необхідні CYP переходять від цитохрому b5.
- FMN/Fd/P450 системи вперше знайдені у виду Rhodococcus в якому ФМН-залежна редуктаза спаяна з CYP.
- Власне P450 системи не вимагають зовнішнього відновну систему. Відомі з них включають CYP5 (тромбоксан-синтазу), CYP8 (простациклін-синтазу) і CYP74A.
Номенклатура
Гени, що кодують монооксигенази, позначаються абревіатурою CYP та числом, яке вказує сімейства генів, велика літера позначає підродину, а додаткові цифрою — ген. Коли мова йде про ген, його пишуть курсивом. Наприклад, CYP2E1 — ген, який кодує фермент CYP2E1 — один з ферментів, що бере участь у метаболізмі парацетамолу (ацетамінофену). Тим не менш, деякі імена генів або ферментом для CYP можуть відрізнятися від такої номенклатури, позначаючи каталітичну активність і назву сполуки, що використовується яко субстрат. Приклади включають CYP5A1, тромбоксан А2 — синтазу, скорочено TBXAS1 (ThromBoXane A2 Synthase 1), та CYP51A1, ланостерин-14-α-деметилази, іноді неофіційно скорочено LDM або ЛДМ відповідно до його субстрату (Ланостерол) і активність (ДеМетилювання).
Назви деяких генів або ферментів для CYP можуть відрізнятися від цієї номенклатури, позначаючи каталітичну активність і назва з'єднання, що використовується в якості субстрату. Правила номенклатури припускають, що члени нових сімейств CYP повинні мати не менше 40% амінокислотної ідентичності, в той час як члени підсемейств - не менше 55% амінокислотної ідентичності.
Розберемо CYP2D6, також відомий як дебризохін гідроксилази (названий в честь препарату, який призвів до відкриття), CYP2D6 є найбільш відомим і вивченим CYP гена. Цей ген має великий інтерес також завдяки своїй високо поліморфній природі, й також бере участь у перетворені великої кількості ліків, метаболізмі.
| CYP2D6 | Метопролол, пропранолол, кодеїн, декстрометорфан, клозапін, дезипрамін, галоперидол, амітриптилін, іміпрамін |
|---|
Більше 100 генетичних варіантів CYP2D6 були визначені.
Назва гену: цитохром Р450 2D6 (CYP2D6)
Міжнародний код поліморфізму: rs35742686, rs3892097, rs5030655
Назви поліморфізмів: алелі * 1, * 3, * 4, * 5, * 6, * 1xN (мутації, що призводять до зміни активності ферменту). Алель * 1 вважається нормою.
Функція гена: кодує цитохром Р450 2D6, монооксигеназу печінки, є ферментом першої фази детоксикації ксенобіотиків і відповідає за метаболізм 20% ліків, в тому числі протиаритміних, антигіпертензивних і психотропних препаратів, а також бере участь в синтезі холестеролу і інших ліпідів.
Метаболізм препаратів
Відносна кількість Р450, порівняно з редуктазою в печінці, сприяє зростанню рівня гему P450, що обмежує стадії хімічних реакцій, а саме вивільнення препаратів в печінці. Виконує важливі функції:
- Детоксифікацію екзогенних органічних з’єднань, в тому числі й дуже небезпечних й токсичних, які можуть призводити до пошкоджень тканин та органів організму в цілому.
- Біосинтез стероїдів, жовчних кислот, гідроксилювання холестерину та найрізноманітніших ксенобіотиків.
- Метаболізм лікарських засобів/речовин.
Всі препарати, які застосовує пацієнт, проходять один і той же шлях через дві фази.
I фаза метаболізму лікарських засобів – несинтетичні реакції, під час яких, з лікарських засобів відбувається утворення більш гідрофільні сполук внаслідок приєднання або звільнення активних функціональних груп (наприклад, ОН, -NН2, -SН).
Основні реакції I фази - окислення, з них найбільш поширена реакція гідроксилювання (приєднання радикала ОН). Каталізаторами цих реакцій служать оксидази зі змішаною функцією. Їх субстратна специфічність дуже низька, тому вони беруть участь в окисленні лікарських речовин різної хімічної структури. Найбільш важливою ферментативної системою фази I метаболізму є цитохром Р-450, який являє собою сімейство мікросомальних ізоферментів, які каталізують окислення багатьох лікарських засобів. Основним необхідним елементом для цих електронів служить НАДФ-Н-цитохром Р450-редуктаза, та флавопротеїни, що переносять електрони з НАДФ-Н на цитохром Р450. Основною задачею є зробити речовини більш розчиненими і менш токсичними шляхом впровадження гідроксильного радикала.
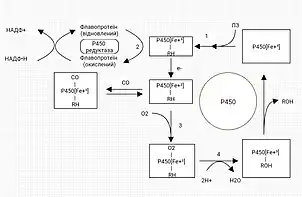
II фаза, в якій можна виділити кілька таких підфаз, що закінчуються метилюванням і кон'югацією з різними речовинами. Для вступу в реакцію II фази в молекулі повинен міститися хімічно активний радикал, до якого може приєднатися кон'югуюча молекула. Найбільш поширені реакції II фази - реакції ацетилювання, метилювання, сульфатування, водної кон'югації. В результаті реакцій ксенобіотики зазвичай повністю втрачають біологічну активність, проте можливе утворення активних метаболітів і канцерогенів. Метаболізм лікарських засобів може здійснюватися в реакціях виключно I або II фази, одночасно в обох або ж послідовно в кожній.
7 мітохондріальних Р450 синтезуються на рибосомах, а потім потрапляють у мітохондрії після протеолітичної обробки. Замість мікросомальної НАДФН-P450 редуктази ці P450 отримують електрони з мітохондріальної електронно-транспортної системи, що складається з флавопротеїну та фередоксину, адренодоксинредуктази НАДФН та адреноксину.
У цьому оксино-відновному процесі ключову роль відіграють два мікросомальні ферменти. Першим із них є флавопротеїн, НАДФН цитохром Р450-оксидоредуктаза. 1 моль цього ферменту містить 1 моль флавінового мононуклеотиду та флавін-аденин-динуклеотиду. Другим мікросомальним ферментом є гемопротеїн, тобто цитохром Р450, який служить кінцевою оксидазою. Насправді мікросомальна мембрана містить кілька форм цього гемопротеїну і ця множинність збільшується шляхом багаторазового введення або впливу екзогенних хімічних речовин.
Лікарські взаємодії
З віком, функціональна активність печінки в процесі метаболізму через ферментну систему CYP450 знижується на ≥ 30% внаслідок зменшення обсягу печінки і кровотоку. Тому лікарські речовини, що метаболізуються даної ферментної системою, у літніх пацієнтів досягають більш високої концентрації і мають тривалий період напіввиведення. Оскільки новонароджені мають недорозвинену систему печінкових ферментів, метаболізм багатьох лікарських засобів у них також утруднений.
Ферменти цитохрому P450 необхідні для метаболізму багатьох ліків. Хоча цей клас містить понад 50 ферментів, шість з них: CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 та CYP3A5 метаболізують 90% ліків, причому двома найбільш значущими ферментами є CYP3A4 та CYP2D6. Ферменти цитохрому P450 (CYP450) Ферменти CYP450 названі так, оскільки вони зв’язані з мембранами всередині клітини (цито) і містять пігмент гему (хром і Р), який поглинає світло на довжині хвилі 450 нм під впливом чадного газу. [6]Експресуються переважно в печінці, але вони також зустрічаються в тонкому кишечнику (зменшуючи біодоступність препарату), легенях, нирках та плаценті. Вони необхідні для виробництва холестерину, стероїдів, простациклінів та тромбоксану А2. Вони також необхідні для детоксикації сторонніх хімікатів та метаболізму ліків.
Генетична мінливість (поліморфізм) цих ферментів може дати певну реакцію пацієнта на загальнопризначені класи препаратів, включаючи бета-адреноблокатори та антидепресанти. Ферменти цитохрому P450 можуть інгібуватися або індукуватися ліками, що призводить до клінічно значущих взаємодій лікарських засобів, які можуть спричиняти непередбачувані побічні реакції або терапевтичні збої. У взаємодії з варфарином, антидепресантами, протиепілептичними препаратами та статинами часто беруть участь ферменти цитохрому Р450. Знання найважливіших препаратів, що метаболізуються ферментами цитохрому P450, а також найпотужніших інгібуючих та індукуючих препаратів може допомогти мінімізувати можливість побічних реакцій та взаємодій лікарських засобів. Хоча тести на генотип можуть визначити, чи є у пацієнта специфічний ферментний поліморфізм, не встановлено, чи рутинне використання цих тестів покращить результати.
Застосування антіцітокінових препаратів дозволило істотно підвищити ефективність терапії різних аутоімунних захворювань. У багатьох випадках вони дозволяють подолати терапевтичну резистентність і поліпшити не тільки найближчий, але й вельми віддалений прогноз при багатьох системних аутоімунних захворюваннях. Взаємодії між моноклональними антитілами (МАТ) і малими молекулами можуть відбуватися на фармакодинамічну рівні за допомогою впливу на рецептори, ліганди і клітини-мішені, а також на фармакокінетичну рівні за допомогою впливу одних ЛЗ на процеси всмоктування, розподілу, метаболізму та елімінації інших ЛЗ. Незважаючи на відсутність метаболізму системою цитохрому Р450, МАТ, тим не менш, можуть впливати на активність ферментів цієї системи.
Нижче приведені дані, щодо взаємодії моноклональних антитіл (МАТ) з лікарськими засобами (ЛЗ) та їх вплив на цитохроми P450(CYP450)[2]
1. Базиліксимаб (сильний селективний імуносупресивний препарат) + Циклоспорин (мунодепресант, селективно діє на Т-лімфоцити) = інгібує CYP3A й підвищує концентрацію циклоспорина. Базиликсимаб + Такролімус (імуносупресивний препарат, який використовується після трансплантації алогенних органів, щоб знизити активність імунної системи й знизити ризик відторгнення органів) = інгібує CYP3A та підвищує концентрацію такролимуса на 63%
2. Муромомаб(має імонодепресивні властивості по відношенню до антигена Т3(CD3) клітин людини, попереджують реакцію відторгнення при трансплантації нирок) + Циклоспорин (мунодепресант, селективно діє на Т-лімфоцити) = інгібує CYP3A й підвищує концентрацію циклоспорина.
3. Тоцилізумаб (імунодепресор, який часто використовують при лікуванні ревматоідного артриту та тяжкої форми артриту у дітей) + Омепразол ( противиразковий препарат, інгібітор Н+/К+ АТФази, тим самим блокує водень при синтезі соляної кислоти в шлунку) = Підвищення експресії CYP2C19 , й тим самим зменшує концентрацію Омепразола на 28%
4. Сарілумаб специфічно зв'язується як з розчинними, так і з мембранними рецепторами ІЛ-6 (IL-6Rα) і пригнічує ІЛ-6-опосередковану передачу сигналу з залученням сигнального білка - глікопротеїну 130 (gp130) і сигнальних білків STAT-3. Є дані, що сарілумаб відрізняється більш вираженою афінністю, щодо зв'язування рецептора ІЛ-6, а також пов'язує рецептор більш стабільно, ніж тоцілізумаб = підвищення експресії CYP3A4 ↓ концентрація симвастатини на 45%.
5. Брентуксімаб ведотин (синтетичний препарат, який є кон'югатом лікарського засобу з химерними моноклональними антитілами до поверхневого антигену лімфоцитів CD30) + Рифампіцин (бактерицидний антибіотик рифампіцинової групи. Це напівсинтетична речовина, яку отримують з бактерії Amycolatopsis rifamycinica) = ↑ експресію CYP3A4 та ↓ концентрацію монометил ауристатину Е на 46%.
Кооперація цитохрому P450 з різними препаратами та речовинами
Ферменти сімейства цитохрому Р450 можуть індукувати і інгібуватися багатьма лікарськими засобами та речовинами, що пояснює механізм багатьох лікарських взаємодій, коли один з препаратів посилює токсичність або знижує терапевтичний ефект іншого.До індукторів (пришвидшують дію цитохрому, метаболізм ліків, шлях виведення також буде прискорюватись, а ефективність ліків зменшуватись) цитохрому Р-450 відносяться:
Приклади лікарських засобів та речовин, що індукують та інгібують цитохром P450
| Інгібітори | Індуктори |
| Ципрофлоксацин | Модафініл |
| Варфарин | Звіробій |
| Аміодарон | Фенітоїн |
| Пароксетин | Фенобарбітал |
| Грейпфрутовий сік | Невірапін |
| Ізоніазид | Рифампіцин |
| Дилтіазем | Гризеофульвін |
| Верапаміл | Карбомазепін |
| Гемфіброзил | Тютюновий дим |
| Хлорамфенікол | Дим від барбекю |
| Флуоксетин | Хронічне вживання алкоголю |
| Флувоксамін | |
| Кларитроміцин | |
| Еритроміцин | |
| Метронідозол | |
| Сульфонамідез | |
| Циметидин | |
| Ритонавір | |
| Омепразол | |
| Вітановір | |
| Сода |
Більшість робіт, описаних досі у ссавців, були з мікросомальними Р450 (зараз відомо 50 із 57 Р450 у людини, які поділяються на 18 родин і 44 підродин).[5] Однак уже було визнано, що в мітохондріях відбувається кілька важливих окислень стероїдів, у тому числі тих, які каталізуються ферментом розщеплення бічного ланцюга холестерину (нині відомим як P450 11A1), який починає весь процес стероїдогенезу. Найбільш поширеними представниками є цитохроми P452 АС, P450 2D, P450 2E1, P450 3A4. Ці ферменти каталізують широкий спектр метаболічних реакцій, а один цитохром, може метабооізувати кілька лікарських препаратів, які мають різну хімічну структуру.
Мітохондріальні цитохроми Р450 (СYР11А1, СYР11В1, СYР11В2) утворюють комплекси тільки з СYВ5В людини. Афінність цих комплексів висока. До недавна, було вперше продемонстровано утворення комплексів між СYВ5В і СYP11А1, СYР11В1 і СYР11В2, в той же час не було зафіксовано утворення комплексів з СYВ5А. Чим зумовлена така вибірковість мітохондріальних СYР залишається невідомим і питання про можливий вплив СYВ5В на активність мітохондріальних цитохромів залишається відкритим. Проте, слід враховувати локалізацію цитохромов Р450 і СYВ5В в мітохондріях - цитохроми Р450 локалізовані на внутрішній мембрані мітохондрії і контактують з матриксом, в той час як мітохондріальна ізоформа СYВ5 знаходиться на зовнішній мембрані мітохондрій. Таким чином, можна говорити про те, що в фізіологічних умовах ці білки швидше за все не зустрічаються.
Цитохром-Р450 у людей
| Родина | Функція | Представники | Назви |
| CYP1 | метаболізм ліків і стероїдів (особливо естрогенів), детоксикація бензопірену | 3 підродини, 3 гени, 1 псевдоген | CYP1A1, CYP1A2, CYP1B1 |
| CYP2 | метаболізм ліків і стероїдів | 13 підродин, 16 генів, 16 псевдогенів | CYP2A6, CYP2A7, CYP2A13, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1, CYP2F1, CYP2J2, CYP2R1, CYP2S1, CYP2U1, CYP2W1 |
| CYP3 | метаболізм ліків і стероїдів (включно з тестостероном) | 1 підродина, 4 гени, 2 псевдогени | CYP3A4, CYP3A5, CYP3A7, CYP3A43 |
| CYP4 | метаболізм арахідонової та інших жирних кислот | 6 підродин, 12 генів, 10 псевдогенів | CYP4A11, CYP4A22, CYP4B1, CYP4F2, CYP4F3, CYP4F8, CYP4F11, CYP4F12, CYP4F22, CYP4V2, CYP4X1, CYP4Z1 |
| CYP5 | тромбоксан A2 синтаза | 1 підродина, 1 ген | CYP5A1 |
| CYP7 | біосинтез жовчних кислот, 7-α гідроксилювання стероїдного ядра | 2 підродини, 2 гени | CYP7A1, CYP7B1 |
| CYP8 | різні | 2 підродини, 2 гени | CYP8A1 (протсациклін синтаза), CYP8B1 (біосинтез жовчних кислот) |
| CYP11 | біосинтез стероїдів | 2 підродина, 3 ген | CYP11A1, CYP11B1, CYP11B2 |
| CYP17 | біосинтез стероїдів, 17-α гідроксилаза | 1 підродина, 1 ген | CYP17A1 |
| CYP19 | біосинтез стероїдів : ароматаза естрогену | 1 підродина, 1 ген | CYP19A1 |
| CYP20 | функція невідома | 1 підродина, 1 ген | CYP20A1 |
| CYP21 | біосинтез стероїдів | 2 підродина, 1 ген, 1 псевдоген | CYP21A2 |
| CYP24 | розщеплення вітаміну D | 1 підродина, 1 ген | CYP24A1 |
| CYP26 | гідролаза ретиноєвої кислоти | 3 підродини, 3 гени | CYP26A1, CYP26B1, CYP26C1 |
| CYP27 | різні | 3 підродини, 3 гени | CYP27A1 (біосинтез жовчних кислот), CYP27B1 (вітамін D3 1-α гідроксилаза, активація вітаміну D3), CYP27C1 (функція невідома) |
| CYP39 | 7-α гідроксилювання 24-гідрохолестеролу | 1 підродина, 1 ген | CYP39A1 |
| CYP46 | холестерол 24-гідроксилаза | 1 підродина, 1 ген | CYP46A1 |
| CYP51 | біосинтез холестеролу | 1 підродина, 1 ген, 3 псевдоген | CYP51A1 (ланостерол 14-α деметилаза) |
Посилання
- Degtyarenko K (9 січня 2009). Directory of P450-containing Systems. International Centre for Genetic Engineering and Biotechnology. Архів оригіналу за 16 липня 2016. Процитовано 10 лютого 2009.
- Estabrook R (2003). A passion for P450s (remembrances of the early history of research on cytochrome P450). Drug Metab Dispos 31 (12): 1461–73. PMID 14625342. doi:10.1124/dmd.31.12.1461.
- Feyereisen R (19 грудня 2005). The Insect P450 Site. Institut National de la Recherche Agronomique. Архів оригіналу за 30 травня 2014. Процитовано 10 лютого 2009.
- Flockhart DA (2007). Cytochrome P450 drug interaction table. Indiana University-Purdue University Indianapolis. Процитовано 10 лютого 2009.
- Fowler L, Mercer A. Cytochrome P450 Animated Tutorial. School of Pharmacy, London. Архів оригіналу за 17 травня 2016. Процитовано 10 лютого 2009.
- Preissner S (2010). Cytochrome P450 database. Nucleic Acids Research.
- Sim SC (4 вересня 2008). Human Cytochrome P450 (CYP) Allele Nomenclature Committee. Karolinska Institutet. Процитовано 10 лютого 2009.
- Hazai E (12 лютого 2012). Cytochrome P450 enzyme-substrate selectivity prediction. Архів оригіналу за 15 лютого 2011.
- Performance of P450 inhibition Studies The performance of in vitro cytochrome P450 inhibition studies studies including analysis of the data.
- DDI Regulatory Guidance Request a guide to drug-drug interaction regulatory recommendations.
- Expanding the toolbox of cytochrome P450s through enzyme engineering Video by the Turner Group, University of Manchester, UK
- Omura, T.; Sato, R. (1964-07). THE CARBON MONOXIDE-BINDING PIGMENT OF LIVER MICROSOMES. I. EVIDENCE FOR ITS HEMOPROTEIN NATURE. The Journal of Biological Chemistry 239. с. 2370–2378. ISSN 0021-9258. PMID 14209971. Процитовано 16 листопада 2020.
- Цитохром Р450-опосредованные взаимодействия моноклональных антител и малых молекул. Клиническая фармакология и терапия - Медицинский журнал. clinpharm-journal.ru (рос.). Процитовано 16 листопада 2020.