Фторид кальцію
Флуорид кальцію — неорганічна бінарна сполука складу CaF2. Має іонну кристалічну ґратку. Являє собою тверду, прозору у чистому вигляді речовину. У природі зустрічається у вигляді мінералу флюориту. Використовується у промисловості як флюс в металургії, для виробництва плавикової кислоти, в оптиці. Нетоксичний.
| Флуорид кальцію | |
|---|---|
 | |
 | |
| Назва за IUPAC | Кальцію флуорид |
| Інші назви | кальцієва сіль плавикової кислоти, фтористий кальцій, плавиковий шпат |
| Ідентифікатори | |
| Номер CAS | 7789-75-5 |
| PubChem | 24617 |
| Номер EINECS | 232-188-7 |
| DrugBank | 15962 |
| Назва MeSH | D01.146.325 і D01.303.350.300.150 |
| ChEBI | 35437 |
| RTECS | EW1760000 |
| SMILES |
[F-].[F-].[Ca+2][1] |
| InChI |
InChI=1S/Ca.2FH/h;2*1H/q+2;;/p-2 |
| Номер Гмеліна | 18380 |
| Властивості | |
| Молекулярна формула | CaF2 |
| Молярна маса | 78,07 г/моль |
| Зовнішній вигляд | безбарвна/біла кристалічна тверда речовина |
| Запах | без запаху |
| Густина | 3,181 г/см3 |
| Тпл | 1423 °C[2] |
| Ткип | 2533 °C |
| Розчинність (вода) | 0,013 г/л (0 °C) 0,016 г/л (25 °C) 0,017 г/л (40 °C)[3] |
| Розчинність (неорганічні кислоти) | малорозчинний |
| Розчинність (ацетон) | нерозчинний |
| Кислотність (pKa) | 1 |
| Показник заломлення (nD) | 1,4338 (589 нм) |
| Структура | |
| Кристалічна структура | гранецентрована кубічна (див. текст), cF8 |
| Fm3m, No. 225 | |
| Координаційна геометрія |
Гексаедральна (Са2+) Тетраедральна (F–) |
| Небезпеки | |
| ЛД50 | 4250 мг/кг (перорально, щурі) |
| Індекс ЄС | не зазначений |
| NFPA 704 |
 0
0
0
|
| Температура спалаху | незаймистий |
| Пов'язані речовини | |
| Інші аніони | CaCl2, CaBr2, CaI2 |
| Інші катіони | BeF2, MgF2, SrF2, BaF2, RaF2 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Знаходження в природі
В природі флуорид кальцію зустрічається у вигляді мінералу флюориту. Забарвлення мінералу буває найрізноманітнішим: найхарактерніша фіолетова і зелена, рідше — блакитна, жовта, рожева, часто перемежаються зелені і фіолетові смуги. Оптичний флюорит безбарвний. Блиск скляний. Просвічує або прозорий, темні різновиди просвічують, рідше непрозорі. Твердість 4, густина 3,2. Крихкий. Спайність досконала по октаедру. Сингонія кубічна. Форма кристалів — куби або октаедри. Характерні двійники проростання. Зазвичай мінерал утворює щільні або зернисті маси, або шестоваті і радіально-променисті агрегати.
Флюорит зустрічається, головним чином, як жильний мінерал в асоціації з кальцитом, баритом, кварцом, а також з сульфідами свинцю, цинку і інших металів, рідше — в пегматитах.
Промислова здобич флюориту ведеться з практично мономінеральних жил. Провідні світові постачальники флюориту — Мексика, Монголія, ПАР, Іспанія, Китай. Родовища флюориту є також у Франції, Німеччині, Великій Британії. Більше половини всього флюориту витрачається в хімічній промисловості для виробництва плавикової кислоти, з якої отримують органічні і неорганічні речовини, що фторують, а також штучний кріоліт для потреб алюмінієвої промисловості. Другий найбільший споживач флюориту — чорна металургія, де він використовується як флюс в плавильних печах.
У 19 столітті у Великій Британії як камінь декоративно-виробу широко застосовувався синювато-фіолетовий і зелений флюорит (Синій Джон, Зелений Джон). Оптичний флюорит в роки Другої світової війни був стратегічною сировиною, необхідною для виготовлення приладів нічного бачення.
Фізичні та фізико-хімічні властивості
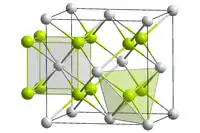
Безбарвні, крихкі діамагнітні кристали (в порошку — білі). Твердість за шкалою Мооса - 4. До температури 1150 °C стабільний α-CaF2 з кубічною градкою (а = 0,54626 нм, z=4, Fm3m), при температурі близько 1150 °C відбувається поліморфний перехід до невпорядкованої β-модифікації тетрагональної сингонії з температурою плавлення 1423 °C. Тиск пари при 1625 °C = 1,0 мм. рт.ст., при 1850 °C = 10 мм. рт. ст.[3]
| Термодинамічні характеристики | |
|---|---|
| Стандартна ентальпія утворення ΔH(solid) (298 К, кДж/моль) | -1214,6 |
| Стандартна енергія Гіббса утворення ΔG(solid) (298 К, кДж/моль) | -1161,9 |
| Стандартна ентропія утворення S(solid) (298 К, Дж/(моль·K)) | 68,87 |
| Стандартна мольна теплоємність Cp(solid) (298 К, Дж/(моль·K)) | 67,03 |
| Стандартна ентальпія утворення ΔH(gas) (298 К, кДж/моль) | -784 |
| Стандартна ентропія утворення S(gas) (298 К, Дж/(моль·K)) | 274 |
| Стандартна мольна теплоємність Cp(gas) (298 К, Дж/(моль·K)) | 51 |
| Ентальпія плавлення ΔHпл. (кДж/моль) | 29,7 |
| Ентальпія кипіння ΔHкип. (кДж/моль) | 305 |
| Ентальпія поліморфного переходу ΔHперех. (кДж/моль) | 4,77 |
| Інші характеристики[4] | |
|---|---|
| Коефіцієнт теплопровідності (Вт/(м·K)) | 9,71 |
| Коефіцієнт термічного розширення (К-1) | 18,5×10-6 |
| Питома теплоємність (Дж/(кг·К)) | 854 |
| Діелектрична стала (f = 1 Мгц) | 6,76 |
| Модуль Юнга Е (ГПа) | 75,8 |
| Модуль зсуву G (ГПа) | 33,77 |
| Модуль об'ємної деформації К (ГПа) | 82,71 |
| Межа пружності (МПа) | 36,54 |
| Коефіцієнт Пуасона ν | 0,26 |
Погано розчиняється у воді (16 мг/л при 18 °C).
Хімічні властивості
При нагріванні флуорид кальцію реагує з водою та кислотами:
Його використовують як агента для флуорування — для отримання флуоридів як металів, так і неметалів:
Сполука може утворювати змішані флуориди:
Отримання
У промислових масштабах флуорид кальцію добувають з мінералів (головним чином, з флюориту). В лабораторних умовах його можна синтезувати декількома способами:
- дією флуоридної кислоти та її солей на сполуки кальцію:
- розкладанням гексафлуоросилікату кальцію:
- безпосередньою взаємодією простих сполук:
Застосування
Флуорид кальцію застосовують у виробництві флуориду натрію, плавикової кислоти, флуоридів фосфору, флюсів для металургії і для виготовлення опалесцентного скла, яке поглинає нейтрони. Також CaF2 застосовуєтьcя у стоматологічній практиці.
Примітки
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1972. — Т. 2. — 871 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Химическая энциклопедия / Гл. ред. Н. С. Зефиров. — М. : Советская энциклопедия, 1998. — Т. 6. — С. 111. (рос.)