Центральна толерантність
В імунній системі людини центральна толерантність (також відома як негативний відбір) — процес елімінації будь-яких Т- або В-лімфоцитів, що розвиваються, які реагують на власні білки організму.[1] Завдяки елімінації аутореактивних лімфоцитів толерантність гарантує, що імунна система не атакує власні структури.[2] Дозрівання лімфоцитів (і формування центральної толерантності) відбувається в первинних лімфоїдних органах, таких як кістковий мозок і тимус. У ссавців В-клітини дозрівають у кістковому мозку, а Т-клітини дозрівають у тимусі.[1]
Центральна толерантність не є ідеальною, тому існує периферійна толерантність, як вторинний механізм, який гарантує, що Т- і В-клітини не будуть аутореактивними, коли вони залишають первинні лімфоїдні органи.[3] Периферійна толерантність відрізняється від центральної тим, що вона виникає, коли імунні клітини, що розвиваються, виходять з первинних лімфоїдних органів (вилочкової залози та кісткового мозку) перед їх експортом на периферію.[1]
Функція центральної толерантності
Центральна толерантність має важливе значення для належного функціонування імунних клітин, оскільки вона допомагає гарантувати, що зрілі В-клітини та Т-клітини не розпізнають власних антигенів як чужорідних мікробів.[2] Точніше, центральна толерантність необхідна, оскільки Т-клітинні рецептори (TCR) і В-клітинні рецептори (BCR) утворюються клітинами шляхом випадкової соматичної перебудови.<sup id="mwIQ">[1]</sup> Цей процес, відомий як V(D)J рекомбінація, збільшує різноманітність рецепторів, що підвищує ймовірність того, що В-клітини та Т-клітини матимуть рецептори до нових антигенів.[1] Розмаїття ділянок для зв'язування, що з'являється під час рекомбінації, служить для подальшого збільшення різноманітності BCR і TCR.[1] Випадкова поява нових TCR і BCR є важливим методом захисту від мікробів, які активно мутують. Цей процес відіграє важливу роль у виживанні виду, оскільки всередині нього існуватиме розмаїття рецепторів — це дає дуже високий шанс, що принаймні один представник виду має рецептори до нового антигену.[1]
Хоча процес соматичної рекомбінації є важливим для успішного імунного захисту, він може призвести до аутореактивності. Наприклад, відсутність функціональних RAG1/2, ферментів, необхідних для соматичної рекомбінації, пов'язують з розвитком імунної цитопенії, при якій виробляються антитіла проти клітин крові пацієнта.[4] Через випадкову природу рекомбінації рецепторів виробляються деякі BCR і TCR, які розпізнають власні антигени як чужорідні.[2] І це вже є проблемою, оскільки ці В- і Т-клітини, якщо вони активовані, створять імунну відповідь проти власного організму, якщо вони не вбиті або інактивовані механізмами центральної толерантності.<sup id="mwMQ">[2]</sup> Тому без центральної толерантності імунна система може атакувати власний організм, що не є прийнятним і може призвести до аутоімунного розладу.<sup id="mwMw">[2]</sup>[3]
Механізми центральної толерантності
Кінцевим результатом толерантності є популяція лімфоцитів, які не реагують на власні антигени, але можуть розпізнавати чужорідні, невласні антигени, залежно від випадково зібраного рецептора.[2] Важливо, що лімфоцити можуть розвивати толерантність лише до антигенів, які присутні в кістковому мозку (для В-клітин) і тимусі (для Т-клітин).
В-клітинна толерантність
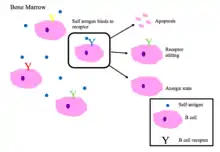
Незрілі В-клітини в кістковому мозку піддаються негативному відбору, коли вони зв'язуються з власними пептидами.[2]
Правильно функціонуючі В-клітинні рецептори розпізнають невласний антиген або молекули, асоційовані з патогеном (PAMP).[1]
Основні наслідки аутореактивності BCR[1][2]
- Апоптоз (клональна делеція)
- Редагування рецепторів: аутореактивна В-клітина змінює специфічність шляхом перебудови генів і формує новий BCR, який не реагує на власні білки. Цей процес дає B-клітині можливість змінити BCR до того, як вона отримає сигнал про апоптоз або стане анергічною.
- Індукція анергії (стан відсутності реактивності)
Т-клітинна толерантність
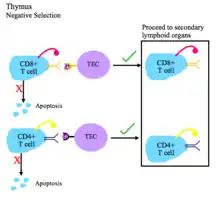
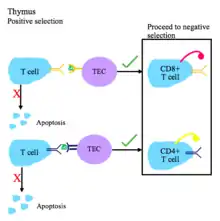
Центральна Т-клітинна толерантність виникає в тимусі.[1] Т-клітини піддаються позитивному і негативному відбору.[2]
Т-клітинні рецептори повинні мати здатність розпізнавати молекули головного комплексу гістосумісності (МНС) зв'язані з чужим пептидом.[1]
Етапи Т-клітинної толерантності[2][5]
- Під час позитивної селекції Т-клітини перевіряються на їх здатність споріднено зв'язувати комплекси пептид-MHC. Якщо Т-клітина не може зв'язати комплекс MHC класу I або MHC класу II, вона не отримує сигнали на виживання, тому гине через апоптоз. Для виживання відбираються Т-клітинни рецептори яких мають достатню спорідненість до комплексів пептид-МНС.
- Під час негативного відбору Т-клітини перевіряються на їх спорідненість до власних пептидів організму. Якщо вони зв'язують власний пептид, то їм надходить сигнал запуску апоптозу (процес клональної делеції).
- Епітеліальні клітини тимуса демонструють власний антиген Т-клітинам, щоб перевірити їх спорідненість до власного організму.
- Регулятори транскрипції AIRE і Fezf2 відіграють важливу роль у експресії власних тканинних антигенів на епітеліальних клітинах тимуса.
- Негативний відбір відбувається в корково-медулярному з'єднанні та в мозковій речовині вилочкової залози.
- Т-клітини, які не зв'язуються з власними білками, але розпізнають комплекси пептид-MHC і є CD4+ або CD8+, мігрують до вторинних лімфоїдних органів як зрілі наївні Т-клітини.
Регуляторні Т-клітини є іншим типом Т-клітин, які дозрівають у тимусі. Їх відбір відбувається в мозковій речовині тимуса і супроводжується транскрипцією FOXP3. Вони важливі для регуляції аутоімунітету шляхом пригнічення імунної системи, коли вона не повинна бути активною.[6]
Генетичні захворювання, спричинені дефектами центральної толерантності
Генетичні дефекти центральної толерантності можуть призвести до аутоімунітету.
Історія дослідження центральної толерантності
Перше спостереження явищя центральної толерантності було здійснене Реєм Оуеном у 1945 році, коли він помітив, що дизиготні близнюки телят не виробляють антитіл, коли одному з них вводили кров іншого.[9] Його висновки були підтверджені пізнішими експериментами Гашека і Біллінгема.[9] Результати були пояснені гіпотезою клонального відбору Бернета.[10] У 1960 році Бернет і Медавар отримали Нобелівську премію за роботу з пояснення того, як працює імунна толерантність.[10][11]
Посилання
- Owen, Judith A; Punt, Jenni; Stranford, Sharon A; Jones, Patricia P; Kuby, Janis (2013). Kuby immunology (вид. 7th). New York: W.H. Freeman. ISBN 978-1-4292-1919-8. OCLC 820117219.
- Immunological tolerance and autoimmunity. Internal and Emergency Medicine 1 (3): 187–96. 2006. PMID 17120464. doi:10.1007/bf02934736. Проігноровано невідомий параметр
|vauthors=(довідка) - Janeway, Charles (2011). Immunobiology 5: The Immune System in Health and Disease (вид. 5th). New York: Garland. ISBN 978-0-8153-3642-6. OCLC 45708106.
- Autoimmunity due to RAG deficiency and estimated disease incidence in RAG1/2 mutations. The Journal of Allergy and Clinical Immunology 133 (3): 880–2.e10. March 2014. PMC 4107635. PMID 24472623. doi:10.1016/j.jaci.2013.11.038. Проігноровано невідомий параметр
|vauthors=(довідка) - The thymus and central tolerance. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 356 (1409): 609–16. May 2001. PMC 1088448. PMID 11375064. doi:10.1098/rstb.2001.0846. Проігноровано невідомий параметр
|vauthors=(довідка) - Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature 441 (7090): 235–8. May 2006. PMID 16648838. doi:10.1038/nature04753. Проігноровано невідомий параметр
|vauthors=(довідка) - Projection of an immunological self shadow within the thymus by the aire protein. Science 298 (5597): 1395–401. November 2002. PMID 12376594. doi:10.1126/science.1075958. Проігноровано невідомий параметр
|vauthors=(довідка) - Aire regulates negative selection of organ-specific T cells. Nature Immunology 4 (4): 350–4. April 2003. PMID 12612579. doi:10.1038/ni906. Проігноровано невідомий параметр
|vauthors=(довідка) - Historical overview of immunological tolerance. Cold Spring Harbor Perspectives in Biology 4 (4): a006908. April 2012. PMC 3312674. PMID 22395097. doi:10.1101/cshperspect.a006908. Проігноровано невідомий параметр
|vauthors=(довідка) - Immunological tolerance 50 years after the Burnet Nobel Prize. Immunology and Cell Biology 89 (1): 14–5. January 2011. PMID 21209621. doi:10.1038/icb.2010.138. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - The curious case of the 1960 Nobel Prize to Burnet and Medawar. Immunology 147 (3): 269–74. March 2016. PMC 4754613. PMID 26790994. doi:10.1111/imm.12558. Проігноровано невідомий параметр
|vauthors=(довідка)