Цитотоксичні T-клітини
Цитотоксичні Т-клітини (також відомі як TC, цитотоксичні Т-лімфоцити, CTL, Т-кілери, цитолітичні Т-клітини, CD8+ Т-клітини) є Т-лімфоцитами (тип білих кров'яних тілець), які вбивають ракові клітини, інфіковані (особливо вірусами) клітини, або клітини, пошкоджені іншими способами.[1]
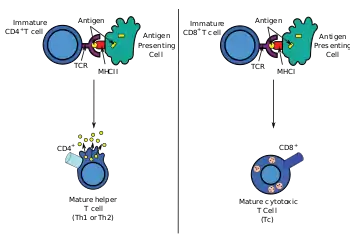
Більшість TC експресують Т-клітинні рецептори (TCR), які можуть розпізнавати специфічний антиген. Антиген — це молекула, здатна стимулювати імунну відповідь, яка часто виробляється раковими клітинами або вірусами. Антигени всередині клітини зв'язуються з молекулами ГКГС класу I і виносяться ними на поверхню клітини, де їх може розпізнати Т-клітина. Якщо TCR є специфічним до цього антигену, він зв'язується з комплексом молекули ГКГС класу I та антигеном, а TC руйнує клітину, що несе цей антиген.
Для того, щоб TCR зв'язувався з молекулою ГКГС класу I, він повинен супроводжуватися глікопротеїном під назвою CD8, який зв'язується з постійною частиною молекули ГКГС класу I. Тому ці Т-клітини називають CD8+ Т-клітинами .
Спорідненість між CD8 і молекулою ГКГС утримує клітини ТС і клітини-мішені, близько один до одного під час антиген-специфічної активації. CD8+ T-клітини вважаються цитотоксичними після відповідної активації. CD8+ Т-клітини також мають здатність виробляти деякі цитокіни.
Розвиток
Імунна система повинна розпізнавати мільйони потенційних антигенів. В організмі людини менше 30 000 генів, тому неможливо мати один ген для кожного антигена. Натомість ДНК в мільйонах білих кров'яних тільцях у кістковому мозку перекомбінується, що створює клітини з унікальними рецепторами, кожен з яких може зв'язуватися з різним антигеном. Деякі рецептори зв'язуються з тканинами самого організму людини. Тому, щоб запобігти самоушкодженню організму, ці аутореактивні білі кров'яні клітини руйнуються під час подальшого розвитку в тимусі (важливим елементом для цього є йод).[2]
TCR має дві частини, як правило, альфа- та бета-ланцюги (деякі TCR мають гамма- і дельта-ланцюги). Стовбурові гемопоетичні клітини в кістковому мозку мігрують в тимус, де відбувається V(D)J рекомбінація їхньої ДНК, яка кодує бета-ланцюг TCR з утворенням проміжної форми білка TCR, відомого як pre-TCR. Якщо ця перебудова успішна, клітини перебудовує свою ДНК TCR альфа-ланцюга, щоб створити функціональний комплекс альфа-бета TCR. Цей високомінливий продукт генетичної перебудови (рекомбінації) в генах TCR допомагає створити мільйони різних Т-клітин з різними TCR, допомагаючи імунній системі організму реагувати практично на будь-який білок інфекційного агента. Переважна більшість Т-клітин експресують альфа-бета-TCR (αβ-Т-клітини), але деякі Т-клітини в епітеліальних тканинах (наприклад, кишечника) експресують гамма-дельта-TCR (гамма-дельта-Т-клітини), які розпізнають небілкові антигени.
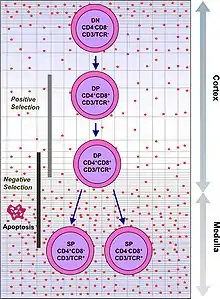
Т-клітини з функціонально стабільними TCR експресують як корецептори CD4, так і CD8, і тому їх називають «подвійно позитивними» (DP)Т-клітинами (CD4+CD8+). Подвійно позитивні Т-клітини піддаються впливу широкого спектру власних антигенів у тимусі та проходять дві форми відбору:
- позитивний відбір, при якому залишаються двічі позитивні Т-клітини, які зв'язуються з чужорідним антигеном у присутності власного ГКГС. Вони диференціюються на CD4+ або CD8+ залежно від того, який ГКГС асоціюється з представленим антигеном (ГКГС1 для CD8, ГКГС2 для CD4). Для диференціації у CD8+ Т-клітину антиген презентується в присутності ГКГС1. Позитивний відбір означає відбір тих TCR, які здатні розпізнавати власні молекули ГКГС.
- негативний відбір, при якому ті подвійно-позитивні Т-клітини, які занадто сильно зв'язуються з власними антигенами, які презентуються ГКГС, піддаються апоптозу, оскільки в іншому випадку вони можуть стати аутореактивними, що призведе до аутоімунітету.
Позитивно відбираються лише ті Т-клітини, які слабко зв'язуються з комплексами ГКГС-самоантиген. Ті клітини, які виживають при позитивному та негативному відборі, диференціюються в однопозитивні Т-клітини (або CD4+, або CD8+), залежно від того, чи розпізнає їх TCR антиген, представлений ГКГС класу I (CD8) або антиген ГКГС класу II (CD4). CD8+ Т-клітини дозрівають і перетворюються на цитотоксичні Т-клітини після їх активації антигеном, пов'язаним з ГКГС класу I.
Активація
За винятком деяких типів клітин (без'ядерні, включаючи еритроцити), ГКГС класу I експресується всіма власними клітинами організму. Коли ці клітини інфіковані вірусом (або іншим внутрішньоклітинним патогеном), відбувається розщеплення чужорідних білків шляхом процесінгу антигену. В результаті утворюються пептидні фрагменти, деякі з яких презентуються рецептору CD8+ Т-клітин за допомогою ГКГС класу I.
Активація TC залежить від кількох одночасних взаємодій між молекулами, які експресуються на поверхні Т-клітини, і молекулами на поверхні антигенпрезентувальної клітини (АПК). Існує двосигнальна модель активації Тс-клітин:
| Сигнал | Т-клітина | АПК | Опис |
| Перший сигнал | TCR | зв'язана з пептидами молекула ГКГС класу I | Для стабілізації цього сигналу існує друга взаємодія між корецептором CD8 і молекулою ГКГС класу I. |
| Другий сигнал | Молекула CD28 на Т-клітині | CD80 або CD86 (також називаються B7-1 і B7-2) | CD80 і CD86 відомі як костимулятори для активації Т-клітин. Цей другий сигнал може бути посилений (або замінений), стимулюванням Тс-клітини цитокінами, вивільненими Т-хелперами. |
Проста активація наївних (неактивованих) CD8+Т-клітин вимагає взаємодії зі спеціалізованими АПК, в основному з дозрілими дендритними клітинами. Для створення довгоживучих Т-клітин пам'яті та для повторної стимуляції TC, дендритні клітини повинні взаємодіяти як з активованими CD4+ Т-клітинами-хелперами, так і з CD8+ Т-клітинами.[3][4] Під час цього процесу Т-хелпери «надають ліцензію» дендритним клітинам, на потужний активуючий сигнал наївним CD8+ Т-клітинам.[5]
Крім того, дозрівання CD8+ Т-клітин опосередковується через передачу сигналу CD40.[6] Після того, як наївна CD8+ Т-клітина зв'язується з інфікованою клітиною, інфікована клітина запускає вивільнення CD40.[6] Це вивільнення CD40 за допомогою Т-хелперів ініціює диференціацію наївних CD8+ Т-клітин у зрілі CD8+ Т-клітини.[6]
Хоча в більшості випадків активація TC залежить від розпізнавання антигену через TCR, були описані й альтернативні шляхи активації. Наприклад, було показано, що TC активуються під час дії інших CD8+ Т-клітин, що призводить до толерантності останніх.[7]
Після активації ТС клонуються за допомогою цитокіну інтерлейкіну 2 (IL-2), який є фактором росту і диференціювання для Т-клітин. Це збільшує кількість клітин, специфічних до антигену-мішені, які потім можуть подорожувати по всьому тілу в пошуках соматичних клітин на яких є ці антигени.
Ефекторні функції
При дії на заражені/дисфункційні соматичні клітини, TC виділяють цитотоксини перфорин, гранзими і гранулізин. Завдяки дії перфорину гранзими потрапляють в цитоплазму клітини-мішені, де дія серинової протеази запускає каспазний каскад, який є серією цистеїнових протеаз, які, кінець-кінцем, призводять до апоптозу (запрограмованої смерті клітини). Через високу щільність ліпідів і негативно заряджений фосфатидилсерин, присутній в їх плазматичній мембрані, TC стійки до впливу власного перфорину і гранзимів.[8]
Другий спосіб викликати апоптоз — взаємодія між TC й інфікованою клітиною через клітинні поверхні. Коли TC активована, вона починає експресувати поверхневий білок FAS ліганд (FasL)(Apo1L)(CD95L), який може зв'язуватися з молекулою Fas (APO1) (CD95), що експресується на клітині-мішені. Однак, така взаємодія Fas-FasL, вважається більш важливою для видалення небажаних Т-лімфоцитів у процесі їх «тренування» або для літичної активності деяких клітин T-хелперів, ніж для цитолітичної активності ефекторних цитотоксичних T-клітин. Взаємодія Fas-FasL дозволяє залучити індукований некрозом сигнальний комплекс (DISC).[9] Fas-асоційований домен некрозу (FADD) транслокується з DISC, що дозволяє активувати прокаспази 8 і 10.[9] Ці каспази потім активують ефекторні каспази 3, 6 і 7, що призводить до розщеплення субстратів некрозу, таких як ламін A, ламін B1, ламін B2, PARP (полі-АДФ рибозополімераза) і DNA-PKcs (ДНК-активована протеїнкіназа). Кінцевим результатом є апоптоз клітини, яка експресує Fas.
Вважається, що транскрипційний фактор еомезодермін відіграє ключову роль у функції TC, діючи як регуляторний ген в адаптивній імунній відповіді.[10] Дослідження, що вивчали вплив втрати функції еомезодерміну, виявили, що зниження експресії цього транскрипційного фактора призвело до зменшення кількості перфорину, що виробляється TC.[10]
Роль у патогенезі хвороб
На відміну від антитіл, які ефективні як проти вірусних, так і проти бактеріальних інфекцій, TC в основному ефективні проти вірусів.[11]
Під час інфікування вірусом гепатиту B (HBV) TC вбивають інфіковані клітини та виробляють противірусні цитокіни, здатні очищати життєздатні гепатоцити від HBV. Вони також відіграють важливу патогенну роль, сприяючи майже всім ушкодженням печінки, пов'язаним з інфекцією HBV.[12] Було показано, що тромбоцити сприяють накопиченню вірус-специфічних TC в інфікованій печінці.[13]
TC причетні до прогресування артриту: деградація макромолекул хряща колінного суглоба, таких як глікозаміноглікани, TC та макрофагами спостерігалася на моделі захворювання у щурів.[14]
Встановлено, що CD8+ Т-клітини відіграють роль у ВІЛ-інфекції. З часом ВІЛ розробив багато стратегій, щоб уникнути імунної системи клітини-хазяїна. Наприклад, ВІЛ дуже сильно мутує, що дозволяє йому уникнути розпізнавання CD8+ Т-клітинами.[15] Він також здатен знижувати експресію поверхневих білків ГКГС класу I клітин, які він інфікує, для подальшого уникнення руйнування CD8+ Т-клітинами.[15] Якщо CD8+ Т-клітини не можуть знайти, розпізнати та зв'язатися з інфікованими клітинами, вірус не буде знищений і продовжить розмноження.
Крім того, TC можуть бути залучені до розвитку діабету 1 типу.[16] На додаток до ролі CD4+ клітин у цьому аутоімунному захворюванні, дослідження на мишачій моделі діабету показали, що TC також можуть відігравати певну роль, руйнуючи клітини острівців підшлункової залози, що виробляють інсулін.[16]
TC можуть бути необхідні для усунення периферичної нейропатії, спричиненої хіміотерапією (CIPN).[17][18] У мишей без TC спостерігається подовжений CIPN порівняно зі звичайними мишами, а ін'єкція «тренованих» TC усуває або запобігає CIPN.
Аномальна гіперактивація ТС може бути пов'язана з розвитком тяжкої ковідної пневмонії[19].
Примітки
- Lymphocytes. Advanced Hematology in Integrated Cardiovascular Chinese Medicine. Elsevier. 2020. с. 41–46. ISBN 978-0-12-817572-9. doi:10.1016/b978-0-12-817572-9.00007-0. «Helper T cells/CD4+ •express CD4 glycoproteins on their cell surface, which activate in the presence of peptide antigens on the surface of invading pathogens; •respond immediately to protect the immune system; •secrete different cytokine proteins according to the immune response.»
- Iodine, thymus, and immunity. Nutrition 25 (9): 977–9. September 2009. PMID 19647627. doi:10.1016/j.nut.2009.06.002. Проігноровано невідомий параметр
|vauthors=(довідка) - Crosstalk between T lymphocytes and dendritic cells. Critical Reviews in Immunology 32 (2): 139–55. 2012. PMID 23216612. doi:10.1615/CritRevImmunol.v32.i2.30. Проігноровано невідомий параметр
|vauthors=(довідка) - Concurrent interaction of DCs with CD4(+) and CD8(+) T cells improves secondary CTL expansion: It takes three to tango. European Journal of Immunology 44 (12): 3543–59. December 2014. PMID 25211552. doi:10.1002/eji.201444477. Проігноровано невідомий параметр
|vauthors=(довідка) - Lanzavecchia A (1998). Immunology. Licence to kill. Nature 393 (6684): 413–414. PMID 9623994. doi:10.1038/30845. Проігноровано невідомий параметр
|doi-access=(довідка) - Help for cytotoxic-T-cell responses is mediated by CD40 signalling. Nature (En) 393 (6684): 478–80. June 1998. Bibcode:1998Natur.393..478B. PMID 9624004. doi:10.1038/30996. Проігноровано невідомий параметр
|vauthors=(довідка) - CTLs respond with activation and granule secretion when serving as targets for T-cell recognition. Blood 117 (3): 1042–52. January 2011. PMC 3035066. PMID 21045195. doi:10.1182/blood-2010-05-283770. Проігноровано невідомий параметр
|vauthors=(довідка) - Lipid order and charge protect killer T cells from accidental death. Nature Communications 10 (1): 5396. November 2019. PMC 6881447. PMID 31776337. doi:10.1038/s41467-019-13385-x. Проігноровано невідомий параметр
|vauthors=(довідка) - Bakshi, Rakesh K.; Cox, Maureen A.; Zajac, Allan J. (2014). Cytotoxic T Lymphocytes. Encyclopedia of Medical Immunology. с. 332–342. ISBN 978-0-387-84827-3. doi:10.1007/978-0-387-84828-0_36.
- Control of effector CD8+ T cell function by the transcription factor Eomesodermin. Science 302 (5647): 1041–3. November 2003. PMID 14605368. doi:10.1126/science.1090148. Проігноровано невідомий параметр
|vauthors=(довідка) - Type B coxsackieviruses and their interactions with the innate and adaptive immune systems. Future Microbiology 5 (9): 1329–1347. 2010. PMC 3045535. PMID 20860480. doi:10.2217/fmb.10.101. Проігноровано невідомий параметр
|vauthors=(довідка) - Pathogenetic and antiviral immune responses against hepatitis B virus. Future Virology 1 (2): 189–96. 2006. doi:10.2217/17460794.1.2.189. Проігноровано невідомий параметр
|vauthors=(довідка) - Platelets mediate cytotoxic T lymphocyte-induced liver damage. Nature Medicine 11 (11): 1167–9. November 2005. PMC 2908083. PMID 16258538. doi:10.1038/nm1317. Проігноровано невідомий параметр
|vauthors=(довідка) - Electron microscopic evidence on the participation Cytotoxic T Lymphocytes and Macrophages in Mtb adjuvant induced connective tissue inflammation and arthritogenesis in Rattus norvegicus. Asian Journal of Microbiology, Biotechnology and Environmental Sciences 7 (2): 227–233. 2005. ISSN 0972-3005. Проігноровано невідомий параметр
|vauthors=(довідка) - CD8+ T-cells: function and response to HIV infection. Current HIV Research 2 (1): 23–37. January 2004. PMID 15053338. doi:10.2174/1570162043485077. Проігноровано невідомий параметр
|vauthors=(довідка) - CD8+ T cells in type 1 diabetes. Advances in Immunology 100: 79–124. 2008. PMID 19111164. doi:10.1016/S0065-2776(08)00804-3. Проігноровано невідомий параметр
|vauthors=(довідка) - Cisplatin educates CD8+ T cells to prevent and resolve chemotherapy-induced peripheral neuropathy in mice. Pain 160 (6): 1459–1468. June 2019. PMC 6527475. PMID 30720585. doi:10.1097/j.pain.0000000000001512. Проігноровано невідомий параметр
|vauthors=(довідка) - CD8+ T Cells and Endogenous IL-10 Are Required for Resolution of Chemotherapy-Induced Neuropathic Pain. The Journal of Neuroscience 36 (43): 11074–11083. October 2016. PMC 5098842. PMID 27798187. doi:10.1523/JNEUROSCI.3708-15.2016. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - Kang, Chang Kyung; Han, Gi-Chan; Kim, Minji; Kim, Gwanghun; Shin, Hyun Mu; Song, Kyoung-Ho; Choe, Pyoeng Gyun; Park, Wan Beom та ін. (2020-08). Aberrant hyperactivation of cytotoxic T-cell as a potential determinant of COVID-19 severity. International Journal of Infectious Diseases (англ.) 97. с. 313–321. PMC PMC7261468. PMID 32492530. doi:10.1016/j.ijid.2020.05.106. Процитовано 30 листопада 2021.
