Цитоскелет прокаріот
Цитоскелет прокаріот — це система ниткоподібних структур, що переважно є впорядкованими полімерами білків одного класу, наявна у клітинах бактерій та архей. Всі досліджені (на 2006 рік) білки цитоскелету бактерій здатні до самоогрганізації у довгі філаменти in vitro.[1]
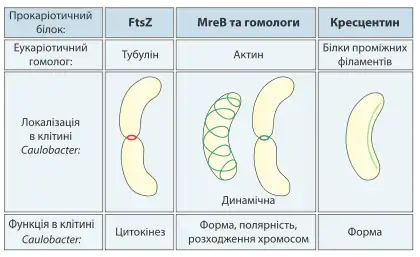
Цитоскелет прокаріот був вперше відкритий на початку 1990 років, коли було встановлено, що майже всі бактерії та більшість архей містять білок FtsZ, який є гомологом тубуліну, і може полімеризуватись у філаменти, що утворюють кільце (Z-кільце) під час клітинного поділу.[2] Пізніше були виявлені і прокаріотичні гомологи актину. Ці відкриття змінили уявлення про те, що саме відсутність цитоскелету є найважливішою причиною менших розмірів і простішої організації прокаріот у порівнянні з еукаріотами. Натомість зараз допускається, що відносна простота бактерій та архей пов'язана з відсутністю білків-моторів (принаймні досі вони виявлені не були), що «ходять» вздовж філаментів цитоскелету і забезпечують транспорт різних структур, а також і локомоцію всієї клітини.[3]
Наявність у прокаріот гомологів актину та тубуліну дозволяє припускати, що ці два класи нуклеотид-зв'язуючих білків, які можуть утворювати догві філаменти, виникли в процесі еволюції досить давно, ще до появи еукаріот. Проте, ядерні та безядерні організми по-різному їх використовують, наприклад у цитокінезі бактерій задіяний гомолог тубуліну FtsZ, тоді як в еукаріот цю функцію здійснюють актинові філаменти, у розходженні молекул ДНК під час поділу в бактерій навпаки беруть участь гомологи актину, а в еукаріот — мікротрубочки із тубуліну, що утворюють веретено поділу. Також у прокаріот був виявлений принаймні один клас білків, що можуть вважатись гомологами білків проміжних філаментів та один клас білків цитоскелету — АТФази типу Walker A (WACA — MinD та PraA) що не мають відповідників в еукаріот.[1]
Гомологи актину
У 2001 році Джонс (англ. Jones) та співробітники виявили, що у бактерії Bacillus subtilis наявні білки гомологи актину, які формують довгі спіральні структури. Це відкриття дало початок інтенсивному розвитку досліджень в галузі цитоскелету прокаріот, внаслідок чого було виявлено багато інших гомологів актину. Для всіх цих білків характерна наявність актинового АТФазного домену. Більшість з них, як і актин в еукаріот, є частиною цитоскелету, проте деякі мають інші функції, наприклад FtsA, що бере участь у клітинному поділі, шаперон DnaK та гексокінази.[1] Гомологи актину бактерій мають схожу просторову будову, але переважно досить сильно відрізняються за амінокислотною послідовністю (5-10 % ідентичності). Також ці білки мають відмінні характеристики динаміки полімеризації та властивостей філаментів, які вони утворюють. Очевидно, що на відміну, від еукаріот, які використовують один і той самий актин для дуже різних потреб клітини, бактерії мають багато варіантів схожих білків, кожен із яких спеціалізований на виконанні окремої функції.[3]
MreB та його гомологи
MreB (англ. murein cluster B) та його гомологи — білки поширені серед бактерій, що мають паличкоподібну або спіральну форми, і відсутні у коків. Деякі бактерії, наприклад Escherichia coli та Caulobacter crescentus, містять тільки ген білка MreB, тоді як інші, зокрема Bacillus subtilis, крім нього мають також гени його гомологів Mbl (англ. MreB-like) та MreBH (англ. MreB homolog).[4] Ці білки забезпечують підтримання паличкоподібної форми клітини, її полярності, а також розходження копій бактерійної ДНК під час поділу.
Структура та динаміка філаментів MreB та його гомологів
In vivo білок MreB та його гомологи утворюють довгі спіральні філаменти розташовані вздовж бактерійної клітини, вони можуть об'єднуватись у міцні і досить гнучкі пучки. Такі філаменти є динамічними структурами, тривалість їх півжиття зазвичай не перевищує кількох хвилин. Окрім того у деяких видів, зокрема C.crescentus та Rhodobacter sphaeroides філаменти MreB змінюють своє розташування впродовж клітинного циклу: під час поділу вони концентруються у центральній частині клітини і утворюють кільце. Проте, оскільки мутанти із делецією гену mreB не втрачають здатність до цитокінезу, очевидно білок MreB не є необхідним для цього процесу.[1]
Як було показано в експериментах на білках бактерії Thermotoga maritima мономерні одиниці MreB здатні до самоорганізації in vitro у довгі лінійні філаменти, які складаються з двох протофіламентів розташованих паралельно. Отже за будовою філаменти MreB відрізняються F-актину, утвореного двома ланцюгами спірально закрученими один навколо одного. Для полімеризації MreB необхідна наявність у середовищі АТФ, проте вона відбувається однаково успішно і в присутності ГТФ (на відміну від актину, який полімеризується лише за наявності АТФ). Це пов'язано з тим, що нові субодиниці включаються до складу полімеру тільки у формі зв'язаній з нуклеотидтрифосфатом, пізніше відбувається гідроліз зв'язаного АТФ чи ГТФ до АДФ чи ГДФ відповідно.[1]
Функції MreB та його гомологів
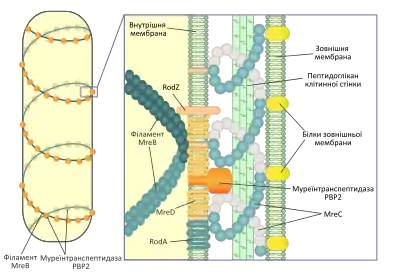
Одною із основних функцій філаментів MreB та гомологічних білків є підтримання паличкоподібної або спіральної форми бактерійної клітини. Мутації, які порушуюють експресію цих білків, призводять до вираженої зміни форми бактерій (зазвичай, вони перетворюються в округлі клітини, або у випадку Mbl — у клітини неправильної форми). Проте філаменти MreB не слугують безпосередньо каркасом для підтримання форми клітини, натомість, розташовуючись по спіралі вздовж неї вони є сайтами для прикріплення ферментів, що синтезують пептидоглікан клітинної стінки. Таким чином вони регулюють характер відкладання нових елементів до оболонки бактерій, яка власне і є визначальним фактором у підтриманні сталої форми. Подібним чином мікротрубочки рослинної клітини впливають на її форму, направляючи включення молекул целюлози в клітинну стінку.[3] У багатьох бактерій (зокрема і в E.coli та B.subtilis) ген mreB є частиною оперону, до складу якого входять також гени mreC та mreD. Цей оперон входить до великого кластеру генів, необхідних для біосинтезу пептидоглікану. Продукти генів mreC та mreD — це білки внутрішньої мембрани грам-негативних бактерій, вони взаємодіють із білком MreB і беруть участь в організації його комплексу із ферментами, задіяними в біосинтезі муреїну, такими як муреїнтранспептидаза PBP2.[1] Також до складу цього комплексу входять трансмембранні білки RodZ та RodA.[5]
Філаменти MreB також беруть участь у визначенні деяких аспектів полярності клітини, зокрема концентрації на одному або обидвох полюсах деяких білків, наприклад тих, що відповідають за хемотаксис, рухливість, секрецію та вірулентність.
Ще однією функцією MreB та його гомологів є участь у розходженні копій бактерійної хромосоми під час поділу. Серед мутантів, в яких цей білок відсутній, були виявлені клітини із кількома нуклеоїдами в цитоплазмі, а також і клітини, що не мали хромосом. Місцем прикріплення білків MreB до бактерійної ДНК є точка oriC, приєднання відбувається або безпосередньо або за участі інших білків. Під час поділу філаменти цитоскелету забезпечують розходження точок oriC двох копій ДНК до протилежних кінців клітини, механізм цього процесу наразі (2006 рік) не з'ясований. Також невідомо яким чином відбувається розходження хромосом у коків, в яких відсутній ген mreB та його гомологи.[1]
Білок розділення плазмід ParM
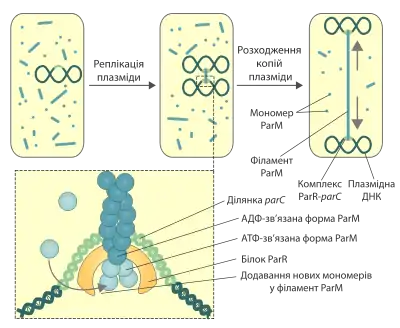
Багато малокопійних (~1-5 копій) плазмід бактерій мають спеціальні системи, що забезпечують їх розходження після реплікації. Ці механізми необхідні для того, щоб після поділу кожна з дочірних клітин отримала принаймні одну молекулу плазмідної ДНК. Відомо три типи систем, що забезпечують розходження малокопійних плазмід, у кожній з яких використовуються різні моторні білки (тип І — АТФази типу Walker A або ParA-подібні білки, тип ІІ — гомологи тубуліну або TubZ-подібні білки, тип ІІІ — гомологи актину або ParM-подібні білки). Білок ParM (від англ. partitioning motor) був вперше виявлений при дослідженні пламзіди R1 E.coli. Зараз ця система сегрегації плазмідної ДНК є найкраще вивченою.[6] Схожа система була виявлена і в інших плазмідах, зокрема тих, що відповідають за поширення стійкості до багатьох препаратів (англ. multidrug resistance).[3]
Структура і динаміка філаментів ParM
Як і всі елементи цитоскелету філаменти ParM складаються із мономерних білкових субодиниць. Ці субодиниці здатні до полімеризації in vitro у присутності АТФ або ГТФ. Утворені нитки складаються із двох протофіламентів, закручених один навколо одного (структура схожа до F-актину). У живих клітинах мономери ParM формують довгі нерозгалужені філаменти, які розміщуються вздовж осі бактерії. На відміну від актину та MreB і його аналогів ParM не утворює пучків.
Полімеризація та дисоціаця мономерів ParM залежить від приєднання та гідролізу АТФ. Нові субодиниці включаються до складу філаменту в АТФ-зв'язаній формі, при чому приєднання може відбуватись на обидвох кінцях філаменту. Одночасно із включенням нової ParM-АТФ субодиниці відбувається гідроліз АТФ в останній приєднаній білковій молекулі. Таким чином весь філамент складається із білків ParM-АДФ, і тільки на кінцях знаходяться ParM-АТФ субодиниці, які «кепують» всю структуру стабілізуючи її.
За відсутності відповідної плазміди полімеризація філаментів ParM триває поки вони не досягають певної критичної довжини. Після цього вони починають дуже швидко дисоціювати, при чому швидкість цього процесу приблизно у 100 разів перевищує таку для F-актину, тобто спостерігається так звана динамічна нестабільність, за якою ці елементи більше нагадують мікротрубочки еукаріот.[1][6]
Принцип функціювання філаментів ParM
Ген parM входить до локусу par плазміди R1, крім нього тут також міститься ділянка parC (від англ. centromere), що відіграє роль аналогічну до центромери в хромосомах еукаріот, а також ген parR, продукт якого ParR (від англ. repressor) приєднується до ділянки parC та здійснює ауторегуляцію транскрипції локуса par, а також слугує адаптером для приєднання білка ParM.
Після реплікації плазміди R1 до обидвох її копій у ділянці parC приєднується білок ParR. У такому стані він може зв'язувати та стабілізувати філаменти ParM, які постійно збираються і розбираються у цитоплазмі. Після цього полімерні нитки ParM починають видовжуватись, приєднуючи на кожному кінці нові мономери. Цей процес супроводжується гідролізом АТФ. Внаслідок видовження філаменту дві плазміди, що приєднані до його країв, розштовхуються в різні сторони аж поки не досягають полюсів клітини. Після цього відбувається дисоціація полімеру ParM.[1][6]
Білок організації магнетосом MamK
Ще один прокароітичний гомолог актину MamK бере участь в організації мембран магнетосом. Магнетосоми — це оточені мембраною органели бактерій родів Magnetospirillum та Magnetococcus, які містять кристали магнетиту і допомагають бактерії орієнтуватись у геомагнітному полі. У клітині магнетосоми розташовані в ряд, внаслідок чого вони можуть функціювати як голка магніту. Таке розташування забезпечується філаментами білка MamK, до якого ці мембранні міхурці кріпляться.[7][8]
Гомологи тубуліну
У більшості прокаріот також наявні гомологи еукаріотичного білка тубуліну, з якого складаються мікротрубочки. Найкраще вивченим із цих гомологів є блілок FtsZ, що бере участь у цитокінезі. Тубулін та FtsZ мають досить мало ідентичності в амінокислотній послідовності, консервативним є тільки ГТФазний домен, проте за просторовою структурою вони схожі між собою. Також в окремих представників бактерій та архей були виявлені інші гомологи тубуліну: наприклад білки BtubA/BtubB Prosthebacter dejoneii, а також TubZ та RepX, що кодуються плазмідними генами бактерій роду Bacillus.[9]
FtsZ та Z-кільце
FtsZ FtsZ (англ. filamenting temperature-sensitive mutant Z) — один із перший виявлених у прокаріот білок цитоскелету. Він наявний у клітинах фактично всіх досліджених бактерій та архей, а також у еукаріотичних органелах, що походять від прокаріот, зокрема пластидах.[1] Цей білок бере участь у формуванні Z-кільця, що забезпечує цитокінез під час поділу клітини. Крім FtsZ, у цьому процесі задіяна також велика кількість допоміжних білків, зокрема тих, що беруть участь у синтезі клітинної стінки бактерій.
Структура і динаміка філаментів FtsZ
Мономери FtsZ формують in vitro протофіламенти, що складаються із одного ряду цих білків. Протофіламенти не об'єднуються у структури схожі до мікротрубочок, хоча інколи і спостерігається формування пучків або листів. FtsZ полімеризується у активній ГТФ-зв'язаній формі, проте, на відміну від тубуліну, цей білок зазвичай не гідролізує ГТФ після включення його до складу протофіламенту. Таким чином, на відміну від протофіламентів мікротрубочок, які майже повністю складаються із ГДФ-тубуліну, і тільки на кінцях мають кепи із ГТФ-тубуліну, у протофіламентах FtsZ співвідношення ГТФ-зв'язаних субодиниць до ГДФ-зв'язаних становить 80:20.
За певних умов у протофіламентах FtsZ може відбуватись гідроліз ГТФ, у такому випадку їх форма переважно змінюється від прямої до зігнутої, і відбувається дестабілізація полімеру, внаслідок чого він може розпадатись на мономери. Протофіламенти FtsZ є динамічними структурами, вони постійно обмінюються субодиницями із пулом вільних мономерів.[10]
Структура Z-кільця
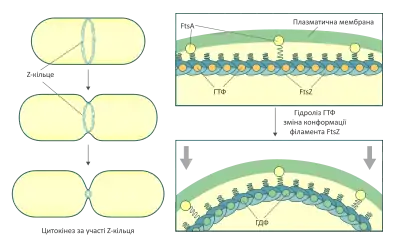
Частина білка FtsZ у клітині бере участь у формуванні Z-кільця, тоді як решта перебуває у цитоплазмі у мономерній формі, або у формі коротких філаментів. Як було показано за допомогою флуоресцентної мікроскопії (із використанням мічених антитіл, або FtsZ злитого із GFP), Z-кільце добре помітне в центрі більшості клітин. Під час клітинного поділу воно скорочується, таким чином забезпечуючи цитокінез. Одночасно із зменшенням Z-кільця у материнській клітині, FtsZ починає полімеризуватись у центрі дочірніх клітин.
Z-кільце не складається із одного замкнутого у протофіламенту FtsZ, як показують численні дослідження, кількість мономерів FtsZ у Z-кільці достатня для того, щоб зробити приблизно 2,5 витків навколо внутрішнього діаметра клітини. Оскільки окремі протофіламенти FtsZ значно коротші за окружність клітини, була запропонована модель будови Z-кільця, згідно з якою воно складається із великої кількості коротких профіламентів, що перекриваються.[10] Ця модель була підтверджена даними отриманими за допомогою електронної кріотомографії.[11] Проте існують також і альтернативні моделі будови Z-кільця, одна з яких передбачає, що протофіламенти FtsZ взаємодіють кінець до кінця і утворюють неперервну спіраль.
Для забезпечення цитокінезу Z-кільце повинне якимось чином кріпитись до плазматичної мембрани. Цю роль у більшості бактерій виконує білок напівінтегральний білок FtsA та трансмембранний білок ZipA, цитоплазматичні домени яких кріпляться до FtsZ.
Моделі функціонування Z-кільця під час цитокінезу
Механізм, за яким відбувається скорочення Z-кільця під час цитокінезу досі залишається не з'ясованим. Існувало кілька гіпотез, що описували ця вище:
- Модель ковзання: так як, швидше за все, Z-кільце складається із протофіламентів, що можуть взаємодіяти латерально, за аналогією до актину і міозину еукаріот, припускається, що існує певний моторний білок, який може забезпечувати ковзання цих протофіламентів один відносно одного. По мірі цього процесу також відбувається деполімеризація FtsZ, таким чином Z-кільце вкорочується і тягне плазматичну мембрану за собою. Головним недоліком цієї моделі є те, що ніяких таких моторних білків не було знайдено у жодного із видів бактерій.
- «Каркасна» модель: протофіламенти FtsZ можуть відігравати пасивну роль у цитокінезі. Згідно із цією моделлю вони тільки залучають ферменти синтезу клітинної стінки, до місця, де має відбутись цитокінез. Нові шари пептидоглікану, що відкладаються, забезпечують вгиннання плазматичної мембрани, через що і відбувається скорочення Z-кільця. Ця модель не в змозі пояснити механізму цитокінезу у мікобактерій, зокрема Mycobacterium tuberculosis, у яких пептидоглікан взагалі відсутній у клітинній стінці.
- Модель «повторюваного стиснення» — найбільш визнана в цей час. Цей механізм не передбачає участі якихось білків-моторів, а говорить про те, що протофіламенти FtsZ самі можуть генерувати силу, необхідну для цитокінезу. Вважається, що філаменти у складі Z-кільця приєднуються до цитоплазматичної мембрани у ГТФ-зв'язаній формі, в такому випадку вони мають пряму конформацію. Згодом в них відбувається гідроліз ГТФ, що призводить до згинання філаменту. Коли це відбувається, мебмрана клітини, приєднана до філаменту білками FtsA або ZipA, дещо вгинається. Таке послідовне стиснення мембрани і призводить до цитокінезу. Тільки останні його етапи не можуть відбуватись за таким механізмом, і можливо, проходять без участі білка FtsZ.[10][11]
Інші гомологи тубуліну
Секвенування геномів багатьох бактерій дозволило виявити деякі тубуліноподібні білки відмінні від FtsZ. Зокрема, у бактерії Prosthebacter dejoneii були знайдені два білки BtubA та BtubB (англ. Bacterial tubulin), які є гомологами відповідно α та β тубуліну. Під час полімеризації у присутності ГТФ вони утворюють гетеродимери, як і α та β тубулін. Наразі функція цих білків невідома.
Цікаво, що ці білки за амінокіслитною послідовністю значно ближчі до еукаріотичних тубулінів, ніж до їх прокаріотичного гомолога FtsZ. Вважається, що бактерія P. dejoneii отримала гени цих білків внаслідок горизонтального перенесення від еукаріот.
Інший клас гомологів тубуліну був виявлений у великих плазмідах бактерій роду Bacillus, зокрема:
- Білок TubZ Bacillus thuringiensis, що кодується генами плазиди pBtoxis;
- Білок RepX закодований у плазміді pX01 Bacillus anthracis.
Обидва ці білки здатні утворювати довгі філаменти, внаслідок полімеризації у присутності ГТФ, і є необхідними для стабільного підтримання відповідної плазміди у клітині. Вони можуть брати участь у сегрегації копій плазмід, реплікації плазмід або в обох процесах.[9]
Кресцентин — гомолог білків проміжних філаментів
Кресцентин — це білок проміжних філаментів, знайдений у бактерії Caulobacter crescentus та інших бактерій цього роду. Цей білок утворює довгу вигнуту ниткоподібну структуру, яка розміщуються вздовж внутрішнього краю комоподібної бактерії і забезпечує підтримання такої форми. За відсутності кресцентину бактерії стають плачкоподібними, але життєздатності не втрачають.[9]. Кресцентин має 25 % ідентичності та 40 % гомологічності в амінокислотній послідовності із еукаріотичними білками проміжних філаментів, а також схожу організацію білкових доменів — зокрема наявність центрального домену подвійної спіралі (англ. coiled coil). Полімеризація мономерів кресцентину, як і у випадку еукаріотинчних білків проміжних філаментів, проходить без потреби у нуклеотидах. Цікаво, що для підтирмання форми C.crescentus крім кресцентину необхідний також гомолог актину MreB, за його відсутності клітини стають сферичними, незважаючи на присутність кресцентину.[1]
Цитоскелетні АТФази типу Walker A
Окрім гомологів еукаріотичних актину, тубуліну та білків проміжних філаментів, у бактерій також виявлені компоненти цитоскелету, що не мають відповідників у клітинах ядерних. Зокрема такими є білки WACA (англ. Walker A cytoskeletal ATPase — цитоскелетні АТФази типу Walker A), що належать до функціонально різнорідної родини АТФаз, які мають у своїй структурі консервативний аномальний домен Walker A і димерезуються у присутності АТФ.
Білки WACA у АТФ-зв'язаній формі можуть утворювати полімери на певних поверхнях, наприклад на клітинній мембрані, і вважаються елементами цитоскелету. До цього класу належить білок MinD, що бере участь у визначенні місця, в якому буде проходити цитокінез під час поділу, та білки ParA, Soj, а також SopA та ParF, які забезпечують розходження (сегрегацію) копій плазмід і бактерійної хромосоми. Не зважаючи на те, що вони мають різні функції, ці білки мають дуже схожу просторову будову і високий рівень гомології в амінокислотній послідовності. Всі WACA здатні до гідролізу АТФ, їхня каталітична активність регулюється шляхом взаємодії із активуючими білками: для MinD — це білок MinE, а для ParA — ДНК-зв'язуючий білок ParB. Також цю родину білків об'єднує те, що за всіма ними спостерігається динамічна поведінка in vivo: полімеризовані форми цих білків осцилюють між певними клітинними ділянками. Наприклад, MinD полімеризуються то на одному полюсі клітини, то на іншому, тривалість такого циклу становить приблизно 40-50 сек. Білки ParA та Soj осцилюють переважно між двома нуклеоїдами перед поділом, а часові інтервали «перестрибування» у них менш регулярні (від кількох хвилин до години).[12]
Система MinCDE
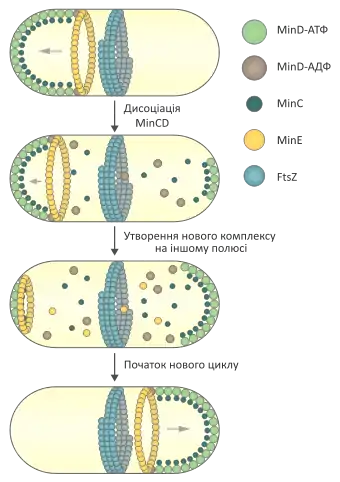
Механізм осцилювання найкраще вивчений на прикладі системи MinCDE, до складу якої входить WACA MinD. Ця система необхідна клітині для того, щоб точно розмістити Z-кільце в центральній частині для правильного проходження цитокінезу. До її складу входять три білки:
- MinC — інгібітор полімеризації FtsZ;
- MinD — цитоскелетний білок WACA, що полімеризується на цитоплазматичній мембрані;
- MinE — білок, що стимулює гідролітичну активність MinD.
В E.coli ця система функціонує наступним чином: після приєднання молекули АТФ MinD полімеризується на плазматичній мембрані, утворюючи спіралі. У такій активованій формі він зв'язує білок MinC, через що у цьому конкретному місці пригнічується утворення Z-кільця. Також MinD-АТФ може взаємодіяти із MinE, що стимулює гідроліз АТФ, після цього інактивований MinD від'єднується від мембрани і може дисоціювати в інше місце. Дисоціює він переважно на протилежний полюс клітини, де нема білка MinE, там починається полімеризація нового комплексу, яка триває до тих пір, поки не закінчиться деполімеризація старого. А коли вона починає підходити до кінця, то білок MinE вивільняється і починає «руйнувати» новоутворений комплекс MinD/MinC. Таким чином цей комплекс «скаче» від одного полюсу до іншого із періодичністю 40-50 хв, і не зачіпає тільки центральну ділянку, в якій і відбувається утворення Z-кільця, оскільки там її нічого не пригнічує.[12]
Попри те, що MinD є дуже консервативним білком серед прокаріот, у різних видів він функціонує по-різному, наприклад у B.subtilis не відбувається осцилювання: MinD постійно приєднаний до клітинних полюсів за допомогою іншого білка DivIVA. Окрім того, бактерії мають «запасні» механізми просторового регулювання цитокінезу, які діють навіть за відсутності MinCDE, наприклад механізм «уникнення нуклеоїда»: формування Z-кільця пригнічується поблизу від нуклеоїда.
У деяких бактерій взагалі відсутня і система MinCDE і механізм «уникнення нуклеоїда», наприклад у C.crescentus місце проходження цитокінезу визначається за допомогою білка MipZ (що має схожість до ParA). Цей білок полімеризується поблизу точки ori і також пригнічує утворення Z-кільця.[12]
Використані джерела
- Shih YL, Rothfield L (2006). The bacterial cytoskeleton. Microbiol Mol Biol Rev 70: 729–54. PMID 16959967. doi:10.1128/MMBR.00017-06.
- Bi EF, Lutkenhaus J (1991). FtsZ ring structure associated with division in Escherichia coli. Nature 354: 161–4. PMID 1944597. doi:10.1038/354161a0.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
- Gitai Z (2005). The new bacterial cell biology: moving parts and subcellular architecture. Cell 120: 577–86. PMID 15766522. doi:10.1016/j.cell.2005.02.026.
- Gerdes K (2009). RodZ, a new player in bacterial cell morphogenesis. The EMBO Journal 28: 171 – 172. PMID 19194484. doi:10.1038/emboj.2008.287.
- Salje J, Gayathri P, Löwe J (2005). The ParMRC system: molecular mechanisms of plasmid segregation by actin-like filaments. Cell 120: 577–86. PMID 15766522. doi:10.1016/j.cell.2005.02.026.
- Taoka A, Asada R, Wu LF, Fukumori Y (2007). Polymerization of the actin-like protein MamK, which is associated with magnetosomes. J Bacteriol 189: 8737–40. PMID 17905974. doi:10.1128/JB.00899-07.
- Thanbichler M, Shapiro L (2008). Getting organized--how bacterial cells move proteins and DNA. Nat Rev Microbiol 6: 28–40. PMID 18059290. doi:10.1038/nrmicro1795.
- Pogliano J. (2008). The bacterial cytoskeleton. Curr Opin Cell Biol 20: 19–27. PMID 18243677. doi:10.1016/j.ceb.2007.12.006.
- Erickson HP, Anderson DE, Osawa M (2010). FtsZ in Bacterial Cytokinesis: Cytoskeleton and Force Generator All in One. Microbiol Mol Biol Rev 74: 504–28. PMID 21119015. doi:10.1128/MMBR.00021-10.
- Li Z, Trimble MJ, Brun YV, Jensen GJ (2007). The structure of FtsZ filaments in vivo suggests a force-generating role in cell division. EMBO J 26: 4694–708. PMID 17948052. doi:10.1038/sj.emboj.7601895.
- Michie KA, Löwe J (2006). Dynamic filaments of the bacterial cytoskeleton. Annu Rev Biochem 75: 467–92. PMID 16756499. doi:10.1146/annurev.biochem.75.103004.142452.