Автофагія
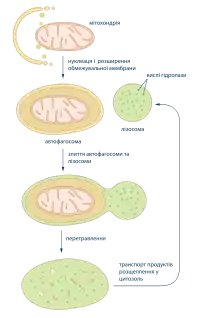
Автофагі́я (дав.-гр. φαγεῖν — поїдати та αὐτο — себе) — процес перетравлення клітиною власних органел та ділянок цитоплазми за допомогою лізосом. Автофагія потрібна для позбавлення від старих і пошкоджених частин, а також може активуватись в умовах голодування. Процес розпочинається оточенням відповідної органели або ділянки цитоплазми подвійною мембраною, утворена автофагосома зливається із лізосомою, де на її вміст діють гідролітичні ферменти. Наприклад, у печінці середня тривалість існування мітохондрій не перевищує десяти днів, після чого вони руйнуються в процесі автофагії. Продукти розщеплення використовуються для побудови нових клітинних компонент[1].
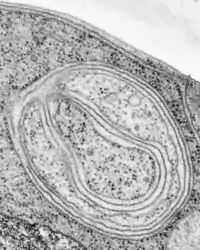
Руйнування старих органел — суворо регульований процес, відповідні компоненти певним чином мітяться для лізосомної деградації. Наприклад у гепатоцитах під час знешкодження гідрофобних сполук, таких як фенобарбітали, сильно збільшується кількість мембран ендоплазматичного ретикулуму, які по завершенню детоксифікації селективно підлягають автофагії. З іншого боку, під час голодування автофагосоми захоплюють ділянки цитоплазми випадковим чином, метаболіти, що виділяються внаслідок розщеплення макромолекул, допомагають клітині деякий час виживати без надходження поживних речовин із середовища. Окрім того, автофагія має значення у процесах розвитку, оскільки вона дозволяє руйнувати більше не потрібні частини клітини. Також цей процес може бути використаний для руйнування вірусів та бактерій[1].
Точні молекулярні механізми проходження автофагії досі повністю не з'ясовані. У дріжджів та тварин було виявлено більше 25 білків задіяних у цьому процесі (Atg гени). Автофагію загалом можна поділити на чотири основні етапи: 1) нуклеація і ріст обмежувальної мембрани, що приймає форму півмісяця і захоплює частину цитоплазми; 2) замикання автофагосоми; 3) злиття автофагосоми із лізосомою; 4) перетравлення вмісту автофагосоми[1].
Регуляція автофагії
Автофагія регулюється сигнальними шляхами фосфатидилінозитол-3-кінази (ФІ3К) типу I та ФІ3К типу III. Перший із них пригнічує автофагію. Він починається із активації інсуліном або інсуліноподібними факторами росту, що свідчать про наявність енергетичних субстратів, відповідних рецепторних тирозинкіназ. Останні стимулюють фосфатидилінозитол-3-кіназу продукувати фосфатидилінозитол-3,4,5-трифосфат (ФІ(3,4,5)Ф3), який у свою чергу залучає до плазматичної мембрани протеїнкіназу Akt (також протеїнкіназа B, ПКB) та фосфоінозитид-залежну протеїнкіназу 1 (PDK1), що в результаті призводить до активації Akt, яка після цього може фосфорилювати багато клітинних білків[2]. Супресор пухлин PTEN (гомолог фосфатази і тензину, англ. phosphatase and tensin homolog) розщеплює ФІ(3,4,5)Ф3 у мембрані, перешкоджаючи його накопиченню і таким чином сприяє автофагії[3].
До мішеней протеїнкінази Akt належать продукти генів TSC1 та TSC2 (англ. TSC — tuberous sclerosis complex), вони інактивуються внаслідок фосфорилювання. TSC1 та TSC2 є позитивними модуляторами автофагії, завдяки тому, що вони пригнічують малий G-білок Rheb. Функція останнього полягає в активації TOR (англ. target of rapamycin, мішень рапаміцину, у ссавців цей білок називається mTOR), який пригнічує автофагію. Механізм функціонуванн TOR до кінця не відомий, проте є дані про те, що у дріжджів його дія опосередковується кіназою Atg1. Оскільки сигнальний шлях ФІ3К також регулює синтез білків, захоплення поживних речовин, клітинний цикл та пригнічує апоптоз, очевидно, що автофагія тісно пов'язана із цими процесами[3].
Позитивно регулює автофагію сигнальний шлях ФІ3К III типу. ФІ3К III сприяє утворенню ізоляційної мембрани автофагсоми, в цьому процесі також бере участь Atg6 (інша назва Beclin1). Для росту подвійної ізоляційної мембрани необхідні дві убіквітиноподібні системи, до складу яких входять білки Atg3, Atg4, Atg5, Atg7, Atg8, Atg10, Atg12 і Atg16, консервативні у вищих тварин. Ізоляційна мембрана охоплює потрібну ділянку цитоплазми, проте досі не відомо яким чином забезпечується селективність цього процесу[3].
Роль автофагії в загибелі клітин
Хоча автофагія є стратегією виживання клітин, існують експериментальні дані, які свідчать про те, що вона може бути задіяна і в механізмах запрограмованої смерті. Зокрема, у багатьох випадках спостерігалась одночасна активація каспаз (ферментів, що беруть участь у протіканні апоптозу) та формування автофагосом у клітинах, що гинуть[3].
Роль автофагії у загибелі клітин досі залишається суперечливим питанням. Однією із можливостей є те, що вона взагалі не має такої ролі, а призначена тільки для «порятунку» клітини в стресових умовах, що передують смерті. Проте таке припущення погано узгоджується із деякими спостереженнями: наприклад у клітинах слинних залоз дрозофіли чорночеревої стероїдні гормони одночасно активують проапоптичні гени та гени Atg. Якби автофагія була потрібна тільки для забезпечення виживання, то не зрозуміло, чому цей шлях повинен активуватись всього за 2 години до загибелі клітин[3].
Автофагія може бути необхідною для запуску клітинної смерті другого типу. Наприклад, вона може забезпечувати деградацію певної порогової кількості цитоплазматичних факторів, необхідних для виживання, або здійснювати селективне розщеплення регуляторних молекул та органел із такою функцією[3].
Якщо розглядати автофагію у контексті живлення цілого організму, а не окремої клітини, то можна припустити, що вона може бути потрібною для підтримання життєдільності всього багатоклітинного об'єднання за рахунок смерті деяких його членів. Наприклад у личинок комах і амфібій, на стадіях розвитку, що не годуються, спостерігалась загибель клітин із автофагічними структурами[3].
Одним із найпростіших пояснень наявності автофагосом у клітинах, які гинуть, є те, що смерть потребує і механізмів загибелі, і механізмів деградації. У випадку апоптозу ці дві активності забезпечуються різними клітинами: перша — самою апоптичною клітиною, друга — фагоцитами. Ймовірно, в умовах, коли кількість фагоцитів недостатня функцію деградації може брати на себе автофагія[3].
Дослідження автофагії
Термін автофагія в сучасному розумінні широко вживати став Крістіан де Дюв у 1962 році.
У 2016 році за відкриття механізмів автофагії японець Осумі Йосінорі отримав Нобелівську премію з фізіології або медицини [4].
Примітки
- Alberts et al, 2007, с. 782—783.
- Alberts, 2007, с. 934.
- Baehrecke EH (2005). Autophagy: dual roles in life and death?. Nat Rev Mol Cell Biol 6: 505—10. PMID 15928714. doi:10.1038/nrm1666.
- Нобелівська премія з фізіології або медицини 2016 року. Nobelprize.org. Процитовано 3 жовтня 2016.(англ.)
Джерела
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.