Адамантан
Адамантан — хімічна сполука, насичений трициклічний містковий вуглеводень з формулою C10H16.Молекула адамантану складається з трьох циклогексанових фрагментів, що знаходяться в конформації «крісло».[2] Просторове розташування атомів вуглецю в молекулі адамантану повторює розташування атомів в кристалічній решітці алмазу. Цим фактом пояснюється походження назви сполуки, тому що слово ἀδάμας — «незламний» — є також грецькою назвою алмазу.[3]
| Адамантан | |
|---|---|
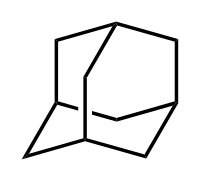 | |
| Систематична назва | трицикло[3.3.1.13,7]декан |
| Ідентифікатори | |
| Номер CAS | 281-23-2 |
| Номер EINECS | 206-001-4 |
| DrugBank | 03627 |
| ChEBI | 40519 |
| SMILES |
C1C2CC3CC1CC(C2)C3[1] |
| InChI |
InChI=1S/C10H16/c1-7-2-9-4-8(1)5-10(3-7)6-9/h7-10H,1-6H2 |
| Номер Бельштейна | 1901173 |
| Номер Гмеліна | 26963 |
| Властивості | |
| Молекулярна формула | C10H16 |
| Молярна маса | 136 г/моль |
| Зовнішній вигляд | безкольорові кристали |
| Густина | 1,07 г/см³ |
| Тпл | 268 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Систематичною хімічною назвою сполуки є трицикло[3.3.1.13,7]декан, хоча відповідно до практичних порад IUPAC щодо номенклатури органічних сполук рекомендуєься використання назви адамантан.[4]
Унікальність молекули адамантану полягає в тому, що вона є жорсткою та практично вільною від напруження одночасно.[5] Відкриття адамантану і вивчення його властивостей послужило імпульсом до розвитку однієї з областей сучасної органічної хімії — хімії органічних поліедранів.[6] Похідні адамантана знайшли практичне застосування як лікарські препарати, що володіють різною біологічною активністю (антивірусні препарати, тощо). На основі адамантану розроблені полімерні матеріали та композиції з поліпшеними експлуатаційними властивостями, термостабільні мастильні матеріали.[6]
Історія вивчення
Вперше на можливість існування вуглеводню складу C10H16 с алмазоподібною будовою молекули вказував Деккер (Decker H.) на науковому конгресі в Інсбруці в 1924 році.[7] Він навіть висловив здивування тим фактом, що такий вуглеводень на той час ще не був синтезований.
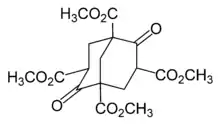
Перша спроба синтезувати адамантан в лабораторних умовах була зроблена німецьким хіміком Гансом Меервейном, також в 1924 році. Він припустив, що адамантан утворюється в результаті реакції формальдегіду з малоновий ефіром у присутності піперидину. Однак реалізувати це перетворення на практиці Меервейну не вдалося, оскільки замість адамантану був отриманий тетраметиловий ефір бицикло [4,3,1] нонадіон-2,6-тетракарбонової-1,3,5,7 кислоти, який згодом отримав назву «ефір Меервейна». Хоча в цілому експеримент виявився невдалим, саме ефір Меервейна згодом використовувався як вихідна сполука в перших успішних синтезах адамантану і його похідних.[6]
Інші дослідники робили спроби синтезувати адамантан виходячи з флороглюцину або з деяких похідних циклогексанону, однак такі експерименти виявилися невдалими.[5]
Як індивідуальна хімічна сполука адамантан був відкритий чеськими хіміками С. Ланда і В. Махачек в 1933 році.[8] Цей вуглеводень був виділений ними з нафти Годонінського родовища. Вчені отримали лише кілька міліграмів адамантану, структуру якого встановили багато в чому завдяки аномально високій температурі плавлення.[5] Згодом адамантан був виявлений і в інших нафтових родовищах.
Перший успішний хімічний синтез адамантану вдалося здійснити швейцарському хіміку Прелогу в 1941 році.[9][10] Адамантан був отриманий з ефіру Меервейна у п'ять стадій, при цьому загальний вихід склав менше одного відсотка:
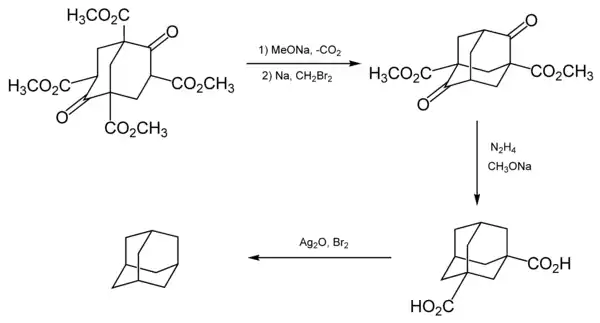
Пізніше Штеттером була запропонована інша синтетична схема, в результаті чого вихід адамантану був підвищений до 6,5 %.[6][11]
Важливою подією в історії вивчення хімії адамантану стало відкриття, зроблене Шлейером і Дональдсоном в 1957 році. Вченими був розроблений ефективний метод отримання великих кількостей цього вуглеводня.[12] Ця робота зробила адамантан цілком доступним з'єднанням, що послужило стимулом до активного вивчення його фізичних і хімічних властивостей.
Отримання
З природних джерел
Єдине відоме природне джерело адамантану — нафта.[6][13] Вміст цього вуглеводню в нафті становить всього 0,0001 — 0,03 % (залежно від родовища), внаслідок чого такий спосіб отримання адамантану є економічно невигідним.
Крім самого адамантану, у нафті присутні його численні похідні.[6] Таких сполук відомо більше тридцяти. Виділення адамантану зі складної суміші вуглеводнів нафти можливо завдяки його унікальним фізико-хімічним властивостям, таким як висока температура плавлення, здатність переганятися з водяною парою і утворювати стійкі аддукти з тіокарбамідом.
Синтетичні
Метод Прелога вже не використовується для синтезу незаміщеного адамантану у зв'язку з високою трудомісткістю і низьким виходом кінцевого продукту. Однак, він все має деяку синтетичну цінність за необхідності отримати похідні адамантану із специфічним розташуванням замісників, зокрема 1,3-адамантандикарбонової кислоти.[5]
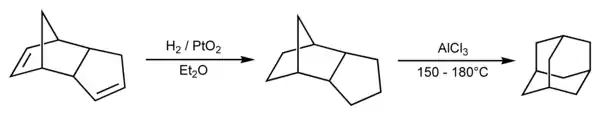
Наразі для хімічного синтезу адамантану в лабораторних умовах використовують метод Шлейера. Димер циклопентадієну (який є цілком доступною речовиною) піддається каталітичному гідруванню, після чого ізомеризується в адамантан в присутності каталізатора — кислот Льюіса. Методика, описана в Organic Synthesis, передбачає використання оксиду платини як каталізатора гідрування, а також хлориду алюмінію як кислот Льюіса, каталізатора ізомеризації. При цьому вихід адамантану становить 13-15 %.
Адамантан є цілком доступною хімічною сполукою. Вартість одного грама у різних фірм-виробників зазвичай не перевищує одного долара США.
Номенклатура
Згідно з правилами систематичної номенклатури, адамантан слід називати трицикло[3.3.1.1 3,7]декан. Однак ІЮПАК рекомендує використовувати назву «адамантан» як більш прийнятну.
Молекула адамантана володіє високою симетрією. Внаслідок цього 16 атомів водню і 10 атомів вуглецю, що утворюють її, можуть бути віднесені всього до двох типів.

Положення типу 1 називаються вузловими , а положення типу 2 — мостовим . У молекулі адамантану налічується чотири вузлових і шість мостових положень.
Зазвичай 1-адамантільний заступник у літературі традиційно позначають символами «Ad-».
Фізичні властивості
Індивідуальна речовина

Хімічно чистий адамантан є безбарвною кристалічною речовиною, що має характерний камфорний запах. Він практично не розчиняється у воді, але легко розчиняється в неполярних органічних розчинниках.Адамантан має незвичайно високу для вуглеводнів температуру плавлення (268 °C), та попри це повільно сублімує вже при кімнатній температурі. Крім того, він може переганятися з водяною парою.
Структурні властивості
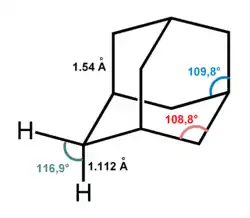
Молекула адамантану включає в себе три конденсованих циклогексанових кільця, що знаходяться в конформації «крісло». Параметри молекули адамантану були визначені методом дифракції електронів і рентгенівських променів. Було встановлено, що довжина кожного зв'язку «вуглець — вуглець» становить 1,54 Å, а кожного зв'язку «вуглець — водень» — 1,112 Å.
Кристалічний адамантан існує у вигляді гранецентричної кубічної решітки (така будова кристалічної ґратки є дуже рідкісною для органічних сполук). При охолодженні цієї форми до температури нижче −65 °C спостерігається фазовий перехід з утворенням об'ємно-центрованої тетрагональної ґратки.
Оптична активність
Молекули адамантана, що містить чотири різних замісники при вузлових атомах вуглецю, є хіральними і оптично активними. При цьому центр хіральності, як і в оптично активних біфенілів, не припадає на який-небудь конкретний атом. Вперше такий вид оптичної активності був описаний в 1969 році двома групами вчених. Оптична активність була виявлена у адамантану, що містить у вузлових положеннях чотири різних замісники: водень, бром, метил та карбоксильну групу. Вченим вдалося провести поділ енантіомерів цієї сполуки і продемонструвати, що оптично активні адамантани мають дуже маленькі значення питомого обертання (зазвичай до 1 °).Це можна пояснити більшою віддаленістю заступників від центру хіральності, ніж, наприклад, у випадку асиметричного атома вуглецю. Оптично активні адамантани не знайшли практичного застосування.
Хімічні властивості
Вуглеводні, структура яких утворена тільки σ-зв'язками, відрізняються хімічної інертністю. Однак, попри це, адамантан і його похідні досить реакційноздатні. Ця їхня властивість особливо яскраво проявляється в реакціях іонного типу, які протікають з утворенням карбокатіонів як інтермедіатів.
Адамантильні катіони
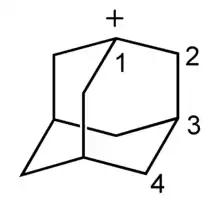
1-адамантил-катіон володіє високою стабільністю в порівнянні з іншими третинними карбокатіонами. Він легко утворюється в результаті взаємодії 1-фтор-адамантана з SbF5 . Дикатіон адамантану був отриманий в розчинах суперкислот. Він володіє підвищеною стабільністю завдяки явищу, яке отримало назву «тривимірна ароматичність».
Адамантан є зручною модельною сполукою для вивчення карбокатіонів і факторів, що впливають на їх стабільність.
Реакції по вузлових положеннях
Найбільш реакційноздатними положеннями молекули адамантану є вузлові. Існує безліч методів модифікації по них.
Бромування
Адамантан легко вступає в реакцію з різними бромуючими реагентами, в першу чергу з молекулярним бромом. Склад і співвідношення продуктів реакції можуть бути різними і залежать від умов проведення реакції, зокрема, наявності каталізаторів.
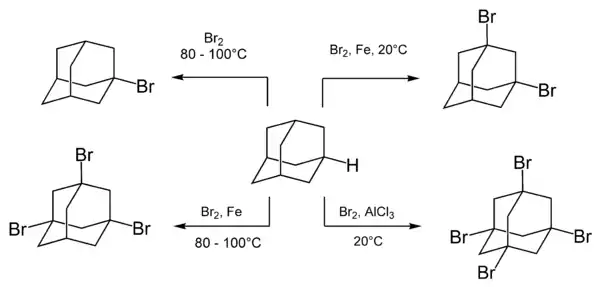
При кип'ятінні адамантану з бромом утворюється монозаміщений продукт — 1-бромадамантан. При використанні як каталізаторів різних кислот Льюїса можливе утворення дво-, три- або чотиризаміщенних бромадамантанів.
Реакція бромування протікає по іонному механізму з утворенням адамантильного карбокатіона як інтермедіату. Це підтверджується, наприклад, тим, що швидкість реакції збільшується в присутності кислот Льюїса і не змінюється при опроміненні реакційної суміші або додавання донорів вільних радикалів.[5]
Фторування
Перші синтези 1-фторадамантану були проведені з використанням 1-гідроксиадамантану. У всіх випадках генерувався адамантильний катіон, який далі взаємодіяв з фторовмісним нуклеофілом. Відома також реакція адамантану з газоподібним фтором, в ході якої утворюється 1-фторадамантан.
Карбоксилювання
У 1-ше положення адамантана може бути введена карбоксильна група.Відповідна реакція була вперше описана в 1960 році. Як карбоксилюючий агент була використана мурашина кислота, як розчинник — тетрахлорид вуглецю.
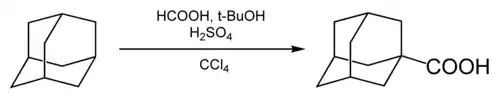
Роль трет-бутанолу та сірчаної кислоти полягає в генеруванні адамантильного катіона, який згодом піддається карбонілюванню моноксидом вуглецю, що генеруютьсяin situпри взаємодії мурашиної та сірчаної кислот. Вихід 1-адамантанкарбонової кислоти у препаративному варіанті методу становить 55-60 %.
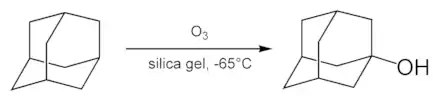
Гідроксилювання
Найпростішим адамантановим спиртом є 1-гідроксиадамантан. Він досить легко утворюється при гідролізі 1-бромадамантана у водному ацетоні. Крім того, існує методика синтезу 1-гідроксиадамантану шляхом озонування самого адамантану.
Реакції по мостикових положеннях
Мостикове положення менш реакційноздатне, ніж вузлове, у зв'язку з чим похідні адамантану цього типу менш доступні. Важливою реакцією, яка дозволяє отримувати похідні цього типу, є взаємодія адамантану з концентрованою сірчаної кислотою, в результаті чого утворюється кетон — адамантанон.
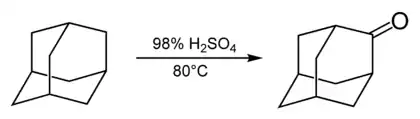
Наявність в адамантаноні карбонільної групи дає можливість проводити подальшу модифікацію по мостиковому положенню шляхом взаємодії цього кетону з нуклеофільними реагентами. Наприклад, адамантанон служить вихідним з'єднанням для отримання таких похідних адамантану, як 2-адамантанкарбонітрил
Застосування
Адамантан як проста речовина не знайшов практичного застосування. Однак деякі його похідні успішно використовуються людиною в різних галузях діяльності.
В медицині
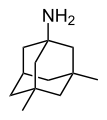
Першим похідним адамантану, яке знайшло застосування як лікарський засіб став амантадин. Спочатку він використовувався як противірусний препарат, ефективний у боротьбі з вірусом грипу А2 (1967). Пізніше був виявлений його антипаркінсонічний ефект.
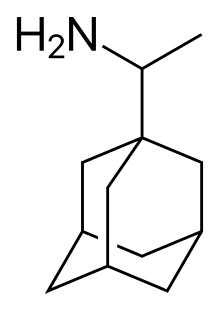
Серед інших похідних адамантана, які є діючими речовинами лікарських препаратів, можна назвати мемантин, римантадин, допамантін, тромантадін, вілдагріптін і кармантадін.
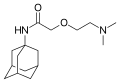 Тромантадін
Тромантадін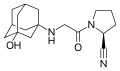 Вілдагріптін
Вілдагріптін
Полімерні аналоги адамантана запатентовані як противірусні препарати, активні проти ВІЛ.
В техніці
За допомогою адамантана були отримані алмазоподібні плівки, які в міцності лише у три рази поступаються алмаз у. Вони утворюються при впливі на пари адамантана електричних розрядів. При нанесенні таких плівок на будь-яку поверхню збільшується її твердість. Деякі алкільні похідні адамантану знайшли застосування як робоча рідина в гідравлічних установках. Полімери на основі адамантана передбачається використовувати при виготовленні сенсорних покриттів для електронних дисплеїв.
Структурні аналоги
У адамантанів є ряд структурних аналогів серед неорганічних та елементоорганічних сполук. До них належать оксид фосфору (V), сульфід фосфору (V), уротропін, а також деякі інші сполуки.
 Адамантан
Адамантан
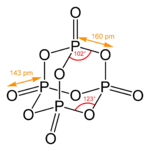
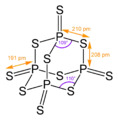 Пентасульфид фосфора
Пентасульфид фосфора Тетраметилендисульфотетрамин
Тетраметилендисульфотетрамин
У 2005 році був синтезований кремніевий аналог адамантану[14].
Примітки
- ADAMANTANE
- Несмеянов А. Н. Начала органической химии. — 1969. — Т. 1. — 664 с.
- Багрий Е. И. Особенности строения и свойств адамантанов // Адамантаны: Получение, свойства, применение. — Москва : Наука, 1989. — С. 5—57. — ISBN 5-02-001382-x.
- Рекомендації ІЮПАК щодо номенклатури. Архів оригіналу за 17 грудня 2008. Процитовано 9 листопада 2014.
- Raymond C. Fort, Jr., and Paul Von R. Schleyers. (1964). Adamantane: Consequences of Diamondoid Structure. Chem. Rev. 64 (3): 277—300. doi:10.1021/cr60229a004.
- Синтез производных адамантана (рос.). Процитовано 11 грудня 2009. Задача спецпрактикума для студентов IV курса кафедры химии нефти и органического катализа МГУ
- Decker H. (1924). Versammlung deutscher Naturforscher und Ärzte. Innsbruck, 21.—27. September 1924. Angew. Chem. 37 (41): 795. doi:10.1002/ange.19240374102.
- Landa, S.; Machácek, V. (1933). Collection Czech. Chem. Commun. 5: 1.
- Prelog, V., Seiwerth,R. (1941). Über die Synthese des Adamantans. Berichte 74: 1644—1648. doi:10.1002/cber.19410741004.
- Prelog, V., Seiwerth,R. (1941). Über eine neue, ergiebigere Darstellung des Adamantans. Berichte 74: 1769—1772. doi:10.1002/cber.19410741109.
- Stetter, H., Bander, O., and Neumann, W., Ber., 89, 1922 (1956).
- Schleyer, P. von R. (1957). A Simple Preparation of Adamantane. J. Am. Chem. Soc. 79: 3292—3292. doi:10.1021/ja01569a086.
- Багрий Е. И. Методы получения углеводородов ряда адамантана // Адамантаны: Получение, свойства, применение. — Москва : Наука, 1989. — С. 58—123. — ISBN 5-02-001382-x.
- Jelena Fischer, Judith Baumgartner, Christoph Marschner. (2005). Synthesis and Structure of Sila-Adamantane. Science 310 (5749): 825. doi:10.1126/science.1118981.
Посилання
- Адамантан // Велика українська енциклопедія : у 30 т. / проф. А. М. Киридон (відп. ред.) та ін. — 2016. — Т. 1 : А — Акц. — 592 с. — ISBN 978-617-7238-39-2.
