Органічна хімія
Органі́чна хі́мія — один з найважливіших розділів хімії, який вивчає структуру та властивості органічних сполук, вуглеводнів та їхніх похідних (тобто майже всіх сполук вуглецю з іншими хімічними елементами), займається розробленням методів синтезу, досліджує реакційну здатність таких сполук. Здатність вуглецю з'єднуватися з більшістю елементів і утворювати молекули різного складу і будови обумовлює різноманіття органічних сполук (до кінця XX століття їх число перевищило 10 млн, зараз понад 20 млн). В органічних сполуках вуглець завжди знаходиться в збудженому стані (явище переходу електронів на більш високі енергетичні рівні за розпаду заповненої комірки на нижчому енергетичному рівні), коли його максимальна валентність дорівнює IV, а не II (за спокійного стану). Органічні сполуки відіграють ключову роль в існуванні живих організмів.
Основною метою фундаментальних досліджень у галузі органічної хімії є:
- встановлення залежності властивостей органічних сполук від їх будови,
- вивчення фізичних і хімічних властивостей органічних сполук, зокрема практично цінних властивостей, з метою використання цих сполук у різних галузях господарства,
- вивчення нових типів і механізмів органічних реакцій, розвиток методів синтетичної органічної хімії.
Історія органічної хімії
- Див. також Історія хімії

Способи отримання різних органічних речовин були відомі ще з давнини. Єгиптяни і римляни використовували барвники індиго і алізарин, що містяться в рослинах. Багато народів знали секрети виробництва спиртних напоїв і оцту з сировин, які містять цукор і крохмаль.
За часів середньовіччя до цих знань нічого не додалося, деякий прогрес почався тільки в XVI–XVII століттях: були отримані деякі речовини, в основному шляхом перегонки певних рослинних продуктів. У 1769–1785 роках Шеєле виділив кілька органічних кислот, таких як яблучна, лимонна, винна, галова, молочна і щавлева. У 1773 році Руель виділив з людської сечі сечовину.
Виділені з тваринної або рослинної сировини продукти мали між собою багато спільного, але відрізнялися від неорганічних сполук. Так виник термін «Органічна хімія» — розділ хімії, котрий вивчає речовини, виділені з організмів (визначення Берцеліуса, 1807 р.).
Однак, цю ідею було спростовано в 1828 році, коли німецький дослідник Фрідріх Велер вперше синтезував сечовину (яка є біологічно важливою органічною речовиною) шляхом випаровування водного розчину типової неорганічної солі, ціанату амонію NH4OCN. Ця дата часто вважається початком органічної хімії як наукової дисципліни. Але справжнє сприйняття органічної хімії як незалежної дисципліни відбулось дещо пізніше, в другій половині XIX ст.
Важливим етапом стала розробка теорії валентності Купером і Кекуле в 1857 році, а також теорії хімічної будови Бутлеровим в 1861 році. В основу цих теорій були покладені чотиривалентність Карбону і його здатність до утворення ланцюгів. У 1865 році Кекуле запропонував структурну формулу бензену, що стало одним з найважливіших відкриттів в органічній хімії. У 1875 році Вант-Гофф і Ле Бель запропонували тетраедричну модель атома Карбону, за якою валентності Карбону направлені до вершин тетраедра, якщо атом Карбону помістити в центр цього тетраедра. У 1917 Льюїс запропонував розглядати хімічний зв'язок за допомогою електронних пар.
У 1931 році Хюккель застосував квантову теорію для пояснення властивостей альтернантних ароматичних вуглеводнів, чим заснував новий напрям в органічній хімії — квантову хімію. У 1933 році Інгольд провів вивчення кінетики реакції заміщення біля насиченого атома Карбону, що призвело до масштабного вивчення кінетики більшості типів органічних реакцій.
Предметом вивчення були переважно субстанції біологічного походження. Але науково-технічний прогрес не стояв на місці, і з часом основною матеріальною базою органічної хімії стала кам'яновугільна смола, що виділяється при отриманні коксу прожарюванням кам'яного вугілля. Саме на основі переробки кам'яновугільної смоли вкінці XIX століття виник основний органічний синтез. У 50-60 роках XX століття відбувся перехід основного органічного синтезу на нову базу — нафту. Таким чином з'явилася нова галузь хімії — нафтохімія. Величезний потенціал, який був закладений у нову сировину викликав бум в органічній хімії і хімії взагалі. Виникнення та інтенсивний розвиток такої області як хімії полімерів зобов'язана перш за все нової сировинної бази.
Попри те, що сучасна органічна хімія як матеріальну базу і далі використовує сировину біологічного походження і кам'яновугільну смолу, обсяг переробки цих видів хімічної сировини порівняно з переробкою нафти малий. Зміна матеріально-сировинної бази органічної хімії була викликана насамперед можливостями нарощування обсягів виробництва.
Основними віхами в історії органічної хімії були
- Синтез органічних сполук з неорганічних (синтез сечовини Велером в 1828 році)
- Розвиток індустрії барвників (друга половина XIX ст.)
- Реакція Вюрца (утворення С-С зв'язків)
- Відкриття реакцій конденсації кетонів та естерів
- Реактиви Гріньяра
- Відкриття ядерного магнітного резонансу, як методу аналізу
- Відокремлення біохімії, супрамолекулярної хімії та інших розділів.
Основні напрямки досліджень в органічній хімії
Основні напрямки досліджень:
- Розробка методів синтезу органічних сполук різних класів.
- Розробка теоретичних та експериментальних методів дослідження будови і властивостей органічних сполук.
- Вивчення будови, фізичних та хімічних властивостей органічних сполук.
- Вивчення нових типів і механізмів органічних реакцій.
- Хімія аліфатичних, аліциклічних, ароматичних, гетероциклічних, азотовмісних, сірковмісних та інших органічних сполук.
Класифікація органічних сполук
В основі класифікації лежить структура органічних сполук. Основа опису структури — структурна формула. Атоми елементів позначаються латинськими символами, як вони позначені в періодичній таблиці хімічних елементів (таблиці Менделєєва). Водневий і електрондефіцитний зв'язки позначаються пунктирною лінією, іонний зв'язок позначається зазначенням зарядів частинок, що входять до складу молекули. Оскільки в переважну більшість органічних молекул входить водень, його зазвичай не позначають при зображенні структури, але позначають, якщо він приєднаний до атомів функціональної групи. Отже, якщо в структурі у одного з атомів вуглецю зображена недостатня валентність, значить, біля цього атома розташований один або кілька атомів водню. Атоми можуть утворювати циклічні і ароматичні системи.
Основні класи органічних сполук
- Вуглеводні — сполуки, що складаються тільки з атомів вуглецю і водню. Вони в свою чергу діляться на:
- Насичені — не містять кратних зв'язків в своїй структурі (алкани);
- Ненасичені — мають у своєму складі хоча б один подвійний (алкени) і / або потрійний зв'язок (алкіни).
- З відкритим ланцюгом;
- З замкнутим ланцюгом — містять цикл (циклічні).
- Молекули з гетероатомами у функціональних групах — сполуки, у яких карбоновий радикал R пов'язаний з функціональною групою, яка містить гетероатом. За характером функціональних груп поділяються на:
- Галогенні;
- Спирти, феноли;
- Прості ефіри (етери);
- Складні ефіри (естери);
- Сполуки, що містять карбонільну групу:
- Сполуки, що містять карбоксильну групу (Карбонові кислоти, складні ефіри);
- Сірковмісні сполуки;
- Азотовмісні сполуки;
- Металоорганічні сполуки;
- Гетероциклічні — містять гетероатоми у складі кільця. Розрізняються за кількістю атомів в циклі, по виду гетероатому, за кількістю гетероатомів в циклі;
- Органічного походження — як правило високомолекулярні сполуки дуже складної структури, часто належать відразу до декількох класів органічних речовин. Через це їх складно класифікувати і їх виділяють в окремий клас речовин;
- Полімери — речовини дуже великої молекулярної маси, які складаються з періодично повторюваних фрагментів — мономерів.
Будова органічних молекул
Органічні молекули в основному утворені ковалентними неполярними зв'язками C-C, або ковалентними полярними типу C-O, C-N, C-Hal. Згідно з октетною теорією Льюїса і Косселя молекула є стійкою, якщо зовнішні електронні оболонки всіх атомів повністю заповнені. Для таких елементів як C, N, O, галогени потрібно 8 електронів, щоб заповнити валентну оболонку, для водню необхідно тільки 2 електрони. Полярність пояснюється зміщенням електронної густини у бік більш електронегативного атома. Класична теорія валентних зв'язків неспроможна пояснити всі типи зв'язків, що існують в органічних сполуках, тому сучасна теорія використовує методи молекулярних орбіталей і квантовохімічні методи.
Будова органічної речовини
Властивості органічних речовин визначаються не тільки будовою їх молекул, але й числом і характером їх взаємодій із сусідніми молекулами, а також взаємним просторовим розташуванням. Найбільш яскраво ці фактори проявляються у відмінності властивостей речовин, що знаходяться в різних агрегатних станах. Так, речовини, які легко взаємодіють у вигляді газу, можуть зовсім не реагувати в твердому стані, або приводять до інших продуктів. У твердих органічних речовинах, в яких найбільш яскраво проявляються ці фактори, розрізняють органічні кристали і аморфні тіла. Їх описом займається наука «хімія органічного твердого тіла», основу якої пов'язують з ім'ям радянського фізика-кристалографа А. І. Китайгородського. Приклади корисних органічних твердих тіл — органічні люмінофори, різноманітні полімери, сенсори, каталізатори, електропровідники, магніти тощо, рідких — рідкі кристали.
Визначення структури органічних сполук
За весь час існування органічної хімії як науки важливим завданням було точно визначити структуру органічних сполук. Тобто точно встановити, які атоми входять до складу сполуки, у якому порядку ці атоми зв'язані між собою і як розташовані в просторі.
Існує кілька методів вирішення цих завдань.
- Елементний аналіз. Полягає в тому, що речовина розкладається на простіші молекули, за кількістю яких можна визначити кількість атомів, що входить до складу сполуки. За допомогою цього методу неможливо встановити порядок зв'язків між атомами. Часто використовується лише для підтвердження припущень структури.
- Інфрачервона спектроскопія і спектроскопія комбінаційного розсіяння (ІЧ-спектроскопія і КР-спектроскопія). Речовина взаємодіє з електромагнітним випромінюванням (світлом) інфрачервоного діапазону (в ІЧ-спектроскопії спостерігають поглинання, в КР-спектроскопії — розсіювання випромінювання). Це світло при поглинанні збуджує коливальні і обертальні рівні молекул. Опорними даними є число, частота та інтенсивність коливань молекули, пов'язаних зі зміною дипольного моменту (ІЧ-спектроскопія) або поляризовності (КР-спектроскопія). Методи дозволяють встановити наявність певних функціональних груп в молекулі. Часто використовуються і для того, щоб підтвердити ідентичність досліджуваної речовини з деякими вже відомими речовинами шляхом порівняння спектрів.
- Мас-спектроскопія. Речовина при певних умовах (електронний удар, хімічна іонізація та ін.) перетворюють на іони без втрати атомів (молекулярні іони) і з втратою (осколкові іони). Дозволяє визначити молекулярну масу і іноді дозволяє встановити наявність різних функціональних груп.
- Метод ядерного магнітного резонансу (ЯМР). Заснований на взаємодії ядер, що володіють власним магнітним моментом (спіном) і поміщених під зовнішнє постійне магнітне поле, з електромагнітним випромінюванням радіочастотного діапазону. Один з головних методів, який може бути використаний для визначення хімічної структури. Метод використовують також для вивчення просторової будови молекул, динаміки молекул. Залежно від ядер, що взаємодіють з випромінюванням розрізняють, наприклад:
- Метод протонного магнітного резонансу (1Н ЯМР). Дозволяє визначити положення атомів водню в молекулі.
- Метод ЯМР 13С. Дозволяє визначити число і типи атомів Карбону в молекулі. Використовується для дослідження форми вуглецевого скелета молекули. На відміну від інших методів ЯМР, в ЯМР 13С використовується неосновний ізотоп елементу, оскільки ядро основного ізотопу Карбону — 12С має нульовий спін і не може спостерігатися методом ядерного магнітного резонансу, так само як і ядро 16O — єдиного природного ізотопу кисню.
- Метод ЯМР 19F. Дозволяє визначити наявність і стан атомів фтору в молекулі.
- Метод ЯМР 31P. Дозволяє визначити наявність, стан і валентний стан атомів фосфору в молекулі.
- Метод ультрафіолетової спектроскопії (УФ-спектроскопія) або Спектроскопія електронних переходів. Метод заснований на поглинанні електромагнітного випромінювання ультрафіолетової і видимої області спектра при переході електронів в молекулі з верхніх заповнених рівнів на вищі незаповнені рівні (збудження молекули). Найчастіше використовується для визначення наявності та характеристик кон'югованих π-систем.
- Методи аналітичної хімії. Дозволяють визначити наявність деяких функціональних груп за специфічними хімічними реакціями, факт протікання яких можна фіксувати візуально або за допомогою інших методів.
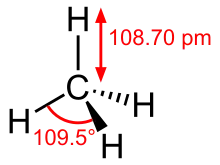
- Рентгеноструктурний аналіз. Цей метод дослідження структури речовини, в основі якого лежить явище дифракції рентгенівського випромінювання на тривимірних кристалічних ґратках, дозволяє визначити точне просторове розташування атомів у молекулі. Цей метод дає найбільше інформації про будову молекули, але для отримання результатів речовина повинна утворювати монокристали, що трапляється досить рідко серед органічних сполук.
Описаних вище методів, як правило, повністю вистачає для визначення структури невідомої речовини.
Фізичні властивості органічних сполук
Для всіх комерційно доступних органічних сполук досліджують їхні кількісні і якісні властивості. До кількісних характеристик належать температура плавлення, температура кипіння та показник заломлення. До якісних характеристик належать запах, консистенція, розчинність і колір.
Характеристики плавлення і кипіння
На відміну від неорганічних сполук, органічні сполуки зазвичай плавляться, багато з них киплять. Раніше температури плавлення і кипіння були ключовими показниками при визначенні речовини і її чистоти. Температури плавлення і кипіння також корелюють з полярністю молекул, їхньою молекулярною масою. Деякі органічні сполуки, особливо симетричні, здатні сублімувати, тобто випаровуватись з твердого стану, без переходу в рідкий. Органічні сполуки не є дуже стійкими при температурах вище 300 °C, хоча існують деякі винятки.
Розчинність
Нейтральні органічні сполуки в основному є гідрофобними, тобто вони краще розчиняються в органічних розчинниках, ніж у воді. До винятків належать органічні сполуки, які здатні іонізуватись, а також низькомолекулярні спирти, аміни та карбоксильні кислоти, які здатні зв'язуватись водневими зв'язками. Органічні сполуки краще розчиняються в органічних розчинниках. Такі розчинники можуть бути як чистою речовиною (наприклад, діетиловий ефір або етиловий спирт), так і сумішшю (наприклад, петролейний ефір). Розчинність в різних розчинниках залежить від типу розчинника, його полярності та наявних функціональних груп.
Властивості в твердому стані
Різноманітні спеціалізовані властивості молекулярних кристалів та органічних полімерів з спряженою π-системою можуть визначатись залежно від застосування цих речовин. Наприклад, визначаються такі термомеханічні та електромеханічні властивості, як п'єзоелектричність, електропровідність, та електрооптичні властивості (наприклад, для нелінійної оптики).
Особливості органічних реакцій
У неорганічних реакціях зазвичай беруть участь іони, реакції проходять швидко і до кінця при кімнатній температурі. В органічних реакціях часто відбуваються розриви ковалентних зв'язків з утворенням нових. Як правило, ці процеси вимагають особливих умов: певної температури, часу реакції, і часто наявності каталізатора. Зазвичай протікає не одна, а відразу кілька реакцій і вихід цільової речовини досить часто не перевищує 50 %. Тому при зображенні органічних реакцій використовують не рівняння, а схеми без розрахунку стехіометрії.
Реакції можуть протікати дуже складним чином і в кілька стадій, не обов'язково так, як реакція умовно зображена на схемі. Як проміжні продукти (інтермедіати) можуть виникати карбокатіони R+, карбаніони R−, радикали R·, карбени CX₂, катіон-радикали, аніон-радикали та інші активні або нестабільні частинки, які зазвичай живуть долі секунди. Детальний опис всіх перетворень, що відбуваються на молекулярному рівні під час реакції, називається механізмом реакції.
Реакції класифікуються залежно від способів розриву і утворення зв'язків, способів збудження реакції, її молекулярності.
Основні типи органічних реакцій
Основними типами кислотно-основних органічних реакцій є:
- реакції нуклеофільного приєднання;
- реакції електрофільного приєднання;
- реакції нуклеофільного заміщення: SN1 та SN2;
- реакції електрофільного заміщення;
- реакції відщеплення (елімінування): E1, E2 та E1cB.
Закономірності вільнорадикальних реакцій за участю органічних молекул є дуже відмінними від кислотно-основних і здебільшого розглядаються в рамках фізичної хімії та хімії високомолекулярних сполук (коли йдеться про радикальну полімеризацію).
Див. також
Література
- ВАК України. Паспорт спеціальності. N 17-09/1 від 29.01.98
- Гупало О. П., Тушницький О. П. Органічна хімія. — К. : Знання, 2010. — 431 с. — ISBN 978-966-346-414-5.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — Л. : Центр Європи, 2006. — 864 с. — ISBN 966-615-235-5.
- Опейда Й., Швайка О. Глосарій термінів з хімії. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0.
- Посібник з органічної хімії / О. Коритко, М. Д. Обушак, С. В. Мідяний, Н. Р. Мотько. - Львів : ЛНАВМ імені С. З. Гжицького, 2005. - 213 с.
- Черних В. П., Гриценко І. С., Єлисєєва Н. М. Органічна хімія. — Х. : Оригінал, 2004. — 464 с. — ISBN 966-615-235-5.
- Штеменко Н. І., Соломко З. П., Авраменко В. І. Органічна хімія та основи статичної біохімії. — Д. : Вид-во ДНУ, 2003. — 644 с. — ISBN 966-551-117-3.
- Беккер Г., Бергер В., Домшке Г. и др. Органикум. — М. : Мир, 1979. — 454+550 с.
- Марч Дж. Органическая химия. — М. : Мир, 1987-1988. — 382+504+458+468 с.
- Пальм В. А. Введение в теоретическую органическую химию. — М. : Высшая школа, 1974. — 446 с.
- Робертс Дж., Касерио М. Основы органической химии. — М. : Мир, 1978. — 840+888 с.
- Clayden J., Greeves N., Warren S., Wothers P. Organic Chemistry. — Oxford University Press, 2012. — ISBN 978-0-19-927029-3.
Посилання
- Органічна хімія // Фармацевтична енциклопедія / голова ред. ради та автор передмови В. П. Черних. — 2-ге вид., переробл. і доповн. — К. : «МОРІОН», 2010. — 1632 с. — ISBN 978-966-2066-34-0.
- (рос.) Іменні реакції в органічній хімії