Гідроксид магнію
Гідрокси́д ма́гнію, ма́гній гідрокси́д — неорганічна сполука складу Mg(OH)2. Білі кристали, які погано розчиняються у воді. Сполука проявляє слабкі осно́вні властивості.
| Гідроксид магнію | |
|---|---|
 | |
| Ідентифікатори | |
| Номер CAS | 1309-42-8 |
| Номер EINECS | 215-170-3 |
| DrugBank | 09104 |
| KEGG | C07876 і D06425 |
| ChEBI | 6637 |
| RTECS | OM3570000 |
| Код ATC | G04BX01 і A02AA04 |
| SMILES |
[OH-].[OH-].[Mg+2][1] |
| InChI |
InChI=1S/Mg.2H2O/h;2*1H2/q+2;;/p-2 |
| Номер Бельштейна | 11342935 |
| Номер Гмеліна | 485572 |
| Властивості | |
| Молекулярна формула | Mg(OH)2 |
| Молярна маса | 58,320 г/моль |
| Зовнішній вигляд | безбарвні кристали |
| Густина | 2,37 г/см³[2] |
| Тпл | 350 °C[2] |
| Розчинність (вода) | 0,00069 г/100 г H2O[3][2] |
| Структура | |
| Кристалічна структура | гексагональна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
–924,7 кДж/моль |
| Ст. ентропія S |
63,18 Дж·моль–1·К-1 |
| Теплоємність, c |
77,11 Дж·моль–1·К-1 |
| Пов'язані речовини | |
| Інші аніони | оксид магнію, хлорид магнію |
| Інші катіони | гідроксид кальцію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Застосовується як препарат для зниження кислотності шлункового соку та як антидот при отруєннях арсеном. Проміжна сполука у синтезі металевого магнію.
Поширення у природі

Мінерали, до складу яких входить гідроксид магнію, є доволі малопоширеними. Серед таких мінералів найбільше значення має брусит. Окрім основної сполуки, Mg(OH)2, в ньому можуть знаходитися домішки MnO, FeO, Fe2O3.[4] Брусит утворюється в результаті гідролізу розчинних у лугах природних сполук магнію.
Також Mg(OH)2 зустрічається у складі мінералу гідромагнезиту, який за складом наближений до суміші гідроксиду та карбонату магнію, — 4MgCO3·Mg(OH)2·2H2O.[5]
Фізичні властивості
Гідроксид магнію є білими кристалами, які погано розчиняються у воді й не проводять струм. Активно осушує повітря шляхом поглинання води і вуглекислого газу. Добре розчиняється в солях амонію.
Отримання
З огляду на малу поширеність гідроксиду магнію у мінеральних покладах, його добувають в інший спосіб. Для потреб промисловості Mg(OH)2 отримують преципітацією морської води та розсолів. Вперше добування гідроксиду з морської води застосували у 1865 році на узбережжі французького Середземномор'я.
В лабораторних у мовах гідроксид магнію можна синтезувати спаленням металевого магнію у парі води:
Також застосовується осадження малорозчинного гідроксиду при взаємодії солей магнію з лугами і гідроксидом амонію.
Однак, осадження за допомогою гідроксиду амонію відбувається неповністю через постійне зменшення іонів OH-.
Хімічні властивості
Гідроксид магнію розкладається при нагріванні понад 350 °C вакуумі і при 800 °C — на повітрі:
Сполука є слабкою основою, взаємодіє з кислотами, солями амонію та кислотними оксидами (активно поглинає з повітря вуглекислий газ):
При нагріванні реагує з деякими неметалами, які в результаті утворюють відповідні гідриди:
Комплексоутворення з неорганічними лігандами для катіону Mg2+ нехарактерне (нестійкі комплекси з оксигеновмісними молекулами відомі для галогенідів магнію[6]), тож в лугах Mg(OH)2 нерозчинний.
Застосування
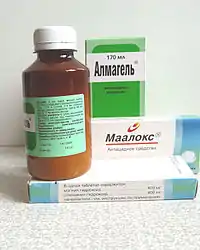
Гідроксид магнію застосовується як проміжна сполука в синтезі металевого магнію. Застосовується для очистки цукру, води у котельнях, у виготовленні зубних паст.
У медицині
Гідроксид магнію широко використовується як антацидний засіб при підвищеній кислотності шлункового соку (при гастритах, виразковій хворобі шлунку та дванадцятипалої кишки). Входить до складу препарату «Маалокс» (акронім від «магній алюміній оксид»), а також його аналогу «Альмагелю», які знижують кислотність.
Нейтралізуючи хлоридну кислоту, що міститься у шлунку, перетворюється на хлорид магнію, який має послаблюючу дію. Застосовується при отруєнні кислотами та сполуками арсену.
Примітки
- 1309-42-8
- За тиску 101,3 кПа
- При 20 °C
- Mineralogical Society of America — Brucite (англ.)
- Mineralogical Society of America — Hydromagnesite (англ.)
- Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. Ч.2. Химия непереходных элементов / Пер. с англ. под ред. Астахова К.В. — М. : Мир, 1969. (рос.)
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — P. ?. — ISBN 0-8493-0486-5.
- Seeger M. Magnesium compounds // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 23. — DOI:
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — С. ?.
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — С. ?.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — С. ?. — ISBN 5-7245-1163-0.
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.?)
- Магния гидроксид // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Сов. энцикл., 1990. — Т. 2 : Даффа реакция — Меди сульфат. — Стб. 1246. — Библиогр. в конце ст. — ISBN 5-85270-035-5.(рос.)
