Період 3 періодичної системи елементів
До третього періоду періодичної системи відносяться елементи третього рядка (або третьої періоду) періодичної системи хімічних елементів. Будова періодичної таблиці заснована на рядках для ілюстрації повторюваних (періодичних) трендів у хімічних властивостях елементів при збільшенні атомного номера: новий рядок починається тоді, коли хімічні властивості повторюються, що означає, що елементи з аналогічними властивостями потрапляють в один і той же вертикальний стовпець. Усі атоми третього періоду періодичної системи мають три електронні оболонки. Зовнішня (третя) електронна оболонка може бути занята від одного до максимально восьми електронів (аргон - [Ne] 3s2 3p6). Таким чином третій період містить 8 хімічних елементів (як і попередній), до нього входять: натрій, магній, алюміній, кремній, фосфор, сірка, хлор і аргон. Перші два з них, натрій і магній, входять до s-блоку періодичної таблиці, тоді як інші відностяться до р-блоку. Слід звернути увагу, що 3d-орбіталі у елементів не заповнені до 4 періоду, що дає періодам таблиці їх характерний вигляд «два рядки в одному».
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Uuh | Uus | Uuo | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| Третій період періодичної системи |
Огляд
Всі елементи третього періоду зустрічаються в природі і мають принаймні один стабільний ізотоп.
Елементи
| Група | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| I | II | III | IV | V | VI | VII | VIII | |||||||||||
| Символ | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||
| Лужні метали | Лужноземельні метали | Лантаноїди | Актиноїди | Перехідні метали | Постперехідні метали | напівметали | Неметали | Галогени | Інертні гази |
Електронні конфігурації
Хімічний елемент Група періодичної системи Електронна конфігурація 11 Na Натрій Лужний метал [Ne] 3s1 12 Mg Магній Лужноземельний метал [Ne] 3s2 13 Al Алюміній Постперехідний метал [Ne] 3s2 3p1 14 Si Кремній Металоїд [Ne] 3s2 3p2 15 P Фосфор Неметал [Ne] 3s2 3p3 16 S Сірка Неметал [Ne] 3s2 3p4 17 Cl Хлор Галоген [Ne] 3s2 3p5 18 Ar Аргон Інертний газ [Ne] 3s2 3p6
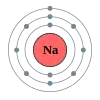
Натрій
.jpg.webp)
Натрій (Na) — лужний метал сріблясто-білого кольору з атомним номером 11, атомною масою 22,98977, що має один стабільний ізотоп 23Na.
Вміст натрію у земній корі 2,64% за масою. Натрій присутній у великих кількостях у світовому океані у формі хлориду натрію. У живих організмах натрій знаходиться більшою частиною зовні клітин (приблизно у 15 разів більше ніж у цитоплазмі). Цю різницю підтримує натрій-калієвий насос, який відкачує натрій, що потрапив всередину клітини. Рекомендована доза натрію становить для дітей від 600 до 1700 міліграмів, для дорослих від 1200 до 2300 міліграмів. У вигляді кухонної солі це становить від 3 до 6 грамів на день.
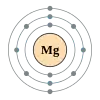
Магній

Магній (Mg) — лужноземельний метал сріблясто-білого кольору з атомним номером 12 і атомною масою 24,305. Має три стабільних ізотопи: 24Mg (78,60%), 25Mg (10,11%), 26Mg (11,29%).
Основна область використання магнію — виробництво магнієвих сплавів. Магній застосовують також для легування сплавів на основі алюмінію, для металотермічного отримання деяких металів (Ti, U, Zr, V та ін.), для розкислення та десульфурації ряду металів і сплавів, у синтезі магнійорганічних з'єднань. Йони магнію знайдені у хлорофілі.
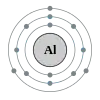
Алюміній

Алюміній (Al) — постперехідний метал сріблясто-білого кольору з атомним номером 13, атомною масою 26,98154, що має один стабільний ізотоп 27Al.
Вміст алюмінію у земній корі 8,8% за масою. За поширеністю у природі він займає четверте місце серед всіх елементів (після кисню, водню і кремнію) та перше серед металів. У вільному вигляді не зустрічається. Алюміній використовують головним чином для отримання алюмінієвих сплавів. Чистий алюміній — конструкційний матеріал у будівництві будинків, у суднобудуванні, для обладнання силових підстанцій і т. д. Застосовують алюміній також для виготовлення кабельних, струмопровідних та інших виробів в електротехніці, корпусів і охолоджувачів діодів, спеціальної хімічної апаратури, товарів народного споживання. Покриття з алюмінію наносять на сталеві вироби для підвищення їх корозійної стійкості.
Кремній
Кремній (Si) — металоїд, напівпровідник з атомним номером 14. Чиста речовина утворює темно-сірі зі смолистим блиском крихкі кристали з гранецентрованою кубічною ґраткою типу алмазу. За новою номенклатурою IUPAC Силіцій належить до групи 14 періодичної системи елементів, за старою — до IV підгрупи основної групи.
Густина кремнію 2,328, tплав 1415 °C, tкип 3250 °C. Твердість за Брінеллем 2,4 ГПа, за Моосом 7. Модуль пружності 109 ГПа. Кремній — напівпровідник, електричні властивості якого сильно залежать від домішок.
При низькій температурі Силіцій хімічно інертний. З багатьма металами утворює силіциди. Вміст у земній корі 27,6% за масою. Солі кремнієвих кислот поширені в природі — мінерали класу природних силікатів. При ізоморфному заміщенні в їхній структурі частини кремнію алюмінієм утворюються алюмосилікати. Відомо понад 400 мінералів, що містять Силіцій. Найважливіші мінерали Силіцію — силікати, кремнезем.
На кремнію виготовляють більшість інтегральних схем.
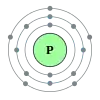
Фосфор

Фосфор (P) — хімічний елемент 15-ї групи (по застарілої класифікації — головної підгрупи п'ятої групи) третього періоду періодичної системи; неметал; має атомний номер 15. Один з поширених елементів земної кори: його зміст становить 0,08-0,09% її маси. Концентрація у морській воді 0,07 мг/л[1]. У вільному стані не зустрічається через високу хімічну активность. Утворює близько 190 мінералів, найважливішими з яких є апатит Ca 5 (PO 4 ) 3 (F, Cl, OH), фосфорит та інші. Фосфор міститься у всіх частинах зелених рослин, ще більше його в плодах і насінні (див. фосфоліпіди). Міститься в тканинах тварин, входить до складу білків та інших найважливіших органічних сполук (АТФ, ДНК), є елементом життя.
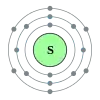
Сірка

Сірка (S) — хімічний елемент VI групи періодичної системи елементів, неметал, атомова вага 32,064; неметал; жовта кристалічна речовина. Досить поширений елемент, на неї припадає близько 0,1% маси земної кори. У природі вона зустрічається як у вільному стані — так звана самородна сірка, але значно частіше сірка зустрічається у зв'язаному вигляді, тобто у вигляді різних сполук. Найважливіші з них — залізний колчедан, або пірит FeS2, цинкова обманка ZnS, свинцевий блиск PbS, мідний блиск Cu2S, гіпс CaSO4 · 2H2O, мірабіліт Na2SO4 · 10H2O тощо.
У невеликих кількостях сірка міститься в кам'яному вугіллі і нафті, а також в усіх рослинних і тваринних організмах, оскільки вона входить до складу білків. Знайдена у двох амінокислотах: цистеїні та метіоніні.
Сірку застосовують переважно у хімічній промисловості для виробництва сірчаної кислоти, синтетичного волокна, сірчистих барвників, димного пороху, у ґумовій промисловості, також у сільському господарстві, фармацевтиці тощо.
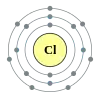
Хлор

Хлор (Cl) — елемент 17-ї групи періодичної таблиці хімічних елементів (за застарілою класифікацією — елемент головної підгрупи VII групи) з атомним номером 17[2]. Позначається символом Cl (лат. Chlorum). Хімічно активний неметал. Входить у групу галогенів (спочатку назву «галоген» використовував німецький хімік Швейгер для хлору [дослівно «галоген» перекладається як солерід], але воно не прижилося, і згодом стало загальним для VII групи елементів, у яку входить і хлор[3]).
Проста речовина хлор (CAS-номер: 7782-50-5) за нормальних умовах — отрйний газ жовтувато-зеленого кольору важчий за повітря, з різким запахом. Молекула хлору двоатомна (формула Cl 2). Використовується як дезинфікуючий засіб, особливо у плавальних басейнах.
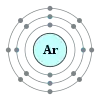
Аргон

Аргон (Ar) є інертним газом, що робить його майже повністю нереакціонноспособним. Лампи розжарювання часто заповнюють інертними газами, у тому числі і аргоном, що оберігає нитки від перегорання при високих температурах.
хімічний елемент з атомним номером 18, а також його проста речовина, інертний газ, без кольору і запаху. Вважається, що він не вступає в реакції з іншими елементами, проте недавно встановлено, що він може з'єднуватися з фторидом бору. Міститься в атмосфері Землі (1 %).
Відноситься до нульової групи періодичної системи елементів, атомна вага 39,944. Природний аргон складається з ізотопів 36Ar (0,337%). 38Ar (0,063%), 40Ar (99,600%); штучно одержано радіоактивні ізотопи 35Ar, 37Ar і 41Ar.
Аргон — безколірний, молекули його одноатомні; t° кип. — 185,83 °C, t° плав.— 189,3 °C, критична температура — 122,4 °C; критичний тиск — 48 атм. В природі аргон зустрічається лише у вільному стані і становить 0,933% (за об'ємом) повітря, з якого вперше його виділили у 1894 році У. Рамзай і Дж. Релей. У промисловості аргон добувають фракціонуванням рідкого повітря.
Примітки
- JP Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- Таблиця Менделєєва Архівовано 17 травня 2008 у Wayback Machine. на сайті ІЮПАК
- Популярная библиотека химических элементов / І. В.Петрянов-Соколов (отв. ред.). — 3-е. — Москва : Видавництво «Наука», 1983. — Т. 1. — С. 238-247.
Література
- Greenwood N. N., Earnshaw A. Chemistry of the Elements. — 2nd. — Oxford : Butterworth-Heinemann, 1997. — 1341 p. — ISBN 0-7506-3365-4. (англ.)
- Cotton F. A., Murillo C. A., Bochmann M. Advanced inorganic chemistry. — 6th — New York: Wiley-Interscience, 1999. — ISBN 0-471-19957-5. (англ.)
- Housecroft C. E., Sharpe, A. G. Inorganic Chemistry. — 3rd. — Prentice Hall, 2008. — ISBN 978-0-13-175553-6. (англ.)
- Ахметов Н. С. Общая и неорганическая химия. — М. : Высшая школа, 2001. — ISBN 5-06-003363-5. (рос.)
- Лидин Р. А. Справочник по общей и неорганической химии. — М. : КолосС, 2008. — ISBN 978-5-9532-0465-1. (рос.)
- Некрасов Б. В. Основы общей и неорганической химии. — М. : Лань, 2004. — ISBN 5-8114-0501-4. (рос.)
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М. : МГУ, 1991, 1994. (рос.)
- Турова Н. Я. Неорганическая химия в таблицах. — М. : Высший химический колледж РАН, 2002. — ISBN 5-88711-168-2. (рос.)