FAS (ген)
FAS (англ. Fas cell surface death receptor), апоптозний антиген 1 (APO-1 або APT), кластер диференціації 95 (CD95) або рецептора фактора некрозу пухлини 6 (TNFRSF6) – білок, який кодується геном FAS.[3][4]
FAS рецептор є рецептором смерті на поверхні клітин, що призводить до запрограмованої загибелі клітин (апоптоз). Це один з двох шляхів апоптозу, інший - мітохондріальний шлях [5]. FasR розташований на 10 хромосомі у людей і на 19 у мишах. Подібні послідовності, пов'язані еволюцією [6], знайдено у більшості ссавців.
Ген
FAS рецептор розташований на довгому плечі 10 хромосоми (10q24.1) у людини і на 19 хромосомі у мишей. Ген лежить на плюсі (ланцюг Уотсона) і становить 25,255 баз в довжину, організованих в дев'ять екзонів, що кодують білок. Кількість варіацій 19764
Білок
Попередні звіти визначили цілих вісім варіантів сплайсингу, які транслюють на сім ізоформ білка. Індукуючий апоптоз FAS рецептор називають ізоформою 1 і він є трансмембранним білком типу 1. Багато інших ізоформ є рідкісними гаплотипами, які зазвичай пов'язані із захворюванням. Однак дві ізоформи, мембранно-пов'язана форма і розчинна форма, що викликають апоптоз, є нормальними продуктами, продукування яких регулюється за допомогою альтернативного сплайсингу цитотоксичним РНК білком-кодуючим TIA1.[7]
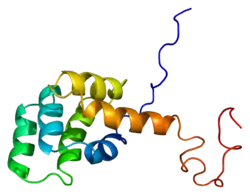
Зрілий білок FAS має 3195 амінокислот, маумолекулярну масу 37732 дальтон і ділиться на 3 домени: позаклітинний домен, трансмембранний домен і цитоплазматичний домен. Позаклітинний домен має 157 амінокислот і багатий залишками цистеїну. Трансмембранні та цитоплазматичні домени мають відповідно 17 і 145 амінокислот. Екзони з 1 по 5 кодують позаклітинну область. Екзон 6 кодує трансмембранну область. Екзони 7-9 кодують внутрішньоклітинні області.
Локалізація
Фенотипні зв'язки між FAS геном та органами
| Шари зародків | |
|---|---|
| Системи | |
| Область |
|
Функції
FAS утворює індукуючий смерть сигнальний комплекс (DISC), після зв'язування ліганду. Мембранно-закріплений FAS -ліганд тример на поверхні сусідньої клітини викликає олігомеризацію FAS. Нещодавні дослідження, які передбачали тримеризацію FAS, не можуть бути підтверджені. Інші моделі запропонували олігомеризацію до 5-7 молекул FAS в DISC.[8] Ця подія також імітується зв'язуванням агоністичного антитіла FAS , хоча деякі дані свідчать про те, що апоптотичний сигнал, індукований антитілом, є ненадійним при дослідженні FAS сигналізації. З цією метою було використано кілька розумних способів тримеризации антитіл для досліджень in vitro.
Після завершення агрегації домену смерті (DD) рецепторний комплекс захоплюється за допомогою клітинного ендосомального механізму. Це дозволяє молекулі адаптеру FADD пов'язувати домен смерті FAS через свій власний домен смерті.[9]
FADD також містить ефектор-домен смерті (DED) поблизу свого аміно-кінця,[10] що полегшує зв'язування з DED FADD-подібного інтерлейкіну-1 бета-перетворюючого ферменту (FLICE), більш часто згадується як каспаза-8. FLICE потім може самоактивуватися за допомогою протеолітичного розщеплення на p10 і p18 субодиниці, дві з яких утворюють активний гетеротетрамерний фермент. Активна каспаза-8 потім вивільняється з DISC в цитозоль, де вона розщеплює інші ефекторні каспази, в кінцевому підсумку призводить до деградації ДНК, мембранного спучування та інших ознак апоптозу.
Нещодавно було показано, що FAS сприяє росту пухлини, оскільки під час прогресування пухлини він часто пригнічується або клітини стають резистентними до апоптозу. Ракові клітини в цілому, незалежно від їх фазової чутливості до апоптозу, залежать від їхньої конститутивної активності FAS. Це стимулюється рак-продукованим FAS-лігандом для оптимального росту.[11]
Хоча було показано, що FAS сприяє росту пухлини у вищезгаданих моделях мишей, аналіз бази даних геноміки раку людини виявив, що FAS значно не посилюється фокусно в наборі даних з 3131 пухлин (FAS не є онкогеном), але значно фокусно видаляється цілий набір даних з цих 3131 пухлин, що свідчить про те, що FAS функціонує як супресор пухлини у людей.
У культивованих клітинах FASL індукує різні типи апоптозу ракових клітин через рецептор FAS. У моделях AOM-DSS-індукованої карциноми товстої кишки і MCA-індукованих сарком мишей було показано, що FAS діє як супресор пухлини.[12] Крім того, рецептор FAS також опосередковує протипухлинну цитотоксичність цитостатичної T-лімфоцитів (CTL), специфічної для пухлини.[13]
Примітки
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- Lichter, P.; Walczak, H.; Weitz, S.; Behrmann, I.; Krammer, P. H. (1992-9). The human APO-1 (APT) antigen maps to 10q23, a region that is syntenic with mouse chromosome 19. Genomics 14 (1). с. 179–180. ISSN 0888-7543. PMID 1385299. Процитовано 9 січня 2019.
- Inazawa, J.; Itoh, N.; Abe, T.; Nagata, S. (1992-11). Assignment of the human Fas antigen gene (Fas) to 10q24.1. Genomics 14 (3). с. 821–822. ISSN 0888-7543. PMID 1385309. Процитовано 9 січня 2019.
- Wajant, Harald (31 травня 2002). The Fas signaling pathway: more than a paradigm. Science (New York, N.Y.) 296 (5573). с. 1635–1636. ISSN 1095-9203. PMID 12040174. doi:10.1126/science.1071553. Процитовано 9 січня 2019.
- Архівована копія. www.orthomam.univ-montp2.fr. Архів оригіналу за 3 березня 2016. Процитовано 9 січня 2019.
- Izquierdo, José María; Majós, Nuria; Bonnal, Sophie; Martínez, Concepción; Castelo, Robert; Guigó, Roderic; Bilbao, Daniel; Valcárcel, Juan (19 серпня 2005). Regulation of Fas alternative splicing by antagonistic effects of TIA-1 and PTB on exon definition. Molecular Cell 19 (4). с. 475–484. ISSN 1097-2765. PMID 16109372. doi:10.1016/j.molcel.2005.06.015. Процитовано 9 січня 2019.
- Wang, Liwei; Yang, Jin Kuk; Kabaleeswaran, Venkataraman; Rice, Amanda J.; Cruz, Anthony C.; Park, Ah Young; Yin, Qian; Damko, Ermelinda та ін. (2010-11). The Fas-FADD death domain complex structure reveals the basis of DISC assembly and disease mutations. Nature Structural & Molecular Biology 17 (11). с. 1324–1329. ISSN 1545-9985. PMC PMC2988912. PMID 20935634. doi:10.1038/nsmb.1920. Процитовано 10 січня 2019.
- Huang, B.; Eberstadt, M.; Olejniczak, E. T.; Meadows, R. P.; Fesik, S. W. (1996 Dec 19-26). NMR structure and mutagenesis of the Fas (APO-1/CD95) death domain. Nature 384 (6610). с. 638–641. ISSN 0028-0836. PMID 8967952. doi:10.1038/384638a0. Процитовано 10 січня 2019.
- Eberstadt, M.; Huang, B.; Chen, Z.; Meadows, R. P.; Ng, S. C.; Zheng, L.; Lenardo, M. J.; Fesik, S. W. (30 квітня 1998). NMR structure and mutagenesis of the FADD (Mort1) death-effector domain. Nature 392 (6679). с. 941–945. ISSN 0028-0836. PMID 9582077. doi:10.1038/31972. Процитовано 10 січня 2019.
- Chen, Lina; Park, Sun-Mi; Tumanov, Alexei V.; Hau, Annika; Sawada, Kenjiro; Feig, Christine; Turner, Jerrold R.; Fu, Yang-Xin та ін. (27 травня 2010). CD95 promotes tumour growth. Nature 465 (7297). с. 492–496. ISSN 1476-4687. PMC PMC2879093. PMID 20505730. doi:10.1038/nature09075. Процитовано 10 січня 2019.
- Liu, Feiyan; Bardhan, Kankana; Yang, Dafeng; Thangaraju, Muthusamy; Ganapathy, Vadivel; Waller, Jennifer L.; Liles, Georgia B.; Lee, Jeffrey R. та ін. (20 липня 2012). NF-κB directly regulates Fas transcription to modulate Fas-mediated apoptosis and tumor suppression. The Journal of Biological Chemistry 287 (30). с. 25530–25540. ISSN 1083-351X. PMC PMC3408167. PMID 22669972. doi:10.1074/jbc.M112.356279. Процитовано 10 січня 2019.
- Yang, Dafeng; Torres, Christina M.; Bardhan, Kankana; Zimmerman, Mary; McGaha, Tracy L.; Liu, Kebin (1 травня 2012). Decitabine and vorinostat cooperate to sensitize colon carcinoma cells to Fas ligand-induced apoptosis in vitro and tumor suppression in vivo. Journal of Immunology (Baltimore, Md.: 1950) 188 (9). с. 4441–4449. ISSN 1550-6606. PMC PMC3398838. PMID 22461695. doi:10.4049/jimmunol.1103035. Процитовано 10 січня 2019.