Ацетамід
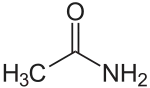
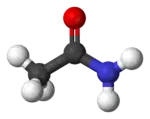
Ацетамі́д — органічна сполука, амід оцтової кислоти. За звичайних умов чистий ацетамід є прозорими, безбарвними кристалами, що повільно випаровуються на повітрі і при дії світла. Може мати сіруватий відтінок за наявності домішок карбонатів. Кристали є дуже гіркими на смак.
| Ацетамід | |
|---|---|
 | |
 | |
| Назва за IUPAC | ацетамід[1] |
| Інші назви | амід оцтової кислоти етанамід |
| Ідентифікатори | |
| Номер CAS | 60-35-5 |
| Номер EINECS | 200-473-5 |
| DrugBank | 02736 |
| KEGG | C06244 |
| ChEBI | 27856 |
| RTECS | AB4025000 |
| SMILES |
CC(=O)N[2] |
| InChI |
InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
| Номер Бельштейна | 1071207 |
| Номер Гмеліна | 1500 |
| Властивості | |
| Молекулярна формула | C2H5NO |
| Молярна маса | 59,067 г/моль |
| Густина | 1,159 г/см³ (при 20 °C) 0,9986 г/см³ (при 85 °C) |
| Тпл | 80,16 °C[3] |
| Ткип | 222,0 °C[3] |
| Розчинність (вода) | 40,8 % (при 20 °C) |
| Діелектрична проникність (ε) | 67,6 |
| Показник заломлення (nD) | 1,4278 |
| Дипольний момент | 3,68±0,03 D |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-317,0 кДж/моль |
| Ст. ентропія S |
115,0 Дж/(моль·K) |
| Теплоємність, c |
91,3 Дж/(моль·K) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Ацетамід застосовується як розчинник і пластифікатор.
Поширення у природі
У надрах Землі ацетамід був знайдений у вугільних териконах Львівсько-Волинського басейну. Новознайдений органічний мінерал мав велику схожість із природним хлоридом амонію (мінерал нашатир), супутником якого він був і, ймовірно, саме через це тривалий час не був розпізнаний як окремий індивід. У 1974 році Міжнародна мінералогічна асоціація затвердила назву ацетамід і для мінеральної форми сполуки.[4]
Поклади мінерального ацетаміду зафіксовані поблизу Червонограда (Львівська область) і Шемокіна (Пенсільванія, США).[5]
Про спостереження ацетаміду у позаземному просторі вперше повідомили у 2006 році. Використовуючи телескоп Грін-Бенк, науковці виявили його у сузір'ї Стрілець B2. На той момент ацетамід був найбільшою із зафіксованих у міжзоряному середовищі сполук із пептидним зв'язком.[6]
У 2015 році в ході місії космічного апарату «Філи» присутність ацетаміду була зафіксована на кометі 67P/Чурюмова—Герасименко. Разом з ним, вперше в історії дослідження комет, також були виявлені метилізоціанат, ацетон та пропаналь.[7]
Фізичні властивості
Ацетамід має дві кристалічні форми — стійку гексагональну і нестійку орторомбічну.
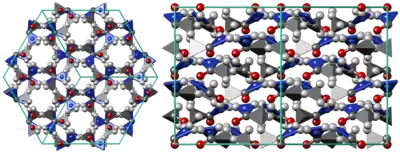
Кристали ацетаміду мають твердість 1—1,5 за шкалою Мооса.
Методом дифракції електронів встановлено, що відстань для пари атомів C—O становить 1,220 Å, а для пари C—N — 1,380 Å.
Отримання
Більшість промислових методів отримання ацетаміду базуються на реакції розкладання (дегідратації) ацетату амонію:
Альтернативним способом є гідратація акрилонітрилу:
Цей метод має певні переваги завдяки низькій ціні вихідного акрилонітрилу, котрий є побічним продуктом окисного амонолізу пропену. Для каталізованого міддю процесу вихід сягає 83 %. Також застосовується біокаталіз бактеріями.
Іншими способами синтезу ацетаміду є реакції ацетилгалогенідів або оцтового ангідриду з аміаком:
Хімічні властивості
Ацетамід легко розчиняється у воді, але гідроліз (до оцтової кислоти) протікає дуже повільно. Сполука демонструє амфотерні властивості — константа кислотності pKa становить 15,1.
Проявляючи кислотні властивості, ацетамід здатен утворювати солі, однак лише при реакції із сильними мінеральними кислотами на кшталт HCl, HBr, HNO3:
При нагріванні з гігроскопічними речовинами, наприклад, з P2O5, молекула втрачає воду й перетворюється на ацетонітрил:
Примітки
- Chapter 5. Constructing Preferred IUPAC Names // IUPAC Provisional Recommendations. — 2004. — P. 50. (англ.)
- acetamide
- За тиску 101,3 кПа.
- Сребродольский Б. И. Ацетамид CH3CONH2 — новый минерал // Записки Российского минералогического общества. — 1975. — Т. 104, вип. 3. — С. 326—328. — ISSN 0869-6055. (рос.)
- Handbook of mineralogy — Acetamide (англ.)
- Hollis, J. M. et al.. Detection Of Acetamide (CH3CONH2): The Largest Interstellar Molecule With A Peptide Bond // The Astrophysical Journal. — 2006. — Т. 643 (23 січня). — С. L25—L28. — DOI:. (англ.)
- Science On The Surface Of A Comet. esa.int. European Space Agency. 30 липня 2015. Архів оригіналу за 24 червня 2017. Процитовано 24 червня 2017. (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Wagner Jr., Frank S. Acetic Acid // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 1. — P. 73. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Cheung, H., Tanke, R. S., Torrence, G. P. Acetic Acid // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 23—24. — DOI: (англ.)
- Краткая химическая энциклопедия / Отв. ред. И. Л. Кнунянц. — М. : Советская энциклопедия, 1961. — Т. 1. А—Е. — 1182 с. (рос.)
- https://www.mindat.org/min-13.html