Карбазол
Карбазол (англ. Carbazole) — ароматична гетероциклічна органічна сполука. Має трициклічну структуру, що складається з двох шестичленних бензенових кілець, сплавлених по обидва боки п'ятичленного азотовмісного кільця. Структура сполуки базується на структурі індолу, але друге бензенове кільце зливається з п'ятичленним кільцем у положенні 2–3 індолу (що еквівалентно подвійному зв'язку 9a — 4a у карбазолі відповідно).
| Карбазол | |
|---|---|
 | |
 | |
 | |
| Інші назви | 9-азафлуорен дибензопіррол дифеніленімін дифеніленеімід USAF EK-600 |
| Ідентифікатори | |
| Номер CAS | 86-74-8 |
| PubChem | 6854 |
| Номер EINECS | 201-696-0 |
| DrugBank | DB07301 |
| KEGG | C08060 |
| ChEBI | 27543 |
| RTECS | FE3150000 |
| SMILES |
c1ccc2c(c1)c3ccccc3[nH]2 |
| InChI |
1/C12H9N/c1-3-7-11-9(5-1)10-6-2-4-8-12(10)13-11/h1-8,13H |
| Номер Бельштейна | 3956 |
| Номер Гмеліна | 102490 |
| Властивості | |
| Молекулярна формула | C12H9N |
| Молярна маса | 167,21 г/моль |
| Густина | 1,301 g см−3 |
| Тпл | 246,3 |
| Небезпеки | |
| ГГС піктограми |   |
| ГГС формулювання небезпек | 341, 351, 400, 411, 413 |
| ГГС запобіжних заходів | 201, 202, 273, 281, 308+313, 391, 405, 501 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Карбазол є складовою частиною тютюнового диму.[1]
Синтез
Класичним лабораторним органічним синтезом карбазолу є циклізація Борше—Дрекселя.[2][3]
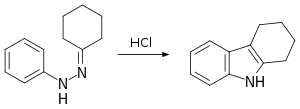
На першому етапі фенілгідразин конденсується з циклогексаноном до відповідного іміну. Другий етап — каталізована соляною кислотою реакція перегрупування та реакція замикання кільця на тетрагідрокарбазол. В одній модифікації обидві стадії з'єднуються в одну, проводячи реакцію в оцтовій кислоті.[4] На третьому етапі ця сполука окислюється червоним суриком до самого карбазолу.
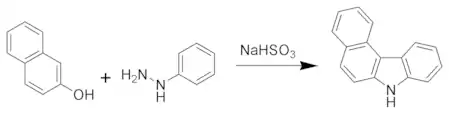
Ще однією класикою є синтез карбазолу Бюхерера, який використовує нафтол та арилгідразин.[5]
Третім методом синтезу карбазолу є реакція Греба–Ульмана.
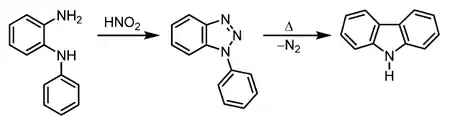
На першому етапі N-феніл-1,2-діамінобензол (N-феніл-о- фенілендіамін) перетворюється в діазонієву сіль, яка миттєво утворює 1,2,3-триазол. Триазол нестійкий, при підвищених температурах з нього виділяється азот і таким чином утворюється карбазол.[6][7]
Застосування
Аміноетилкарбазол використовується у виробництві пігменту фіолетового кольору 23.
Примітки
- Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). Hazardous Compounds in Tobacco Smoke. Int. J. Environ. Res. Public Health 8 (12): 613–628. PMC 3084482. PMID 21556207. doi:10.3390/ijerph8020613.
- W. Borsche (1908). Ueber Tetra- und Hexahydrocarbazolverbindungen und eine neue Carbazolsynthese. (Mitbearbeitet von. A. Witte und W. Bothe.). Justus Liebigs Ann. Chem. (German) 359 (1–2): 49–80. doi:10.1002/jlac.19083590103.
- E. Drechsel (1888). Ueber Elektrolyse des Phenols mit Wechselströmen. J. Prakt. Chem. (нім.) 38 (1): 65–74. doi:10.1002/prac.18880380105.
- Rogers, Crosby U.; Corson, B. B. (1950). 1,2,3,4-Tetrahydrocarbazole (Carbazole, 1,2,3,4-tetrahydro-). Org. Synth. 30: 90. doi:10.15227/orgsyn.030.0090.; Coll. Vol. 4: 884.
- Wang, Zerong (2010). Bucherer Carbazole Synthesis. Comprehensive Organic Name Reactions and Reagents. ISBN 9780470638859. doi:10.1002/9780470638859.conrr120.
- Carl Graebe; Fritz Ullmann (1896). Ueber eine neue Carbazolsynthese. Justus Liebigs Ann. Chem. (German) 291 (1): 16–17. doi:10.1002/jlac.18962910104.
- O. Bremer (1934). Über die Bedeutung der Graebe-Ullmannschen Carbazolsynthese und deren Übertragung auf N-substituierte Pyridino-triazole. Justus Liebigs Ann. Chem. (German) 514 (1): 279–291. doi:10.1002/jlac.19345140116.
