Колоректальний рак
Колоректальний рак (КРР) — злоякісна пухлина товстого кишечника та прямої кишки у людини, що походить з епітеліальних клітин, що вистилають внутрішню поверхню товстої та прямої кишок. КРР — одна з найпоширеніших злоякісних пухлин, що посідає 3 місце за частотою після раку легень, простати або раку молочної залози в залежності від статі хворого. В Україні захворюваність КРР становить ≈37 нових випадків на 100 тис. населення на рік, в інших європейських країнах: найвища розповсюдженість в Чехії (60.3 — чоловіки, 32 — жінки), Угорщині (60 та 35), Словаччині (51 27), Німеччині (45 і 32). Найнижча захворюваність на КРР спостерігається в Греції (17.4 і 14), Румунії (21.1 и 14.3), Литві (25 і 17), Фінляндії (25.2 i 21.2) і Латвії (26 i 19.1).[2]
| Колоректальний рак | |
|---|---|
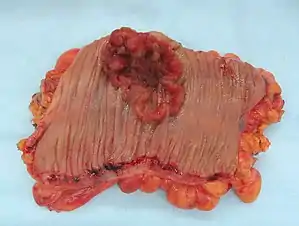 Видалена частина товстої кишки з карциномою (кратероподібне утворення бурого кольору та неправильної форми) Видалена частина товстої кишки з карциномою (кратероподібне утворення бурого кольору та неправильної форми) | |
| Спеціальність | онкологія |
| Метод діагностики | колоноскопія, virtual colonoscopyd, ректороманоскопіяd, Lower gastrointestinal seriesd, КТ, МРТ, позитрон-емісійна томографія, Test RASd і біохімічний аналіз крові |
| Препарати | Іринотекан[1] |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 2B91 |
| МКХ-10 | C18-C20/C21 |
| МКХ-О | M8140/3 (95 % випадків) |
| OMIM | 114500 |
| DiseasesDB | 2975 |
| MedlinePlus | 000262 |
| eMedicine | med/413 med/1994 |
| | |
Класифікація КРР
КРР може виникати як спадкова, спорадична або фамільна форма, кожна з яких має певні особливості.
Спадкова форма
При спадковій формі КРР спостерігається у хворих молодого віку, у родичів яких було діагностовано КРР. При цій формі часто фоновим захворюванням є фамільний аденоматозний поліпоз товстої кишки або спадковий неполіпозний КРР.
Спорадична форма
Спорадичний КРР діагностується за відсутності даних КРР в сімейному анамнезі, часто уражає пацієнтів старших 60 років та являє собою ізольовану пухлину товстої або прямої кишок. При цій формі генетичні аномалії визначаються власне в клітинах пухлини, на відміну від спадкової форми, де мутаціями уражені усі клітини.
Сімейна форма
Концепція сімейної форми КРР була представлена нещодавно. Вважається, що ризик розвитку КРР зростає в два рази, якщо пацієнт має члена родини першого ступеня спорідненості віком менше 50 років з діагнозом КРР. Пацієнти зі сімейною формою КРР мають різні генетичні аномалії: генетичний поліморфізм, модифікатори генів, дефекти тирозинкіназ.
Молекулярно-генетичні аномалії
Генетичні дослідження КРР показали схожі генетичні аномалії при раку товстої та прямої кишок.[3]
КРР — це злоякісна пухлина, що найчастіше виникає в результаті мутацій в генах сигнального шляху Wnt. Ці мутації можуть бути спадковими або спорадичними, та найчастіше виникають в генах клітин інтерстиціальних крипт.[4],[5] Одним з таких генів Wnt є ген APC, що кодує однойменний протеїн APC. Цей протеїн супресує акумуляцію протеїну β-катеніну, що є одним з цетральних компонентів Wnt. Мутований АРС не виконує свою функцію, що призводить до акумуляції β-катеніну та міграції останнього до ядра клітини, зв'язування з ДНК та активацію транскрипції генів, що за нормальних умов регулюють відновлення та диференціацію стовбурових клітин, проте в таких умовах відбувається розвиток раку. У деяких випадках КРР може мати дикий тип APC, але високі рівні β-катеніну внаслідок мутацій в гені, що кодує цей протеїн. Також описані мутації в інших генах-супресорах β-катеніну: AXIN1, AXIN2, TCF7L2, NKD1.[6]
Крім елементів сигнального шляху Wnt, мутації в інших генах також можуть виникати та призводити до КРР. Зокрема, мутації можуть виникати в гені TP53, що кодує білок p53 та регулює процеси клітинного поділу та апоптозу, якщо в клітині виникають дефекти сигнального шляху Wnt. При мутаціях в ТР53, порушується регуляція цих процесів та може бути трансформація аденоми в КРР.[6]
Інші протеїни, що часто деактивовані при КРР є TGF-бета та DCC (Deleted in Colorectal Cancer). TGF-бета деактивується внаслідок мутації, що спостерігається в приблизно 50 % всіх КРР. DCC часто деактивований внаслідок делеції.[7]
При КРР також спостерігається посилена експресія онкогенів: KRAS, C-Raf, та PI3K, що стимулюють проліферацію.[8] Іншим геном, мутації в якому можуть призводити до КРР, є супресор пухлин PTEN, що регулює пригнічення експресії PI3K.[6] При КРР також можуть виникати мутації в гені BRAF.
Патологічна анатомія
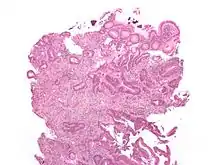
КРР з правого боку товстої кишки (висхідна ободова та сліпа кишки) характеризується екзофітним типом росту — тобто пухлина проростає поза межі стінки кишки в напрямку черевної порожнини. Унаслідок цього правосторонні КРР супроводжуються анемією, але зрідка явищами кишкової непрохідності.
Лівосторонній КРР часто проростає в просвіт товстої кишки та може бути причиною кишкової непрохідності.
КРР — аденокарцинома, тобто епітеліальна пухлина, що походить з залозистого епітелію, що формує мукозний шар стінки товстої кишки. КРР демострує інвазію в стінку кишки, підслизовий шар та м'язовий шар. Клітини КРР мають неправильні тубулярні структури та бідну строму.
Діагноз
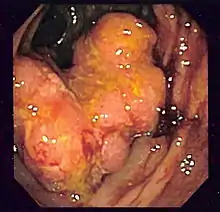
Залежно від місця локалізації КРР та метастатичного поширення пухлини можуть спостерігатись різні симптоми. Класичними симптомами є: закрепи, кров та/або слиз в калі, зменшення калібру стулу, втрата апетиту, втрата маси тіла, нудота, блювання.[9] Також ректальна кровотеча або анемія є частими ознаками КРР, особливо у хворих, старших 50 років, а інші симптоми, включно з утратою ваги та розладами травлення, часто асоціюються з наявністю цього патологічного явища.[10]
Для діагностування КРР застосовуються ендоскопічні методи дослідження: колоноскопія та ректороманоскопія під час яких лікар-ендоскопіст визначає підозріле утворення товстої кишки. Під час ендоскопічного дослідження виконується біопсія підозрілого на КРР утворення з подальшим патогістологічним аналізом біоптату.[11] Менш чутливим методом є пасаж барію з подальшим рентгенологічним дослідженням товстої кишки. Комп'ютерна томографія, МРТ та ПЕТ застосовуються при підозрі наявності віддалених метастазів КРР.
Лікування
Лікування КРР може бути хірургічним, хімієтерапевтичним, променевим або паліативним (при неоперабельних пухлинах та неможливості проведення інших видів лікування). Застосування того чи іншого типу лікування залежить від багатьох факторів, наприклад, віку хворого та загального стану його здоров'я, стадії КРР та операбельності пухлини.[12]
Хірургічне лікування
Більшість хворих з КРР потребує оперативного лікування: видалення карциноми з адекватними краями резекції (видаляється макроскопічно здорова частина кишки з метою профілактики можливого проростання карциноми). Видалення карциноми може бути виконане відкритим доступом (лапаротомія) до товстої кишки або з застосуванням мініінвазивного доступу за допомогою лапароскопічного обладнання. Перед операцією хворому проводять дослідження інших органів черевної та грудної порожнини, зокрема печінки та легень де найчастіше можуть виникати віддалені метастази. Іноді проводиться курс неоад'ювантної (передопераційної) хімієтерапії.[11]
Хімієтерапія
Хімієтерапія при КРР може проводитись до операції (неоад'ювантна) або після (ад'ювантна). Показаннями до проведення хімієтерапії при КРР є наявність метастазів КРР, що не можуть бути видалені хірургічним шляхом або з метою зменшення маси пухлини. Основними хімічними препаратами, що застосовуються для лікування КРР є фторурацил або капецитабін.
Променева терапія
Неоад'ювантна або ад'ювантна променева терапія проводиться в комбінації з хімієтерапією переважно при КРР з локалізацією в прямій кишці. При пухлинах в товстій кишці променева терапія застосовуєтья рідко через ризик ушкодження здорових відділів кишки, що чутливі до радіації.[13]
Паліативне лікування
Паліативне лікування проводиться пацієнтам з неоперабельними карциномами при неможливістю провдення хіміє- або радіотерапії через загальний стан здоров'я. Паліативне лікування направлено на елімінацію болю, виконання колоностомії, видалення пухлини або радіотерапія, стентування при кишковій непрохідності для профілактики ускладнення та забезпечення адекватної якості життя пацієнтів.[14],[15]
Профілактика
Профілактика КРР можлива та нескладна. Зміни стилю життя та харчування дозволяють значно знизити ризик КРР.[16],[17]
Поточні дієтичні дослідження показали, що збільшення споживання фруктів та овочів, а також зменшення червоного м'яса в раціоні знижує ризик розвитку КРР.[18] Регулярна фізична активність також розглядається як фактор зниження ризику утворення КРР.[19]
Примітки
- Inxight: Drugs Database
- С.М. Ткач, А.Ю. Иоффе (червень 2005). Колоректальний рак: поширеність, головні чинники ризику та сучасні підходи до профілактики. Український терапевтичний журнал 2: 83–88. Bibcode:616.348/.35_006.6_036.2_084 УДК 616.348/.35_006.6_036.2_084.
- Cancer Genome Atlas Network (19 липня 2012). Comprehensive molecular characterization of human colon and rectal cancer. Nature 487 (7407): 330–337. Bibcode:2012Natur.487..330T. PMC 3401966. PMID 22810696. doi:10.1038/nature11252.
- Ionov Y, Peinado MA, Malkhosyan S, Shibata D, Perucho M (1993). Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis. Nature 363 (6429): 558–61. PMID 8505985. doi:10.1038/363558a0.
- Srikumar Chakravarthi, Baba Krishnan, Malathy Madhavan (1999). Apoptosis and expression of p53 in colorectal neoplasms. Indian J Med Res 86 (7): 95–102.
- Markowitz SD, Bertagnolli MM (December 2009). Molecular Origins of Cancer: Molecular Basis of Colorectal Cancer. N. Engl. J. Med. 361 (25): 2449–60. PMC 2843693. PMID 20018966. doi:10.1056/NEJMra0804588.
- Mehlen P, Fearon ER (August 2004). Role of the dependence receptor DCC in colorectal cancer pathogenesis. J. Clin. Oncol. 22 (16): 3420–8. PMID 15310786. doi:10.1200/JCO.2004.02.019.
- Vogelstein, B; Kinzler, KW (2004). Cancer genes and the pathways they control. Nature Medicine 10 (8): 789–99. PMID 15286780. doi:10.1038/nm1087.
- al.], edited by Tadataka Yamada ; associate editors, David H. Alpers ... [et (2008). Principles of clinical gastroenterology. Chichester, West Sussex: Wiley-Blackwell. с. 381. ISBN 978-1-4051-6910-3.
- Adelstein BA, Macaskill, P, Chan, SF, Katelaris, PH, Irwig, L (2011). Most bowel cancer symptoms do not indicate colorectal cancer and polyps: a systematic review. BMC gastroenterology 11: 65. PMC 3120795. PMID 21624112. doi:10.1186/1471-230X-11-65.
- Cunningham D, Atkin W, Lenz HJ, Lynch HT, Minsky B, Nordlinger B, Starling N (2010). Colorectal cancer. Lancet 375 (9719): 1030–47. PMID 20304247. doi:10.1016/S0140-6736(10)60353-4.
- Stein A, Atanackovic, D, Bokemeyer, C (Sep 2011). Current standards and new trends in the primary treatment of colorectal cancer. European journal of cancer (Oxford, England : 1990). 47 Suppl 3: S312–4. PMID 21943995. doi:10.1016/S0959-8049(11)70183-6.
- authors, editors, Vincent T. DeVita, Jr., Theodore S. Lawrence, Steven A. Rosenberg ; associate scientific advisors, Robert A. Weinberg, Ronald A. DePinho ; with 421 contributing (2008). DeVita, Hellman, and Rosenberg's cancer : principles & practice of oncology (вид. 8th). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. с. 1258. ISBN 978-0-7817-7207-5.
- Wasserberg N, Kaufman HS (December 2007). Palliation of colorectal cancer. Surg Oncol 16 (4): 299–310. PMID 17913495. doi:10.1016/j.suronc.2007.08.008.
- Amersi F, Stamos MJ, Ko CY (July 2004). Palliative care for colorectal cancer. Surg. Oncol. Clin. N. Am. 13 (3): 467–77. PMID 15236729. doi:10.1016/j.soc.2004.03.002.
- Searke, David (2006). Cancer Epidemiology and Prevention (вид. 3). Oxford University Press. с. 809. ISBN 9780199747979.
- Rennert, Gad (2007). Cancer Prevention. Springer. с. 179. ISBN 9783540376965.
- Campos FG, Logullo Waitzberg, AG, Kiss, DR, Waitzberg, DL, Habr-Gama, A, Gama-Rodrigues, J (Jan 2005). Diet and colorectal cancer: current evidence for etiology and prevention. Nutricion hospitalaria : organo oficial de la Sociedad Espanola de Nutricion Parenteral y Enteral 20 (1): 18–25. PMID 15762416.
- Harriss DJ, Atkinson, G, Batterham, A, George, K, Cable, NT, Reilly, T, Haboubi, N, Renehan, AG, Colorectal Cancer, Lifestyle, Exercise And Research, Group (Sep 2009). Lifestyle factors and colorectal cancer risk (2): a systematic review and meta-analysis of associations with leisure-time physical activity. Colorectal disease : the official journal of the Association of Coloproctology of Great Britain and Ireland 11 (7): 689–701. PMID 19207713. doi:10.1111/j.1463-1318.2009.01767.x.
Посилання
| 1. Як виникає рак і як його лікувати - все про лікування онкології // Канал Tokar.ua українською» на YouTube, 26 серпня 2020. | |