Хімія
Хі́мія або хе́мія[1][2][3] — одна з наук про природу, яка вивчає молекулярно-атомні перетворення речовин, тобто, при яких молекули одних речовин руйнуються, а на їхньому місці утворюються молекули інших речовин з новими властивостями.

Завданням хімії є дослідження властивостей елементів і хімічних сполук, вивчення залежності властивостей речовин від їхнього складу й будови, вивчення умов перетворення одних речовин в інші, поширення хімічних речовин у природі, технологій їхнього одержання, механізмів взаємодії хімічних сполук, а також практичне використання хімічних реакцій.
Походження назви
Поширеною є думка, що назва «хімія» пішла від араб. کيمياء. У свою чергу припускають, що це арабське слово пішло від єгипетського Chemi чи Kimi (стародавня назва Єгипту), що означало «чорний» та згодом було запозичене греками. Згодом, коли Єгипет було захоплено арабами, останні запозичили це слово. Згідно з міркуваннями грецьких фахівців, слово хімія походить від χύμα і χυμεύειν. Запис Χυμεία вперше з'являється у творі З. Панополітського «Eπι της δυνάμεως και της συστάσεως των υδάτων». У грецькій бібліографії термін хімія та його похідні писали з υ [y] до 1828 р., а зараз роблять спроби відновити правильне історичне написання[4][5].
Розділи хімії
- Загальна хімія — вивчає теоретичні основи системи знань про речовину і хімічні перетворення.
- Неорганічна хімія — вивчає речовини неорганічної природи і властивості хімічних елементів.
- Органічна хімія — вивчає речовини органічної природи — сполуки Карбону.
- Аналітична хімія — вивчає принципи і методи визначення хімічного складу речовини.
- Трансфазна хімія — вивчає реакції в гетерогенних системах (тверда-рідка чи рідка-рідка), які відбуваються з участю невеликої кількості агента, що переносить реактанти з однієї фази через поверхню поділу в іншу, де йде реакція.
- Хемометрика — розділ аналітичної хімії, що отримує хімічні дані з допомогою математичних методів обробки даних.
- Фізична хімія — вивчає хімічні явища та процеси на основі загальних принципів фізики з використанням фізичних експериментальних методів.
- Електрохімія — вивчає властивості систем, що містять іонні провідники, та перетворення речовин на межі поділу фаз за участю заряджених часток.
- магнетоелектрохімія — розділ електрохімії, де вивчаються явища та процеси, що відбуваються під впливом магнітного поля.
- Радіохімія — вивчає хімічні та фізико-хімічні властивості радіоактивних елементів і речовин.
- Колоїдна хімія — вивчає дисперсні системи та поверхневі явища на межі поділу фаз.
- Механохімія — вивчає хімічні та фізико-хімічні перетворення при механічній дії на речовину
- Електрохімія — вивчає властивості систем, що містять іонні провідники, та перетворення речовин на межі поділу фаз за участю заряджених часток.
- Біологічна хімія (біохімія) — фундаментальна біомедична наука та навчальна дисципліна, що вивчає хімічний склад живих організмів та хімічні перетворення, яким підлягають молекули, що входять до їхнього складу.
- Біоорганічна хімія — наука, що вивчає хімічну структуру і властивості органічних сполук вуглецю, які входять до складу живих організмів і є основою будови і функції живих клітин. Розглядає закономірності будови і реакцій основних класів вуглецевих сполук у зв'язку з їхніми біологічними функціями та впливом на процеси, що відбуваються в біологічних системах.
- Фармацевтична хімія — наука, що вивчає способи добування, будову та фізико-хімічні властивості лікарських засобів; взаємозв'язок між їхньою хімічною будовою та дією на організм; методи контролю якості та зміни, які відбуваються за збереження ліків та застосування їх у медицині.
- Клінічна біохімія — це клініко-діагностична наука, в задачі якої входять розробка і використання стандартних методів діагностики, контролю над перебігом захворювання з позиції біохімії.
- Токсикологічна хімія — наука, що вивчає методи виділення токсикологічних речовин з різноманітних об'єктів, а також методи виявлення та кількісного визначення цих речовин.
- Теоретична хімія — розділ хімії, що використовує методи фізики для передбачення хімічних явищ.
- Квантова хімія — галузь науки, яка використовує засади квантової механіки для чисельних розрахунків структур та властивостей хімічних молекул.
- Комп'ютерна хімія
- Математична хімія — галузь науки, яка використовує математичне моделювання до хімічних явищ.
- Обчислювальна хімія — галузь науки, яка використовує принципи інформатики для розв'язку хімічних задач.
- Хемоінформатика — галузь науки, яка має на меті застосування комп'ютера та інформатики для вирішення проблем хімії.
- Молекулярна динаміка — комп'ютерне моделювання руху атомів і молекул у газах, рідинах та твердих тілах.
- Молекулярна механіка — галузь науки, яка використовує класичну механіку для моделювання молекулярних систем.
- Спектрохімія — область хімії, в якій вивчається взаємодія електромагнітного випромінення з речовиною, коли ця взаємодія не викликає хімічних змін речовини.
- Кріохімія — роздiл хімiї, де вивчаються закономiрностi перебігу хімiчних реакцiй при низьких (70—223 К) та наднизьких (нижче70 К) температурах.
- Геохімія — вивчає хімічний склад Землі і закони поширення, поєднання і руху атомів хімічних елементів та їхніх стабільних ізотопів у різних оболонках земної кулі.
- Топохімія — вивчає будову поверхні кристалічних речовин на атомно-молекулярному рівні, реакції на поверхні кристалів, процеси асоціації та дисоціації молекул.
- Супрамолекулярна хімія — міждисциплінарна галузь хімії, що зосереджується на вивчені хімічних систем, що складаються з певної визначеної кількості молекулярних блоків чи компонентів.
- Нанохімія — розділ хімії, де об'єктами вивчення є тіла, розмір яких лежить у діапазоні 1-100 нм., де фізичні і хімічні властивості тіл суттєво залежать від розміру, досліджує склад і структуру нанотіл.
- Комбінаторна хімія — галузь хімічної науки, мета якої полягає у швидкому синтезі або комп'ютерній генерації різних, проте структурно споріднених, біологічно активних сполук або матеріалів та високопродуктивному біологічному скринінгу одержаних речовин.
- Фемтохімія — розділ хімії, який вивчає хімічні процеси у часовому діапазоні 10−15—10−12 секунди.
- Теорія вибухових речовин — розділ хімії, який вивчає хімічні процеси під час вибуху ВР.
- Агрохімія — галузь науки, яка вивчає біохімічні процеси та колообіг речовин у системі ґрунт — рослина — добрива.
- Екологічна хімія — наука про хімічні процеси та взаємодії в довкіллі (екосфері).
- Медична хімія
- Структурна хімія
- Термоелектрохімія
- Ядерна хімія
- Хімія харчових продуктів — вивчає хімічні процеси та взаємодії всіх біологічних та небіологічних компонентів харчових продуктів.
Основні поняття
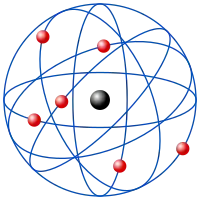
Атом
Атом — базове поняття хімії, це найменша частинка хімічного елемента, яка зберігає всі його хімічні властивості. Атом складається з щільного ядра з позитивно заряджених протонів та електрично нейтральних нейтронів, яке оточене набагато більшою хмарою негативно заряджених електронів. Коли число протонів відповідає числу електронів, атом електрично нейтральний; в іншому випадку це є іон, з певним зарядом. Атоми класифікують відповідно до числа протонів та нейтронів: число протонів визначає хімічний елемент, а число нейтронів визначає нуклід елемента.
Хімічний елемент
- Див. також Періодична система елементів
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Хімічний елемент — тип (вид, сорт) атомів з однаковим зарядом атомних ядер (тобто однаковою кількістю протонів в ядрі атому) і певною сукупністю властивостей, але маса ядра атому хімічного елемента може бути різною, в залежності від кількості нейтронів в ньому. Сукупність атомів елемента з однаковою масою називається нуклідом, а ізотопами називаються атоми одного елемента з різними масами. Атоми даного хімічного елемента відрізняються від атомів інших елементів величиною заряду ядра атома, кількістю та характером розміщення електронів навколо ядра, розмірами і хімічними властивостями. У нейтрального атома число електронів на електронних оболонках дорівнює заряду ядра.
Хімічна речовина

Речовина́ — вид матерії, яка на відміну від поля, характеризується масою та складається з елементарних частинок (електронів, протонів, нейтронів, мезонів тощо). Характерною властивістю таких частинок є відмінні від нуля баріонний заряд або лептонний заряд. Терміном хімічна речовина позначають головним чином матерію речовину організовану в атоми, молекули тощо.[6] Вся різноманітність фізичних та хімічних властивостей речовин зумовлюється взаємодією між електронами та атомними ядрами, а також між атомами, молекулами, йонами. Хімічні речовини, що складаються з атомів одного виду, є простими, з атомів різних видів — складними. Складні хімічні речовини розділяються на органічні і неорганічні.
Проста речовина
Прості речовини — речовини молекули яких складаються з атомів одного і того самого хімічного елемента. Наприклад, до простих речовин належать водень, азот, хлор та інші, бо молекули водню H2 складаються тільки з атомів водню (гідрогену), молекули азоту N2 — тільки з атомів азоту (нітрогену), молекули хлору Cl2 — тільки з атомів хлору. Молекули деяких простих речовин складаються тільки з одного атома. Наприклад, молекули гелію і аргону складаються з одного атома гелію — He та аргону — Ar. Молекули всіх інших інертних газів теж складаються з одного атома.
Складна речовина
Хімічна сполука є речовиною, молекули якої складаються з атомів двох або більше хімічних елементів сполучених між собою тим чи іншим типом хімічного зв'язку, на відміну від простих речовин. Зазвичай це молекула, яка може визначатися певною хімічною формулою. Складних речовин незрівнянно більше, ніж простих. Якщо простих речовин тепер відомо понад 400, то складних речовин в неорганічній хімії — понад 50 тис., а в органічній хімії — близько 3 млн.
Молекула
Моле́кула (новолат. molecula, зменшувально від лат. moles — маса) — здатна до самостійного існування найменша частинка простої або складної речовини, що має її основні хімічні властивості, які визначаються її складом та будовою. Молекула складається з атомів, а якщо точніше, то з атомних ядер, оточених певним числом внутрішніх електронів, та зовнішніх валентних електронів, які утворюють хімічні зв'язки. Внутрішні електрони атомів, зазвичай, не беруть участі в утворенні хімічних зв'язків. Склад та будова молекул речовини не залежать від способу її отримання. У випадку одноатомних молекул (наприклад, інертних газів) поняття молекули й атома збігаються.
Хімічний зв'язок
Хімічнний зв'язок — це взаємодія між атомами, яка утримує їх у молекулі чи твердому тілі. Хімічний зв'язок є результатом складної взаємодії електронів та ядер атомів і описуються квантовою механікою.
Кількість речовини
Кількість речови́ни — фізична величина, що характеризує кількість однотипних структурних одиниць (часток). Під структурними одиницями розуміються будь-які частки, з яких складається речовина (атоми, молекули, іони, електрони або будь-які інші частки). В міжнародній системі одиниць SI кількість речовини поряд з масою (яка теж фактично корелює з кількістю частинок) належить до основних одиниць окремого типу[7]. Таким чином, кількість речовини в системі SI не може бути виражена через інші базові одиниці. Одиниця кількості речовини називається моль. Моль дорівнює кількості речовини системи, яка містить стільки ж частинок, скільки міститься атомів у 0,012 кг вуглецю-12.
Хімічні властивості
Хімічні властивості — властивості речовин, що стосуються хімічних процесів, тобто це такі властивості, які проявляються в ході хімічної реакції. До хімічних властивостей відноситься здатність реагувати з іншими речовинами, а також схильність до розкладу. Хімічні властивості речовини залежать не лише від кількісного та якісного складу, тобто з яких і скількох атомів хімічних елементів вона складається, але й від хімічної структури молекул речовини (структура ізомерія) та від просторової конфігурації молекул (конформація та стереоізомерія).
Хімічні реакції

Хімічна реакція, або хімічне перетворення — це перетворення речовин, при якому молекули одних речовин руйнуються і на їхньому місці утворюються молекули інших речовин з іншим атомним складом. Хімічні реакції можна зображувати хімічними рівняннями. Реакції супроводжуються розривом старих та утворенням нових хімічних зв'язків.
Рівновага
Хімічна рівновага — це термодинамічна рівновага у відкритих системах, коли кількість молів кожного з компонентів, що складають систему, залишається незмінною. Такої рівноваги системи набуває, коли швидкість прямої реакції дорівнює швидкості зворотної реакції.
Енергія
Хімічні закони
- закон збереження маси речовини,
- закон збереження енергії,
- закон Авогадро,
- закон діючих мас,
- закон сталості складу,
- закон об'ємних відношень газів,
- закон кратних відношень
та інші.
Термодинамічна фаза
Термодинамі́чна фа́за — термодинамічно рівноважний стан речовини, відмінний за своїми фізичними властивостями від інших станів тієї ж речовини. Різні фази мають різні упаковки молекул (для кристалічних фаз, різні кристалічні ґратки), і, отже, різні значення коефіцієнта стисливості, коефіцієнта теплового розширення та інші сприйнятливості. Крім того, різні фази можуть мати різні електричні (сегнетоелектрики), магнітні (феромагнетики), та оптичні властивості (наприклад, твердий кисень).
Зелена хімія
Зелена хімія — це філософія хімічних досліджень та інженерії, що закликає до створення продуктів та процесів, які дозволять мінімізувати використання та виробництво шкідливих речовин, які забруднюють навколишнє середовище. Метою зеленої хімії є зменшення забруднення та його запобігання вже на початку планування хімічних технологій тощо. Важливими принципами зеленої хімії є принцип економії атомів та проведення хімічних реакцій у воді для зменшення використання органічних розчинників.
Історія хімії
Нобелівська премія з хімії
Нобелівська премія — це найвища нагорода в області хімії, яка присвоюється щорічно з 1901 року Шведською королівською академією наук в Стокгольмі. Всього з 1901 по 2011 рік Нобелівську премію отримали 160 осіб. Єдиним хіміком, котрий отримав дві Нобелівські премії з хімії (в 1958 та 1980 роках) був Фредерік Сенгер. Ще двоє отримали по дві Нобелівські премії з різних дисциплін — Марія Кюрі (з фізики в 1903 році та з хімії в 1911 році) та Лайнус Полінг (з хімії в 1954 році та миру в 1962 році).[8] За всю історію вручення Нобелівської премії, її отримали тільки 4 жінки: Марія Кюрі, Ірен Жоліо-Кюрі, Дороті Ходжкін та Ада Йонат.[9]
Хімія в Україні

- Див. також Українські хіміки
Практичне застосування хімічних знань відоме в Україні здавна, воно було пов'язане з виготовленням і використанням металів, їхніх сплавів, емалей, пороху тощо. Значну роль у розвитку хімічних наук за нових часів в Україні мали наукові товариства природознавців, які існували в Харкові, Києві та Одесі. Математично-природописно-лікарська секція НТШ у Львові з 1897 видавала збірки, в яких були статті з хімії та української хімічної термінології.

Перші наукові дослідження з хімії провадилися на початку XIX століття в Харківському університеті (Василь Каразін, Фердинанд Гізе). Там таки у 1864—1887 роках Микола Бекетов вивчав термохімію та теорію розчинів, а пізніше його учні та співробітники досліджували кінетику реакцій, адсорбцію, топохімічний та молекулярний поліморфізм. Важливі також праці Миколи Ізмайлова з теорії кислот та основ і електролітів. Визначними вченими у Харківському університеті були Олександр Данилевський (фізіологічна хімія) та Володимир Палладін (біохімія), а досліди з органічної хімії провадили Олександр Ельтеков і Костянтин Красуський. Перший підручник фізіологічної хімії Олексія Ходнєва з Харківського університету вийшов 1847 року.
У Київському університеті важливі досліди над дисоціацією молекул провадив у 1879–1884 роках Микола Миколайович Каяндер, також Я. Михайленко (термодинаміка розчинів) та О. Сперанський (теорія розчинів, 1905—1919). Праці з колоїдної хімії провадив Ілля Григорович Борщов від 1869 року. Широко розвинув цю галузь хімії Антон Володимирович Думанський, який 1912 року почав викладати в Київському університеті колоїдну хімію та видав тоді монументальну монографію про колоїдні розчини. У ділянці органічної хімії в Київському університеті працювали Петро Петрович Алексєєв і Микола Андрійович Бунге та світової слави Сергій Миколайович Реформатський, який відкрив реакцію утворення β-гідроксикислот при допомозі цинк-органічних сполук, що згодом стала носити його ім'я (реакція Реформатського). У 1867–1889 роках Володимир Олександрович Кістяковський працював у галузі біохімії над обміном вуглеводів, зокрема глікогену.
У 1850–1860-их роках у Львівському університеті досліди з органічної та аналітичної хімії провадив Л. Пебаль. У 1872—1910 роках В. Радзішевський досліджував різні питання загальної та фармацевтичної хімії; важливі також праці з фізичної хімії С. Толлочка в 1905—1935 роках, а з органічної хімії — Віктора Кемули і Е. Ліннемана.
В Одеському університеті наприкінці XIX — на початку XX століття праці з органічної хімії провадили Петро Григорович Мелікішвілі, пізніше Микола Дмитрович Зелінський, з колоїдної хімії Ф. Шведов, з фізичної хімії — О. Саханов (електрохімія неводних розчинів), А. Рабинович (аномалія провідности), О. Фрумкін (електрокапілярні явища) і Л. Писаржевський (пероксиди та надкислоти). Цей останній, працюючи в 1913—1934 роках у Дніпрі, заснував там Інститут фізичної хімії і створив основи електронної хімії і каталізу. Визначним українським біохіміком у Віденському університеті наприкінці XIX століття був І. Горбачевський, який 1882 року синтезував сечову кислоту з сечовини та гліцину.
Радянський період
По революції рівень і розвиток хімічних наук був не однаковий. Більшість наукових праць велася далі в університетах та політехнічних інститутах, хоч пізніше роль основних дослідів з хімії перебрали новозасновані інститути АН УРСР, які нині й репрезентують найвищий рівень хімічної науки в Україні. Вони диспонують більшими засобами для наукової праці і співпрацюють з університетами, політехнічними інститутами та іншими дослідними осередками, подекуди координуючи їхню працю у визначених завданнях.
Див. також
- Хімічна промисловість
- Періодична система
- Алфавітний список хімічних елементів
- Закон збереження маси речовини
- Закон сталості складу
- Палегеохімія
- Бази даних з хімії
Примітки
- chemistry // Англійсько-українсько-англійський словник наукової мови (фізика та споріднені науки). Частина І англійсько-українська / уклад. О. Кочерга, Є. Мейнарович. — 2010.
- хемія // Англійсько-українсько-англійський словник наукової мови (фізика та споріднені науки). Частина ІІ українсько-англійська / уклад. О. Кочерга, Є. Мейнарович. — 2010.
- хемія // Українсько-англійський словник з радіоелектроніки / Богдан Рицар, Леонід Сніцарук, Роман Мисак. — 2015.
- Σαραντόπουλος Π. Παιχνίδια, ιστορικές πληροφορίες και αναλογίες στη διδακτική της χημείας, με έμφαση στις αναλογίες με εντόνο κοινωνικό περιεχόμενο: επίπτωσεις στη διδακτική πράξη, στη στάση των μαθητών και στη μάθηση (Using chemical games, historical information and analogies with a strong social content in chemistry teaching: effects on learning and on the attitude of students): PhD thesis / Παναγιώτης Σαραντόπουλος. — University of Ioannina, Greece, 1997.
- Вакуленко М. О. Українська термінологія: комплексний лінгвістичний аналіз: [монографія] / М. О. Вакуленко. — Івано-Франківськ: Фоліант, 2015. — 361 с., іл. {https://drive.google.com/file/d/0Bw44-ZBHniK_Q3luUEprNXhHcWc/view?usp=sharing}
- www.xumuk.ru
- Рішенням XIV Генеральної конференції з мір і вагів (1971 р.) одиниця кількості речовини «моль» була затверджена як сьома основна одиниця Міжнародної системи.
- Nobel Laureates Facts. Nobelprize.org. Архів оригіналу за 12 травня 2013. Процитовано 4 лютого 2012.
- Women Nobel Laureates. Nobelprize.org. Архів оригіналу за 12 травня 2013. Процитовано 4 лютого 2012.
Література
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім.. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Турченко Я. Основные пути развития общей неорганической и физической химии на Украине. К. 1957.
- Розвиток науки в Українській РСР за 40 pp. K. 1957.
- Історія Київського Університету. Видавництво Київського Університету. К. 1959.
- Історія Академії Наук УРСР. К. 1967.
- Академія Наук УРСР. К. 1969.
- Енциклопедія українознавства : Словникова частина : [в 11 т.] / Наукове товариство імені Шевченка ; гол. ред. проф., д-р Володимир Кубійович. — Париж—Нью-Йорк : Молоде життя, 1955—1995.
- Вакуленко М. О. Українська термінологія: комплексний лінгвістичний аналіз: [монографія] / М. О. Вакуленко. — Івано-Франківськ: Фоліант, 2015. — 361 с., іл.
- Опейда Й. О. Математичне та комп'ютерне моделювання в хімії: підручник / Й. О. Опейда. — Вінниця: ДонНУ, 2015. — 388 с.
Посилання
- (рос.) Віртуальна хімічна лабораторія.
- (рос.) «Химия и Жизнь» — сайт російського наукового журналу про хімію та її застосування в господарстві та житті.
- (рос.) Бібліотека науково-навчальної літератури хімічного факультету Московського державного університету.
- (рос.) «Химики и химия» — офіційний сайт журналу хіміків-ентузіастів.