Легенева гіпертензія
Легене́ва гіперте́нзія— в найпростішому значенні, охоплює будь-яке підвищення кров'яного тиску в легеневій артерії, вище звичайного. Наявність ЛГ відбиває наявність серйозних патологічних змін (захворювань) судин легень, що прогресує, або є наслідком підвищення тиску в легеневій артерії у відповідь на підвищення тиску в лівих відділах серця. Сьогодні (початок XXI ст.), серед лікарів, ЛГ розглядається як гемодинамічна патологія, загальна для різноманітних патологічних станів людини, що характеризуються підвищеним післянавантаженням та роботою правого шлуночку серця. Клінічні прояви захворювання, його перебіг та оборотність ЛГ залежить в першу чергу від ступеня ураженості легеневих судин, етіології та тяжкості гемодинамічних розладів.[7]
| Легенева гіпертензія | |
|---|---|
 Анатомія легеневих судин Анатомія легеневих судин | |
| Спеціальність | кардіологія |
| Препарати | bosentand[1], alprostadild[1], treprostinild[1][2], нітрогліцерин (лікарський засіб)[1], hydralazined[1], epoprostenold[2], macitentand[2], Тіотропію бромід[2], (5E)-5-[(3aS,5R,6aS)-5-Hydroxy-4-[(1E,3S)-3-hydroxy-4-methyl-1-octen-6-yn-1-yl]hexahydro-2(1H)-pentalenylidene]pentanoic acid[2], Тадалафіл[2], bosentan hydrated[2], riociguatd[2], selexipagd[2], Силденафіл[2], ambrisentand[2], Силденафіл[3], ambrisentand[4], macitentand[5] і riociguatd[6] |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | BB01 |
| МКХ-10 | I27.0I27.2 |
| DiseasesDB | 10998 |
| MedlinePlus | 000112 |
| eMedicine | radio/583 |
| MeSH | D006976 |
| | |
У людини, що перебуває в стані спокою, ЛГ визначається при тиску в легеневій артерії, що дорівнює 25 mm Hg або вище. Під час фізичного навантаження ЛГ визначається при тиску в легеневій артерії, що дорівнює 30 mm Hg або вище.[8]
Історія
У 1865 році німецький дослідник Юліус Клоб (Julius Klob) звітував про знахідки при аутопсії пацієнта, що мав збільшувані набряки, задишку та ціаноз, що в результаті призвело до його смерті у віці 59 років. Замість серцевої патології, Клоб знайшов виражене звуження дрібних гілок легеневої артерії, що були вражені атеросклерозом[9].
У 1891 році видатний німецький лікар Ернст фон Ромберґ (Ernst von Romberg) описав схожу клінічну картину у чоловіка 24 років. При аутопсії пацієнта окрім склерозу легеневих судин було виявлено виражену гіпертрофію правого шлуночку серця[10].
У 1897 році Віктор Ейзенменгер (Victor Eisenmenger) описав пацієнтку 32-х років, що з дитинства мала симптоми задишки та ціанозу. Згодом у пацієнтки розвинулась гостра серцева недостатність та масивна легенева кровотеча, що в результаті призвело до її загибелі. При аутопсії померлої виявлено великий вентрикулосептальний дефект та декстрапозицію аорти[11].
У 1901 році Професор Медицини Університету Буенос-Айреса, Аргентина, Абель Аєрза (Abel Ayerza) вперше прочитав лекцію студентам з приводу синдрому, що включав в себе такі симптоми, як хронічний ціаноз, задишку та поліцитемію. Всі ці симптоми були асоційовані зі склерозом легеневих артерій. Пізніше, один із його студентів Ф. Арріллага (F. Arrillaga) назвав цей синдром — «Синдром Аєрза».[12] Пізніше, цей синдром асоціювали з терміном Первинна ЛГ, який в подальшому класифікували в Ідіопатичну та Сімейну ЛГ (детальніше див. Класифікація ЛГ).
У 1983 році американські лікарі С. Річ (Rich S) та В. Лем (Lam W) вперше виконали балонну передсердну атріосептостомію у пацієнта з ЛГ, у якого медикаментозне лікування виявилось неефективним.[13]
Ознаки та симптоми захворювання
Симптоми ЛГ є відносно неспецифічними для даного захворювання. Найчастішим є задишка. Інші ознаки включають втому, зниження резистентності до фізичного навантаження, синкопе, біль за грудиною, ціаноз і периферичні набряки.
- Синдром Ейзенменгера
Діти з вродженими вадами серця, що супроводжуються підвищеним легеневим кровотоком і підвищеним тиском у судинах малого кола кровообігу, мають у небезпеці розвиток незворотніх морфологічних змін судинного русла легень. Ці зміни приводять в результаті до втрати частини функціонально активного судинного русла, збільшення шунтування крові, викликаючи прогресивний ціаноз. Клінічно пацієнти з синдромом Ейзенменгера мають задишку при фізичному навантаженні, запаморочення, біль за грудиною, виражену серцеву недостатність, серцеві аритмії, кровохаркання або легеневу кровотечу, ендокардит, як ускладнення в результаті враження легеневого судинного русла.
Етіологія
Однією з найчастіших причин розвитку ЛГ є лівошлуночкова серцева недостатність, що призводить до венозної ЛГ. Лівошлуночкова серцева недостатність, в свою чергу, може бути наслідком систолічної або діастолічної дисфункції лівого шлуночка, або внаслідок клапанної дисфункції, такої як недостатність або стеноз мітрального клапана серця.
Мутація гена, що кодує скелет морфогенетичного протеїнового рецептору типу 2 (англ. BMPR2 – bone morphogenetic protein receptor type II), який знаходиться в хромосомі 2q33, виявляється майже у 50 % хворих на Сімейну ЛГ. Також вона виявлена у хворих на ЛГ, асоційовану з медикаментами (фенфлурамін). На сьогодні відомо понад 70 різновидів мутацій гену BMPR2.[14],[15]
Також причинами ЛГ можуть бути ВІЛ-інфекція, склеродерма та інші аутоімунні захворювання, цироз печінки та портальна гіпертензія, фіброзуючий медіастиніт, вроджені вади серця, тромбоемболія легеневих артерій, приймання медикаментів та інші. У випадках, коли причину розвитку ЛГ не вдається встановити, тоді йде мова про Ідіопатичну ЛГ.
Патогенез
Базові механізми, що лежать в основі ЛГ [16]
- Підвищення легеневого судинного опору (ЛСО)
- Підвищення легеневого кровотоку на фоні нормального ЛСО
- Комбінація підвищеного ЛСО та підвищеного легеневого кровотоку
- Підвищення легеневого венозного тиску
Підвищений ЛСО та ЛГ є центральними механізмами, що призводять до появи легеневого серця (лат. cor pulmonale).
Класифікація
У 2003 році, Третій Світовий Симпозіум з Легеневої Артеріальної Гіпертензії, що проходив у Венеції модифікував класифікацію ЛГ в залежності від нового розуміння розвитку механізмів захворювання[17].
Клінічна класифікація ЛГ (Венеція, 2003)
- Легенева артеріальна гіпертензія
- Ідіопатична
- Сімейна
- Асоційована з:
- колаген-васкулярними захворюваннями
- вродженими системно-легеневими шунтами*
- портальною гіпертензією
- ВІЛ інфекцією
- медикаментами/токсинами
- інші (захворювання щитоподібної залози, глікогенози, хвороба Gaucher, вроджена геморагічна телеангіектазія, гемоглобінопатії, мієлопроліферативні захворювання, спленектомія)
- Асоційована з важкістю венозного або капілярного току
- Персистуюча легенева гіпертензія новонароджених
- Легенева гіпертензія, пов'язана із захворюваннями лівих відділів серця
- Ураження лівого передсердя та/або лівого шлуночку
- Ураження аортального та/або мітрального клапана
- Легенева гіпертензія, зумовлена захворюваннями дихальної системи та/або гіпоксемією
- Хронічні обструктивні легеневі захворювання
- Захворювання інтерстицію легенів
- Розлади дихання під час сну
- Розлади дихання, пов'язані з альвеолярною гіповентиляцією
- Хронічне перебування в умовах висотної місцевості
- Аномалії розвитку
- Легенева гіпертензія внаслідок хронічних тромботичних та/або емболічних захворювань
- Різне
- Саркоїдоз, гістіоцитоз, лімфонгіоматоз, компресія легеневих судин (аденопатії, пухлина, фіброзуючий медіастиніт)
*-Рекомендації по Класифікації вроджених системно-легеневих шунтів[18]
- Тип
Простий — Атріосептальний дефект (АСД), Вентрикулосептальний дефект (ВСД), Відкрита артеріальна протока, Тотальний або Частковий необструктивний легеневий дренаж
Комбінований — Порівнюються вади та визначається переважний дефект
Складний — Загальний артеріальний стовбур, Єдиний шлуночок з необструктивним легеневим кровотоком, Атріовентрикулярний септальний дефект - Розміри
Малі (АСД≤2.0 см та ВСД≤1.0 см); Великі (АСД>2.0 см та ВСД>1.0 см) - Асоційована несерцева патологія
- Стан корекції
Некорегований, Частково корегований (у якому віці), Корегований: спонтанно або хірургічно (у якому віці).
Класифікація функціонального стану пацієнтів з ЛГ (NYHA/WHO)
Опис класів:[19]
I — Пацієнти з ЛГ, які не мають обмеження фізичної активності; звичайна фізична активність не спричинює появу задишки, втоми, болю в грудній клітці або передсинкопального стану.
II — Пацієнти з ЛГ, які мають деяку обмеженість фізичної активності. Вони не відчувають дискомфорту при відпочинку, але звичайні фізичні навантаження спричинюють появу задишки, втоми, болю в грудній клітці або передсинкопального стану.
III — Пацієнти з ЛГ, які мають виражену обмеженість фізичної активності. Вони не відчувають дискомфорту при відпочинку, але менші за звичайні фізичні навантаження спричинюють появу задишки, втоми, болю в грудній клітці або передсинкопального стану.
IV — Пацієнти з ЛГ з неможливістю виконувати будь-яке фізичне навантаження без виникнення симптомів. Пацієнти мають симптоми правошлуночкової недостатності. Задишка та/або втома можуть бути присутні у спокої; симптоми наростають за будь-якої фізичної активності.
Діагностика
- Оглядова рентгенографія органів грудної порожнини
Може показати збільшення за розміром легеневих артерій або правих відділів серця. Також дозволяє клініцистам провести первинну диференційну діагностику, відкинувши такі патології, як хронічні легеневі обструктивні захворювання.
Дозволяє виявити гіпертрофію правого шлуночка серця.
Застосування цього методу діагностики дозволяє раннє виявлення пацієнтів з ЛГ. Ехокардіографія презентує інформацію про розміри правих відділів серця, тиску в легеневих артеріях, систолічну та діастолічну функцію правого та лівого шлуночка[8]
Дає змогу оцінити зовнішню респіраторну функцію легень
- Катетеризація легеневої артерії
Виконується з метою пре-, інтра- та постопераційного моніторингу гемодинаміки пацієнта, у випадках перебування пацієнта в палаті інтенсивної терапії з діагностичною метою для прямого вимірювання тиску в легеневій артерії. Використовується катетер Сван-Ганц (англ. Swan-Ganz catheter), що дозволяє виміряти тиск у правому передсерді та шлуночку та тиск заклинення у легеневій артерії. Протипоказанням до застосування катетеру може бути наявність у пацієнта механічного трикуспідального або клапана легеневої артерії, тромбоз або пухлина правих відділів серця, ендокардит з ураженням трикуспідального або клапана легеневої артерії.
- Рентгенконтрастна катетеризація порожнин серця та магістральних судин
Дозволяє оцінити морфологічний та функціональний стан судинного русла легень, тиск у легеневих судинах. Окрім того, оцінює анатомічні особливості та функцію серця.
- Легенева сцинтіграфія
Дозволяє точно верифікувати діагноз ЛГ внаслідок хронічних тромботичних та/або емболічних захворювань
Можливе раннє виявлення Ідіопатичної ЛГ[20]
Забір легеневої тканини за допомогою торакотомії або торакоскопічної методики дозволяє морфологічно ідентифікувати стан легеневої тканини та встановити причину ЛГ.
Лікування
Лікування ЛГ залежить від причини захворювання. Зміна стилю життя, відмова від шкідливих звичок, застосування дігоксину, діуретиків, пероральних антикоагулянтів та оксигенотерапії не є вірогідно успішними методами, що приводять до виліковування.
Антикоагулянти
Антикоагуляційна терапія може знизити ризик тромбозу та розвитку захворювання у пацієнтів з ЛГ внаслідок хронічних тромботичних та/або емболічних захворювань, асоційованої з дефектами фібринолізу та порушеннями гемостазу.[22]
Вазодилататори
- Простациклін (англ. Prostacyclin) також відомий як Простагландин I2 (англ. Prostaglandin I2 - PGI2) та його синтетичний аналог Ілопрост (Ilomedin®, Ventavis®).
Має вазодилатувальну та антипроліферативну дію. Викликає внутрішньоклітинне підвищення цАМФ, призводячи тим самим до зниження легеневого судинного опору за рахунок вазодилатації, та зниження проліферації гладких м'язових клітин легеневих судин. Є потужним інгібітором тромбоксану, за рахунок чого зменшує його вазоконстриктивну, мітогенну та прокоагулянтну активність. На практиці простацикліни не мають однозначно успішного результату в лікуванні ЛГ, пов'язаної із захворюваннями лівих відділів серця.[23] Дещо кращі результати в лікуванні ЛГ має інгаляційний Ілопрост.[24]
- Інгаляційний NO (оксид азоту)
NO є потужним ендогенним вазодилататором, що викликає релаксацію судинної стінки завдяки збільшенню внутрішньоклітинної концентрації ц-ГМФ. NO швидко дезактивується, потрапляючи у кров завдяки високій афінності (спорідненості) до гемоглобіну, цим самим не викликаючи вазодилатацію системного судинного русла (судин великого кола кровообігу). Інгаляція NO викликає селективну легеневу вазодилатацію, швидко знижуючи післянавантаження правого шлуночка та покращує оксигенацію крові в легенях. Інгаляційний NO використовується у перед- та післяопераційній терапії при операціях на легенях і серці: у дітей після хірургічної корекції вродженої вади серця й у дорослих після трансплантації комплексу серце-легені. У цих випадках використання NO дозволяє проводити корекцію гемодинамічного стану пацієнта, знижуючи легеневий судинний опір.[25]
- Силденафіл (Viagra®) — ц-ГМФ специфічний інгібітор фосфодіестерази типу 5 (англ. cGMP PDE5-inhibitor).[26] Був остаточно апробований у 2005 році.
Застосування Сілденафілу в поєднанні з довгостроковою терапією з простациклінами у пацієнтів з вираженою ЛГ забезпечує тривалу клінічну стабілізацію стану хворого та покращення його дієздатності, що підтверджується ехокардіографічними показниками функції правого шлуночка. Ефект зазвичай триває більше 24 місяців.[27] Інший інгібітор ФДЕ-5 — Тадалафіл знаходиться у III фазі клінічних випробувань.
- Бозентан (Tracleer®) — пероральний антагоніст рецепторів ендотеліну (ETA and ETB). Був апробований у 2001 році.
Застосування Бозентану є терапією вибору у пацієнтів з Ідіопатичною ЛГ класу NYHA III. Також виявляє свою ефективність у пацієнтів з ЛГ, що асоційована з вродженими вадами серця, класу NYHA III—IV .[28],[29] Сітаксентан (Thelin®) — селективний антагоніст рецепторів ендотеліну (ETA), був апробований для застосування у Канаді та Європейському Союзі.[30] Він знаходиться також на фінальній стадії клінічних випробувань у США.
- Ріоцигуат — стимулятор розчинної гуанилатциклази (рГЦ).
Препарат має подвійний механізм дії: підвищує чутливість рГЦ до ендогенного NO та викликає пряму стимуляцію рГЦ.
Хірургічне
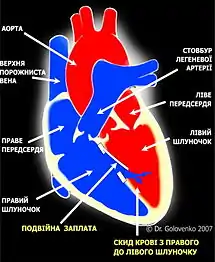
Операція показана пацієнтам з ЛГ у випадках рефрактерності до терапії простагландинами, а також, частково, у випадках частих синкопе. Вона не показана при критичному стані пацієнта, зумовленого правошлуночковою недостатністю, або у пацієнтів зі зниженими показниками роботи лівого шлуночку.[31]
- Легенева тромбоендартеректомія
Показана пацієнтам з ЛГ внаслідок Тромбоемболічної обструкції проксимальних легеневих артерій.
- Імплантація лівошлуночкового допоміжного пристрою.
Дозволяє підготувати пацієнтів з легеневою гіпертензією, яка рефрактерна до медикаментозної терапії, до трансплантації серця.[32]
- Трансплантація легенів[33], Трансплантація комплексу серце-легені[34]
Показані при неможливості медикаментозної терапії.
При хірургічній корекції вроджених вад серця, що супроводжуються легеневою гіпертензією застосовують такі оперативні втручання:
- Закриття ВСД подвійною заплатою
Операція використовується у пацієнтів з ВСД, що супроводжуються гіпертензією в легеневій артерії. У наш час[коли?] найбільша кількість таких операцій у світі виконана в Національному Інституті Серцево-судинної хірургії ім. М. М. Амосова, Україна та в Клініці Університету Теннессі, США.[35],[36],[37]
Перший етап при двоетапній корекції вродженої вади серця, що супроводжується гіпертензією в легеневій артерії. Вважається, що завдяки цій операції фактично відбувається ремоделювання судинного русла легенів і стає можливим проведення другого етапу — радикальної корекції (закриття ВСД).
Програми благодійних фондів
- Громадська Організація "Асоціація Рідкісного Захворювання України-Легенева Гіпртензія",PHURDA http://poryatunok.info/uk/
- Львівський міський благодійний фонд"Сестри Даліли"http://poryatunok.info/uk/
- Українська асоціація хворих легеневою гіпертензією
- Програма "Ковток повітря" Благодійного фонду «Життя у всій красі»
Джерела
- NDF-RT
- Drug Indications Extracted from FAERS — doi:10.5281/ZENODO.1435999
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Valentin Fuster, R. Wayne Alexander, Fuster Alexander, Hein J. J. Wellens HURST's The Heart, 2-Vol Set 11th edition «McGraw-Hill Professional» 2004 ISBN 0071422641
- S. Sciomer, D. Magri, R. Badagliacca «Non-invasive assessment of pulmonary hypertension: Doppler-echocardiography» Pulmonary Pharmacology & Therapeutics 20 (2007) 135—140 PMID 16753319
- Klob. Wien Wochenbl 1865;31:45
- Romberg E. U¨ ber Sklerose der Lungen Arterie. Deutsches Archives für klinische Medizin 1891;48:197-206
- Eisenmenger V: Die angeborenen Defecte der Kammerscheidewand des Herzens. Zeitschrift für klinische Medizin 1897; 32: 1-28
- Arrillaga FC. Sclérose de l’ artére pulmonaire (cardiagues noirs). Bull Mem Soc Méd Hop Paris 1924; 48:292-303
- Rich S, Lam W. Atrial septostomy as palliative therapy for refractory primary pulmonary hypertension. Am J Cardiol. 1983 May 15;51(9):1560-1. PMID 6189385
- Lane KB, Machado RD, Pauciulo, et al., for the International PPH Consortium. Heterozygous germ-line mutations in BMPR2, encoding a TGF-beta receptor, cause familial primary pulmonary hypertension. Nat Genet 2000; 26:81-4 PMID 10973254
- Humbert M, Deng Z, Simonneau G, et al. BMPR2 germline mutations in pulmonary hypertension associated with fenfluramine derivatives. Eur Respir J 2002; 20:518-23 PMID 15194173
- Richard A. Jonas , James DiNardo, Peter C. Laussen, Robert Howe, Robert LaPierre, Gregory Matte, Rebekah Dodson Comprehensive Surgical Management of Congenital Heart Disease «Hodder Arnold Publication» 2004 ISBN 0340808071
- Proceedings of the 3rd World Symposium on Pulmonary Arterial Hypertension. Venice, Italy, June 23-25, 2003. J Am Coll Cardiol 2004 Jun 16;43(12 Suppl S):1S-90S. PMID 15194171.
- Simonneau et al.: Clinical Classification of Pulmonary Hypertension J Am Coll Cardiol 2004 Jun 16;43(12 Suppl S):5S-12S PMID 15194173
- Barst R, McGoon M, Torbicki A et al.: Diagnosis and Differential Assessment of Pulmonary Arterial Hypertension J Am Coll Cardiol 2004 Jun 16;43(12 Suppl S): 40-7 PMID 15194177
- CT of the chest in the evaluation of idiopathic pulmonary arterial hypertension in children Pediatr Radiology (2007) 37:345-350 PMID 17279402
- S. Ley et al. Quantitative 3D pulmonary MR-perfusion in patients with pulmonary arterial hypertension: Correlation with invasive pressure measurements European Journal of Radiology 61 (2007) 251–255 PMID 17045440
- Altman R, Scazziota A, Rouvier J, et al. Coagulation and fibrinolytic parameters in patients with pulmonary hypertension. Clin Cardiol 1996;19:549-54 PMID 8818435
- M.E. van Albada et al. Prostacyclin therapy increases right ventricular capillarisation in a model for flow-associated pulmonary hypertension European Journal of Pharmacology 549 (2006) 107—116 PMID 16978602
- F. Reichenberger, A. Mainwood, N. Doughty et al: Effects of nebulised iloprost on pulmonary function and gas exchange in severe pulmonary hypertension Respiratory Medicine (2007) 101, 217—222 PMID 16831539
- Cannon BC, Feltes TF, Fraley JK et al: Nitric oxide in the evaluation of congenital heart disease with pulmonary hypertension: factors related to nitric oxide response. Pediatr Cardiol. 2005 Sep-Oct;26(5):565-9.PMID 16132310
- Barnett CF, Machado RF Sildenafil in the treatment of pulmonary hypertension Vasc Health Risk Manag. 2006;2(4):411-22. Review. PMID 17323595
- Ruiz et al.: Efficacy of Sildenafil as a Rescue Therapy for Patients With Severe Pulmonary Arterial Hypertension and Given Long-term Treatment With Prostanoids: 2-Year Experience J Heart Lung Transplant. 2006 Nov;25(11):1353-7. PMID 17097500
- Keogh AM, McNeil KD et al: Quality of life in pulmonary arterial hypertension: improvement and maintenance with bosentan J Heart Lung Transplant. 2007 Feb;26(2):181-7.PMID 17258153
- Sitbon O, Beghetti M, Petit J, Iserin L, Humbert M, Gressin V, Simonneau G. Bosentan for the treatment of pulmonary arterial hypertension associated with congenital heart defects Eur J Clin Invest. 2006 Sep;36 Suppl 3:25-31 PMID 16919007
- UPDATE 1-Encysive gets Canadian approval for hypertension drug. Reuters. 30 травня, 2007. Архів оригіналу за 21 червня 2013. Процитовано 8 липня 2007.
- British Cardiac Society Guidelines and Medical Practice Committee, and approved by the British Thoracic Society and the British Society of Rheumatology «Recommendations on the management of pulmonary hypertension in clinical practice» Heart 2001;86;1-13 PMID 11473937
- Etz CD, Welp HA, Tjan TD, Hoffmeier A, Weigang E, Scheld HH, Schmid C. Medically Refractory Pulmonary Hypertension: Treatment With Nonpulsatile Left Ventricular Assist Devices Ann Thorac Surg. 2007 May;83(5):1697-705. PMID 17462383
- Ueno T, Smith JA, Snell GI, et al: Bilateral sequential single lung transplantation for pulmonary hypertension and Eisenmenger's syndrome. Ann Thorac Surg 2000 Feb; 69(2): 381-7. PMID 10735667
- Walter Klepetko, MD, Eckhard Mayer, MD, Julio Sandoval, MD et al: Interventional and Surgical Modalities of Treatment for Pulmonary Arterial Hypertension J Am Coll Cardiol 2004 Jun 16;43(12 Suppl S):73S-80S. PMID 1519417.
- William M. Novick, Nestor Sandoval, Vasiliy V. Lazoryshynets et al, Flap Valve Double Patch Closure of Ventricular Septal Defects in Children With Increased Pulmonary Vascular Resistance, Ann Thorac Surg 2005;79:21-8. PMID 15620908.
- Novick WM, Gurbuz AT, Watson DC, Lazorishinets VV et al, Double patch closure of ventricular septal defect with increased pulmonary vascular resistance, Ann Thorac Surg 1998 Nov;66(5):1533-8. PMID 9875747
- Oleksandr Golovenko, William Novick, Sergiy Siromakha, Vasyl Lazoryshynets, J Cardiothorac Surg 2013;8(Suppl. 1):94. PMCID 3846400
Посилання
українською мовою
- Хронічне легеневе серце Медицина світу, Львів 2003
- Первинна легенева гіпертензія: діагностика та методи лікування Медицина світу, Львів 2001
англійською мовою
- The Merck Manual of Diagnosis and Therapy: Pulmonary Hypertension
- PH Central - the internet resource for Pulmonary Arterial Hypertension
- The Pulmonary Hypertension Association Webpage Асоціація Легеневої Гіпертензії
- Facts About Primary Pulmonary Hypertension Факти про Легеневу Гіпертензію від National Heart, Lung, and Blood Institute (NHLBI)
- Webcast: The Changing World of Pulmonary Arterial Hypertension Therapies - American College of CHEST Physicians
- Pulmonary Arterial Hypertension Information for Healthcare professionals
російською мовою
- Персистирующая легочная гипертензия Журнал «Интенсивная терапия» № 2 2006, Москва
Література
- Легенева гіпертензія / Форманчук О. К., Форманчук К. В. — Львів: Ліга-прес, 2008. — 149 с.
|
|
Ця стаття належить до добрих статей української Вікіпедії. |