Гемостаз
Гемостаз (гемостазис[1]) — це фізіологічний процес в крові, який виконує захисну роль в організмі, при кровотечі і/чи тромбоутворенні.[2]
Два найбільш досліджені процеси, які задіяні у гемостазі — це гемкоагуляція з тромбоутворенням та лізис тромбів (тромболізис і/або природня реканалізація).
Фізіологічний гемостаз можна розділити на два підпроцеси, які, однак, взаємодіють між собою. У первинному (також: клітинному) гемостазі, беруть участь тромбоцити, клітини ушкодженої стінки кровоносної судини (ендотелію та гладком'язові клітини), та тканини за межами пошкодженої судини. Судина у відповідь на пошкодження звужується, тромбоцити збираються біля місця ураження (адгезія), прилипають поверхнями один до одного (агрегація) і таким чином утворюється первинне закупорювання місця ушкодження. При вторинному (також: плазматичному) гемостазі, ця «оклюзія» посилюється утворенням фібринових ниток. Важливу роль в цьому процесі відіграє активація близько десятка факторів згортання, що містяться в плазмі крові. Генетичний дефект факторів згортання може призвести до захворювань, наприклад гемофілія. Початок загоєння ран також ініціюється факторами росту, які виділяються тромбоцитами та ендотеліальними клітинами. Після закінчення загоєння ран фібрин вивільняється фібринолітичною системою плазми крові.
Гіперкоагуляція — це посилене згортання крові.
Фізіологічні процеси після травми судин

Після травмування дрібних судин, кровотеча зазвичай швидко припиняється. Гемостаз, що відповідає за це, можна розглядати як послідовність наступних процесів.
- Спонтанний судинний гемостаз (або вазоконстрікція, скорочення і/чи звуження судин при ушкодженні)
- найяскравіший приклад при ушкодженні артеріальних судин. Артерії «м'язового типу» мають властивість «закупорюватись» після того, як їх розрізають поперечно. Ця властивість обумовлена будовою стінок артерій: еластична внутрішня стінка артерії (Membrana elastica interna) після розрізання стискається сильніше, ніж інші шари стінки. Це затягує вільний край ушкодженої артерії у внутрішню частину судини, забезпечуючи їй тим самим дуже швидке закриття.
- Клітинний гемостаз
- Він складається з прикріплення (адгезії) та склеювання (агрегації) тромбоцитів, подальшої активації тромбоцитів, та утворення оклюзійного «білого тромбу». Крім того, викид вазоконстрикторних речовин, спричиняє рефлекторне звуження судин. Це зменшує приплив і одночасно втрату крові.
- Плазмовий гемостаз
- Компоненти плазми крові створюють сітку механічно стійких фібринових ниток, в яких «застрягають» циркулюючі еритроцити, внаслідок чого утворюється «червоний тромб», який з часом твердне і затягується.
Клітинний гемостаз
В крові людини в нормі знаходиться від 150.000 до 400.000 тромбоцитів на мікролітр. В клітинній мембрані тромбоцитів наявні численні глікопротеїни і рецептори, які відіграють важливу роль в клітинному гемостазі.
Внутрішня клітинна стінка кровоносних судин називається ендотелієм. Зсередини вона вкрита глікокаліксисом, шаром «слизу», до якого тромбоцити не мають рецепторів. Це одна з причин того, що тромбоцити можуть залишаютися неактивними в непошкоджених судинах і не здатні прикріпитися до стінки судин. Різні фактори також протидіють активації, наприклад, простациклін та оксид азоту, а також гепарин, який синтезується тучними клітинами, чий інгібуючий вплив на гемостаз можна використовувати в терапевтичних цілях.
Адгезія та активація тромбоцитів
При пошкодженні судини кров контактує з навколишньою сполучною тканиною, включаючи колагенові волокна. Колаген — структурний білок, який знаходиться майже скрізь у позаклітинному просторі. Тромбоцити спочатку прилипають до цих волокон (тромбоцитарна адгезія), що призводить до утворення тонкого покрову рани. Адгезія забезпечується фактором Фон Віллебранда (vWF), розчинним білком крові, який утворюється ендотеліальними клітинами та мегакаріоцитами. Разом з фібронектином та ламініном, він створює зв'язок між колагеновими волокнами та рецептором на тромбоцитах (GP Ib / V / IX). Дефект фактора Фон Віллебранда призводить до синдрому Віллебранда-Юргенса.
Адгезія запускає активацію тромбоцитів: вони виділяють іони кальцію, АДФ, серотонін, тромбоксан А 2 та інші речовини з так званих «електронепроникних гранул». Цей механізм залучає додаткові тромбоцити (хемотаксис). Тромбоксан А 2 також істотно сприяє звуженню судин, що протидіє сильному кровотоку. Вивільняється вміст так званих «α-гранул» тромбоцитів: коефіцієнти згортання (фактор V, фактор VIII), адгезиви (vWF, фібронектин, тромбоспондин) та фактори росту. Активізуючи різні метаболічні шляхи, все більше утворюються такі речовини, як тромбоксан А 2 та ФАТ (фактор активації тромбоцитів). Деякі з цих речовин індукують згортання плазми.

.
- Агрегація активованих тромбоцитів сприяє перебудові цитоскелету, що спричиняє багаторазове збільшення клітинної поверхні. В той час як тромбоцити в неактивному стані нагадують форму кришталиків, в активному стані — вони набувають сферичної форми і переносять довгі псевдоподії, за допомогою яких можуть чіплятись одне до одного, або рідше до інших клітин. З'єднані одне з одним тромбоцити врешті утворюють «тромбоцитну пробку», яку називають білим тромбом. На цьому закінчується клітинний гемостаз. Процес зазвичай займає одну-чотири хвилини, ця тривалість називається часом кровотечі.
Білий тромб не дуже стійкий і може достатньо легко відриватись. Плазматичний гемостаз утворює більш міцне з'єднання.
Плазматичний гемостаз
Плазматичний гемостаз утворює «сітку» з механічно стійкого фібрину, в який крім тромбоцитів захоплюються еритроцити, що в сукупності називається «червоним тромбом».
Активовані тромбоцити мають на своїй клітинній мембрані рецепторний комплекс (глікопротеїн IIb / IIIa), з яким зв'язується фібриноген з плазми та адгезивні речовини, що виділяються з активованих тромбоцитів (фібронектин, тромбоспондин). Через «механізми зворотного зв'язку», вивільнені речовини призводять до незворотної агрегації, при якій клітинні мембрани тромбоцитів зливаються разом.
Вторинний гемостаз, також відомий як каскад згортання, поділяється на три фази: фаза активації, згортання та втягування.
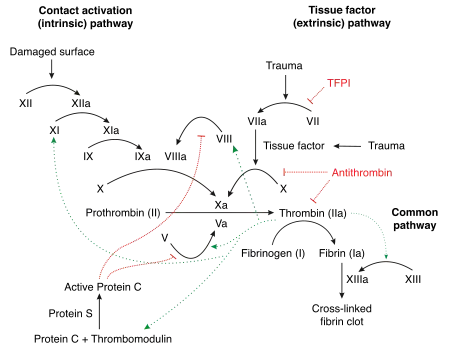
Фаза активації
Через контакт тромбоцитів з негативно зарядженими поверхнями, такими як скло, активуються фактори XII та XI, які запускають каскад згортання (внутрішня система) Якщо фактор XII не виробляється у людини, це не призводить до значного розладу згортання, на відміну від нестачі факторів VIII, IX та XI, що призводить до гемофілії A, B і C.
Нормальний фізіологічний процес (зовнішня система або екзогенний механізм) ініціюється контактом крові з тканинним тромбопластином з травмованої субендотеліальної тканини. Тканинний фактор ((ТФ), тканинний тромбопластин або фактор III) — мембранний білок, який утворюється, в адвентиції судин, та вивільняється лише ендотеліальними клітинами після активації. Він утворює комплекс з фактором VII, який перетворює його в активну форму. Внаслідок цього механізму утворюється тромбін, але процес пригнічується достатньо швидко «інгібітором шляху тканинного фактора» (ІШТФ). Коли утворюється достатня кількість тромбіну, активується так званий активаторний комплекс факторів IX та VIII. Цей комплекс у свою чергу активує фактор X.
Відсутність факторів VIII або IX призводить до гемофілії — каскад переривається і згортання не відбувається. Пацієнт може стікати кров'ю до смерті від наймешних пошкоджень.
В обох механізмах — внутрішньому та зовнішньому — фактор X остаточно активується до фактора Xa. Це в свою чергу розщеплює протромбін (фактор II), утворюється тромбін (фактор IIa). Ця реакція на мембрані тромбоцитів відбувається лише в присутності кальцію і значно прискорюється за допомогою механізму «позитивного зворотнього зв'язку» із комплексом факторів VIII та IX. Фаза активації закінчується утворенням ферментативно активного тромбіну.
Фази згортання та втягування
Ферментативно активний тромбін відповідає за полімеризацію фібрину і, таким чином, за утворення червоного тромбу: у фазі згортання він розщеплює низькомолекулярні одиниці (мономери) від неактивного попередника фібриногену (фактор I), який з'єднується нековалентно з полімерним фібрином. Під дією фактора XIII остаточно утворюються ковалентні зв'язки між мономерами і тромб стабілізується. Фібрин «зшиває» тромбоцити, які вже накопичилися, тим самим посилюючи закриття рани. У утворену «сітку» потрапляють еритроцити, утворюється так званий червоний тромб. Тромбін продовжує викликати скорочення актин-міозинового скелета всередині тромбоцитів: тромбоцити, що скорочуються, тягнуться за фібринову сітку і одночасно за краї рани, таким чином повністю закриваючи її. Скорочення — підтримується PDGF (тромбоцитарний фактор росту) — також сприяє проникненню клітин сполучної тканини, починається загоєння ран.
Огляд факторів згортання та інгібіторів
Крім іонів кальцію (фактор IV), чинниками згортання є білки. Кожному фактору присвоюється римське число. Невелике a після числа означає, що воно знаходиться в активній формі. З історичних причин число VI більше не присвоюється, відповідний коефіцієнт ідентичний Va[3]. Не усі уже відкриті речовини і сполуки, що беруть участь у гемостазі, мають свій номер у міжнародній номенклатурі.
| число | Назва | Функції | Синдроми дефіциту |
|---|---|---|---|
| I | Фібриноген | Молекула-попередник для формування фібринової сітки. | Афібриногенемія (вроджена або при коагулопатії споживання) |
| II | Протромбін | Активна форма тромбіну (IIa) активує фактори I, V, VIII, XI і XIII. | Гіпопротромбінемія (вроджена недостатність вітаміну К або у разі споживання коагулопатії) |
| ІІІ | Тканинний фактор, тканинний тромбопластин, (ТФ) | Єдиний знаходиться не в крові, а в субендотеліальній тканині, кофактор VIIa. | |
| IV | Кальцій | Багато факторів потребують катіона кальцію Са 2+ для того, щоб зв'язатися з негативно зарядженими фосфоліпідами плазматичних мембран. | |
| V | Проакцелерин | Va і Xa утворюють комплекс, який активує II з Ca 2+ і фосфоліпідами. | Парагемофілія (вроджена) |
| VI | відповідає коефіцієнту Va[3] | ||
| VII | Проконвертин | VIIa і (ТФ) утворюють комплекс із Ca 2+ та фосфоліпідами, який активує IX та X. | Гіпопроконвертинемія (вроджена недостатність вітаміну К) |
| VIII | Антигемофільний глобулін А | VIIIa та IXa утворюють комплекс із Ca 2+ та фосфоліпідами, який активує X. | Гемофілія А (вроджена спадкова спадкова спадщина) |
| ІХ | Різдвяний фактор, антигемофільний глобулін Б | VIIIa та IXa утворюють комплекс із Ca 2+ та фосфоліпідами, який активує X. | Гемофілія B (вроджена спадкова спадкова спадщина) |
| Х | Коефіцієнт Стюарт Провер | Va і Xa утворюють комплекс, який активує II з Ca 2+ і фосфоліпідами. | Дефіцит фактора X (вроджений) |
| XI | Фактор Розенталя | XIa активує IX. | Гемофілія С (вроджена), коагулопатії споживання |
| XII | Фактор Хагемана | XIIa активує XI. | Синдром Хагемана, швидше за все, спричиняє розлади фібринолізу (вроджені або коагулопатії споживання) |
| XIII | Стабілізуючий фактор фібрину | XIIIa перетворює мономери фібрину в зшитий фібрин. | Дефіцит фактора XIII |
Щоб уникнути згортання крові при відсутності травм, плазма крові містить різні інгібіторні речовини. Інгібітори протеази пригнічують утворення фібрину. Антитромбін інгібує кілька коагуляційних протеаз у фазах активації та згортання. Інгібіторний ефект значно посилюється його кофактором, гепарином. Гепарин складається з ендотеліальних клітин і тучних клітин. Тромбомодулін, який також походить з ендотелію, зв'язується з тромбіном і активує білок С, який інактивує кофактори Va і VIIIa після зв'язування з білком S.
Клінічне значення
Медикаментозне пригнічення згортання крові
- Зазвичай до, під час і після операцій, а також при багатьох інших захворюваннях, антикоагулянтні препарати (які помилково називають розріджувачами крові) часто застосовуються для запобігання тромбозу та легеневої емболії .
На сьогодні найпоширенішою причиною тривалої терапевтичної антикоагуляції є фібриляція або миготіння передсердь. При цій серцевій аритмії існує підвищений ризик емболії, який у багатьох пацієнтів доводиться знижувати, розріджуючи кров. Друга найпоширеніша причина — тромбоз, як правило, глибоких вен нижніх кінцівок. Пригнічення згортання крові в гострій фазі призначене для запобігання подальшого розширення тромбозу та подальшого рецидиву.
Гепарин
Гепарин та «гепариноїди» можуть використовуватися для інгібування коагуляції in vivo. Це ланцюг цукрів, який має сильний негативний заряд, та приєднується до вже згаданого білкового антитромбіну. Цей комплекс тепер більш ефективно зв'язує фактори тромбіну та Xa, які тим самим виходять з процесу, каскад згортання припиняється. Ефекти починаються відразу після внутрішньовенного введення. Лікарський гепарин зазвичай отримують з тканин тварин.
Кумарини
Іншою можливістю є так звані антагоністи вітаміну K, такі як похідні кумарину фенпрокумон та варфарин. Вітамін К необхідний як кофермент для синтезу більшості факторів згортання. Кумарин починає свою дію в печінці і запобігає зниженню вітаміну К (філохінон). Він впливає на γ- карбоксилювання факторів згортання (II, VII, IX, X) і сам піддається окисленню (вивільнення електронів). Без подальшого зниження (поглинання електронів) вітамін К залишається недіючим. Ефект набуває чинності лише через певний час (дікілька днів)
Антиагреганти
Ацетилсаліцилова кислота може перешкоджати агрегації тромбоцитів, тобто клітинному гемостазу. Циклооксигеназа(ЦОГ), яка необхідна для синтезу фактора тромбоцитів тромбоксану A 2, необоротно інгібується шляхом приєднання залишку оцтової кислоти. Клопідогрель також діє на агрегацію тромбоцитів, що гальмує АДФ-залежну активацію тромбоцитів шляхом незворотного блокування рецепторів. Абциксимаб — це рекомбінантне моноклональне антитіло, яке блокує тромбоцитний глікопротеїн IIb / IIIa, тим самим запобігаючи агрегацію тромбоцитів. Тірофібан має той самий механізм дії.
Фібринолітики
Фібринолітики активізують плазміноген і, таким чином, сприяють розчиненню тромбів (тромболізу). Цей механізм використовується для лікування інфарктів, легеневої емболії, тромбозів вен ніг, периферичних оклюзійних захворювань, а також протягом «чотиригодинного вікна», для гострих інфарктів мозку. У той час як активні речовини, такі як стрептокіназа та урокіназа, мають неспецифічну дію як на фібриноген, так і на фібрин, нові речовини, такі як Альтеплаза (плазміногений активатор рекомбінантної тканини, англ. rt-PA), мають селективність щодо зв'язаного фібрину в тромбах, що зменшує системні побічні ефекти, особливо кровотечі. Застосування фібринолітиків відбувається лише під контролем лікаря.
Інгібування «in vitro»
In vitro, наприклад у пробірках крові часто використовують ЕДТА і цитрат, хелатори яких утворюють комплекс з катіонами кальцію, необхідними для згортання. Антикоагуляція гепарином можлива також in vitro. Антикоагулянт вибирається, виходячи з цього, згодом планується обстеження крові, яка не була згорнута. Для самих досліджень на коагуляцію цитрат використовується майже виключно як антикоагулянт, розбавляючи зразок крові у співвідношенні 9 + 1, 3,8 % розчином цитрату натрію. Зазвичай використовують промислово збірні трубки, які вже вміщують 0,3 мл розчину цитрату натрію, до яких доливають 2,7 мл крові. Для надійності аналізів, створених з цього приводу, важливо, щоб це співвідношення дотримувалося точно і щоб зразок крові ретельно змішувався з розчином цитрату натрію відразу після збору.
Медикаментозне посилення згортання крові
Препарати, що усувають вроджений або набутий дефіцит факторів згортання, наприклад концентрат фактора VIII для гемофілії, набули особливого значення для медикаментозного лікування, вітамін K і концентрат протромбіну для кровотечі при лікуванні кумарином або замороженою свіжою плазмою з дисемінованою внутрішньосудинною коагуляцією. Якщо є виражений брак тромбоцитів, їх можна замінити у вигляді тромбоцитарних концентратів. Дію гепарину можна скасувати антидотом - протаміном.
Гемостаз також може бути підсилений за рахунок пригнічення природного антагоніста коагуляції, фібринолізу. Препарати з таким механізмом дії називаються антифібринолітиками. Транексамова кислота, і ε-амінокапронова кислота використовуються в якості активних інгредієнтів.
Раніше у кардіохірургії використовувся апротинін, був знятий з фарм. ринку деяких європейських країн в листопаді 2007 р — через ризик ренальної дисфункції, масивних кровотеч та підвищеної смертності під час кардіохірургічного лікування.[4][5][6]
Визначення здатності крові до згортання
В клінічній практиці для оцінки згортальної системи крові застосовують наступні основні лабораторні параметри:
- Протромбіновий час (ПТЧ або ПЧ) для визначення селективної функції «екзогенної системи» згортання шляхом додавання тканинного фактора і Са 2+ до зразка крові, а потім визначення часу згортання порівняно з нормальною кров'ю, наприклад у випадку терапії кумаринами, так само і отриманого з нього показника «міжнародного нормалізованого відношення» — INR (International Normalized Ratio), який все частіше використовується в клінчній практиці.
- Активований частковий тромбопластиновий час (активований частковий тромбіновий час, АЧТЧ, англ. PTT) для визначення селективної функції «ендогенної системи» та загального способу згортання крові. При гемофілії це значення вище стандартного значення приблизно на 30 секунд. Дані дослідження використовуються для виявлення сповільненого згортання (ризик кровотечі) і можуть бути застосовані для контролю за лікуванням антикоагулянтними препаратами, такими як Маркумар.. Іншими, менш часто використовуваними тестами для вимірювання здатності крові до згортання є тромбіновий час та функціональне визначення фібриногену згідно Клауса.
- Протеїн C — фактор протизгортаючої (фібринолітичної) системи
- Стан активації системи згортання у всьому організмі можна оцінити, визначаючи D-димери (продукти розпаду фібрину). Наприклад, можна визначити певні захворювання, які існують під час забору крові та пов'язані з активацією згортання плазми (тромбоз, легенева емболія, дисемінована внутрішньосудинна коагуляція та індукована гепарином тромбоцитопенія II типу). Розрізнити різні можливі причини активації коагуляції, та надійну оцінку майбутнього ризику (тромбофілія) неможливо шляхом визначення D-димерів. Підходящого пошукового тесту на тромбофілію на даний момент не існує, а якщо є підозра, необхідно виключити всі можливі причини.
Артеріальна кров згортається швидше, ніж венозна, що пов'язано з різницею концентрації кисню і вуглекислого газу. Коагуляцію артеріальної крові можна уповільнити, додаючи вуглекислоту, але коагулицію венозної крові можна прискорити, збільшуючи в ній вміст кисню.
Примітки
- (англ.)Recently Identified Factors that Regulate Hemostasis and Thrombosis. Julia E Geddings and Nigel Mackman 2014
- СУЧАСНІ УЯВЛЕННЯ ПРО СИСТЕМУ ГЕМОСТАЗУ. Остапець М. О., Волковой В. А., Березнякова М. Є., Карабут Л. В., Фоміна Г. П. 2017
- (англ.)SIX CHARACTERS IN SEARCH OF AN AUTHOR: THE HISTORY OF THE NOMENCLATURE OF COAGULATION FACTORS// 2003 Blackwell Publishing Ltd, British Journal of Haematology 121: P.703–712 Електронне джерело (p. 703, 708)
- Mouton, Ronelle; Finch, David; Davies, Ian; Binks, Andrea; Zacharowski, Kai (9 лютого 2008). Effect of aprotinin on renal dysfunction in patients undergoing on-pump and off-pump cardiac surgery: a retrospective observational study. The Lancet (English) 371 (9611). с. 475–482. ISSN 0140-6736. PMID 18262039. doi:10.1016/S0140-6736(08)60237-8. Процитовано 17 червня 2020.
- Fergusson, Dean A.; Hébert, Paul C.; Mazer, C. David; Fremes, Stephen; MacAdams, Charles; Murkin, John M.; Teoh, Kevin; Duke, Peter C. та ін. (29 травня 2008). A Comparison of Aprotinin and Lysine Analogues in High-Risk Cardiac Surgery. New England Journal of Medicine 358 (22). с. 2319–2331. ISSN 0028-4793. PMID 18480196. doi:10.1056/NEJMoa0802395. Процитовано 17 червня 2020.
- Mangano, Dennis T.; Tudor, Iulia C.; Dietzel, Cynthia; Multicenter Study of Perioperative Ischemia Research Group; Ischemia Research and Education Foundation (26 січня 2006). The risk associated with aprotinin in cardiac surgery. The New England Journal of Medicine 354 (4). с. 353–365. ISSN 1533-4406. PMID 16436767. doi:10.1056/NEJMoa051379. Процитовано 17 червня 2020.
Див. також
Джерела
- Клінічна фізіологія: підручник (ВНЗ ІІІ—IV р. а.) / В. І. Філімонов.- ВСВ «Медицина», 2012.- 736 с. ISBN 978-617-505-192-4 (С.203-227 :Гемостаз і його порушення)
- Recently Identified Factors that Regulate Hemostasis and Thrombosis. Julia E Geddings and Nigel Mackman. 2014 PMID: 24573314 doi: 10.1160/TH13-10-0812
- Основи внутрішньої медицини. Том 3.: Підручник для ВМНЗ IV р.а./Передерій В. Г. та інш..- Вінниця: Нова книга, 2010.-1006 с. ISBN 978-966-382-281-0 (С.654-657)
- Іонов І. А., Комісова Т. Є., Слюсарєв В. Ф., Шаповалов С. О. Фізіологія крові та внутрішнього середовища (методичні рекомендації) І. А. Іонов, Т. Є. Комісова, В. Ф. Слюсарєв, С. О. Шаповалов.- Х: ЧП Петров В. В.- 2017.- 48 c. [ Електронне джерело ]
- Giangrande, Paul L. F. (2003). The History of the Nomenclature of Coagulation Factors. British Journal of Haematology (en) 121 (5). с. 703–712. ISSN 1365-2141. doi:10.1046/j.1365-2141.2003.04333.x(англ.)
- A. Thiele: Захист від небезпеки використання лікарського засобу / Апротинін - вміщуючі лікарські засоби для внутрішньовенного застосування. Bundesinstitut für Arzneimittel und Medizinprodukte. 5. листопада 2007, перглянуто 13. лоютого 2017 PDF Архівовано 26 листопада 2020 у Wayback Machine. (нім.)
