Оксокислоти
О́ксокисло́ти — похідні карбонових кислот, у молекулах яких окрім карбоксильної групи міститься альдегідна (RH=O) або кетогрупа (R1(C=O)R2).
Номенклатура
За кількістю оксогруп розрізняють такі альдегідо- і кетонокислоти: моноальдегідо- і діальдегідокислоти, моно- і дикетокислоти тощо. За кількістю карбоксильних груп оксокислоти поділяють на одно, двох- і багатоосновні. За відстанню карбонільної групи від карбоксильної оксокислоти поділяються на α-оксокислоти (карбонільна група приєднана до карбоксильної), β-оксоксикислоти (ці групи розділяє один атом карбону), γ-оксокислоти та інші.
Отримання
Оксокислоти отримують гідролізом галогенкарбонових кислот:
Їх також можна отримати окисненням двохатомних спиртів:
Реакція йде у три етапи. При цьому може спочатку повністю окиснитися один атом карбону з гідроксильною групою, а може навпаки:
Оксокислоти також можна отримати оксиненням гідроксикислот:
Ще оксокислоти отримують з галогенангідридів:
Хімічні властивості
Оксокислоти — гетерофункціональні сполуки. Вони одночасно мають властивості карбонових кислот і оксосполук. Як карбонові кислоти, вони здатні утворювати солі, галогенангідриди, естери, ангідриди кислот. Маючи у складі своїх молекул карбонільну групу, вони здатні утворювати оксими, гідразони, ціангідрини тощо.
α-оксокислоти є сильнішими кислотами, ніж α-гідроксикислоти. При нагріванні вони декарбоксилюються легше за карбонові кислоти з утворенням альдегідів:
В присутності концентрованої сульфатної кислоти утворюються не альдегіди, а карбонові кислоти, а замість діоксиду вуглецю утворюється монооксид:
При декарбоксилюванні альдегіди можуть окиснюватися:
β-оксокислоти є нестабільними та легко декарбоксилюються. Це пов'язано з утворенням водневих зв'язків між атомом оксигену у карбонільній групі та атомом гідроген у карбоксильній. Внаслідок цього атом гідрогену переходить до карбонільної групи, а між α- та β-атомами карбону утворюється подвійний зв'язок та відщеплюється вуглекислий газ:
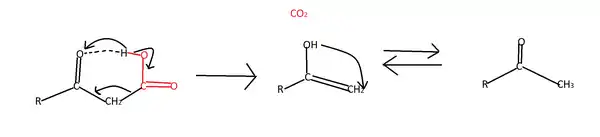
γ- та δ-оксокислоти мають всі властивості, характерні для карбонових кислот та для карбонільних сполук. Вони також можуть вступати у реакцію внутрішньомолекулярної циклізації внаслідок переходу атома гідрогену з карбоксильної групи до карбонільної групи:

Найбільш відомі представники оксокислот
Найпростішими представниками альдегідо- і кетокислот є оксоетанова (гліоксалева кислота) та 2-оксопропанова (піровиноградна), яким належить важлива роль у перетворенні вуглеводів, білків та ліпідів у живих організмах.
Піровиноградна кислота
2-Оксопропанова (піровиноградна, α-кетопропіонова, ацетилформіатна) кислота — рідина], кипить при 165 °С (з розкладанням), добре розчиняється у воді, діетиловому етері й етанолі, має різкий запах. Добувають окисненням лактатної кислоти. Одночасно має властивості кислот і кетонів. Солі й етери піровиноградної кислоти називають піруватами. Піровиноградна кислота, приєднуючи гідроген, перетворюється на лактатну кислоту. При окисненні (окисному декарбоксилуванні) утворює ацетатну кислоту й оксид карбону(IV). Ці реакції відбуваються і в живих організмах.
Піровиноградна кислота — один з центральних проміжних продуктів під час взаємного перетворення вуглеводів, ліпідів та білків у живих організмах.
Таутомерія
Етил-3-оксобутаноат (ацетооцтовий естер) — рідина з приємним запахом, кипить з незначним розкладанням при 180 °С, погано розчиняється у воді, існує у вигляді двох форм — кетонної та енольної, які взаємно переходять одна в одну. Динамічна рівновага обох форм естеру настає в суміші, коли 92 % її становить кетонна форма і 7,5 % — енольна.
Ацетооцтовий естер — цінний продукт для органічного синтезу. Його використовують для виробництва лікарських препаратів амідопірину і акридину, багатьох азобарвників (див. азосполуки), вітаміну В1, ароматизуючих речовин (добавок для харчових продуктів) тощо.
Див. також
Джерела
- Тюкавкина А. Н., Бауков Ю. И. Биоорганическая химия. — 3-е, перераб. и доп. — М. : «Дрофа», 2004. — 544 с. — ISBN 5-7107-7420-0. (рос.)
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- O. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.(рос.)
