Етилбензен
Ети́лбензе́н (також ети́лбензо́л) — органічна сполука, ароматичний вуглеводень із лінійною формулою C6H5C2H5. За звичайних умов є безбарвною, легкозаймистою леткою рідиною з характерним запахом, що нагадує гас.
| Етилбензен | |
|---|---|
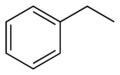 Структурна формула |
 Просторова модель |
| Назва за IUPAC | етилбензен[1] |
| Інші назви | етилбензол, фенілетан |
| Ідентифікатори | |
| Номер CAS | 100-41-4 |
| PubChem | 7500 |
| Номер EINECS | 202-849-4 |
| DrugBank | DB01722 |
| KEGG | C07111 |
| ChEBI | 16101 |
| RTECS | DA0700000 |
| SMILES |
CCc1ccccc1 |
| InChI |
1/C8H10/c1-2-8-6-4-3-5-7-8/h3-7H,2H2,1H3 |
| Номер Бельштейна | 1901871 |
| Номер Гмеліна | 2990 |
| Властивості | |
| Молекулярна формула | C8H10 |
| Молярна маса | 106,165 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Запах | гас |
| Густина | 0,8626 г/моль |
| Тпл | -94,96 °C[2] |
| Ткип | 136,19 °C[2] |
| Розчинність (вода) | 0,161 г/л |
| Тиск насиченої пари | 9,998 мм рт.ст. |
| Діелектрична проникність (ε) | 2,4463 |
| Показник заломлення (nD) | 1,4959 (20 °C) |
| В'язкість | 0,631 мПа·с |
| Дипольний момент | 0,59±0,05 Д |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-12,3 кДж/моль (рід.) 29,9 кДж/моль (газ) |
| Ст. ентропія S |
360,5 Дж/(моль·K) (газ) |
| Теплоємність, c |
183,2 Дж/(моль·K) (рід.) |
| Небезпеки | |
| ЛД50 | 3,5—4,7 г/кг (щурі, орально) 15 г/кг (дермально) |
| Температура спалаху | 21 °C |
| Температура самозаймання | 432 °C |
| Вибухові границі | 0,8—6,7% |
| Пов'язані речовини | |
| Пов'язані речовини | бензен, стирен, толуен |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Незначні кількості етилбензену спостерігаються у кам'яновугільній смолі та нафті.
Етилбензен є важливим прекурсором у нафтохімічному синтезі. 99 % етилбензену, що виробляється у світі, використовується для синтезу стирену (фенілетилену), котрий, у свою чергу, є сировиною для полістирену. Невелика кількість етилбензену використовується як розчинник та антидетонатор.
Фізичні властивості
За звичайних умов етилбензен — безбарвна, прозора рідина із запахом гасу.
| 0 °C | 25 °C | 50 °C | 75 °C | 100 °C |
|---|---|---|---|---|
| 0,872 | 0,631 | 0,482 | 0,380 | 0,304 |
Він змішується із великою кількість органічних розічнників. Також утворює азеотропні суміші.
| Компонент | Температура кипіння, °C | Вміст етилбензену, % | Вміст другого компоненту, % |
|---|---|---|---|
| Вода | 93 | 67 | 33 |
| Оцтова кислота | 114,65 | 34 | 66 |
| Масляна кислота | 35,8 | 96 | 4 |
| 1-Бутанол | 115,9 | 34,9 | 65,1 |
Отримання
Майже увесь промислово отримуваний етилбензен синтезується шляхом алкілювання бензену етиленом. Протягом кількох десятиліть як каталізатор реакції застосовували кислоти Льюїса, наприклад, розчинений хлорид алюмінію:
Попри те, що використання AlCl3 є доцільним з боку загальної вартості виробництва, нині стрімко зростають витрати на утилізацію утворюваних відходів. На додачу цього, синтез за цим метод призводить до незначного пошкодження реакторів і трубопроводів через корозію. У 1980-х роках замість хлориду алюмінію почали використовувати каталізатори на основі цеолітів.
Алкілювання кислотами Льюїса
Рідкофазний синтез етилбензену за участі хлориду алюмінію був запроваджений у 1930-х роках. Варіації цього методу запровадили на підприємствах BASF, Monsanto, Dow Chemical та інших.
Алкілювання бензену етиленом є вкрай екзотермічним процесом (ΔH=-114 кДж/моль)[5], у присутності AlCl3 реакція відбувається дуже швидко, із майже стехіометричним виходом етилбензену. Окрім хлориду алюмінію, також застосовувалися й інші кислоти Льюїса: AlBr3, FeCl3, ZrCl4, BF3. У випадку хлориду алюмінію, як промотори використовують хлороетан або хлороводень — ці галогеніди зменшують кількість AlCl3, необхідну для перебігу процесу.
У процесі виробництва суміш рідкого бензену та розчиненого каталізатору безперервно подають у реактор і перемішують для досягнення рівномірного розподілу. Згодом до суміші впорскуються етилен і промотуючі добавки. Ступінь перетворення етилену сягає 100 %. Поширеним молярним співвідношенням етилен: бензен є 0,3—0,35. Якщо співвідношення зрушиться у напрямку збільшення, зросте ймовірність перебігу побічних реакцій — трансалкілювання та ізомерного перегрупування. Подальше алкілювання бензену веде до зворотнього утворення поліалкілбензенів, які, для мінімізації втрат у виробництві, повертають у реактор.
Типовою температурою для проведення синтезу є 130 °C. Її підвищення призводить до зменшення активності каталізатора та утворення поліалкілбензентів і неароматичних сполук. Значення тиску у реакційній системі підбираються для витримування реагентів у рідкій фазі. Іншим важливим моментом є наявність води у реакторі: окрім спричинення корозійних процесів, вона також суттєво знижує активність каталізатора, тому перед введенням бензену в реакцію проводиться його зневоднення.
Після завершення взаємодії суміш продуктів і каталізатору, виводиться з реактору та охолоджується, а каталізатор відділяється з органічної фази декантацією й направляється на повторний цикл. Органічна фаза промивається водою та лугами для очищення її від залишків розчиненого хлориду алюмінію (утворена водна фаза, що містить розчинений AlCl3 та малорозчинний Al(OH)3, далі направляється на відновлення).
Очищення етилбензену зазвичай здійснюється у трьох дистиляційних колонах:
- у першій колоні відділяється легкокиплячий бензен, що не прореагував;
- у другій етилбензен відділяється від важчих поліалкілбензенів;
- у третій колоні із залишкових поліалкілбензенів з другої стадії відділяються сполуки, що піддаються переробці, від важких, переважно поліциклічних, які спалюються у вигляді палива.
Компанією Monsanto була запропонована модифікація методу, котра полягала у зменшенні кількості хлориду алюмінію до мінімально необхідного значення (що позитивно вплинуло на кількість утворюваних відходів) та підвищення температури в реакторі (до 160—180 °C). Ріст температури надає ще одну перевагу — можливість проведення синтезу за низького тиску етилену.
У 1960-х роках був запропонований метод із використанням флуориду бору, однак він не мав значного поширення через значний перебіг корозійних процесів. Попри це метод має суттєві переваги: продуктом виробництва є етилбензен високої чистоти, а як вихідну сировину можна використовувати неконцентрований етилен. Алкілювання проводиться за високого тиску (2,3—2,5 МПа) і низької температури (100—150 °C). Зневоднений бензен, етилен і BF3 подаються у реактор, із типовим молярним співвідношенням етилен: бензен близько 0,15—0,2. На відміну від першого процесу, тут трансалкілювання за участі сухого бензену, поліалкілбензенів та каталізатору проводиться в окремому реакторі, за вищої температури (180—230 °C).
Поєднані з обох реакторів продукти подаються на три дистиляційні колони, де першими відділяються бензен та інші легколеткі вуглеводні, BF3. Залишок від першої колони подається у другу, де відділяється етилбензен із чистотою >99,9 %. Кінцева колона слугує для виділення вуглеводнів, які піддаються переробці.
Метод може використовувати будь-яку етиленовмісну сировину, що містить принаймні 8—10 % етилену (сировину від переробки нафти, коксовий газ тощо). Однак, для такої сировини пред'являються особливі вимоги чистоти: вона не повинна містити води, сірчистих газів та киснемісних сполук, які отруюють каталізатор.
Алкілювання цеолітами

Перший метод алкілювання бензену в присутності цеолітів (алюмосилікатів) було розроблено 1970-х роках. Базовим каталізатором тоді був цеоліт ZSM-5.
Алкілювання проводиться у двох варіаціях: газофазній та рідкофазній.
Газофазний процес
Алкілювання проводиться за температури 350—450 °C і тиску 1—3 МПа. Для проведення реакції важливим є значний надлишок бензену у системі.
Каталізатор поступово деактивується, перетворюючись на кокс, тому він потребує періодичного оновлення для регенерації. Регенерація in situ триває близько 36 годин і є необхідною після 18—24 місяців роботи каталізатору. Він є чутливим до дії води, сірковмісних сполук та інших каталітичних отрут.
Газуваті продукти реакції аналогічно до методу з кислотами Льюїса подаються на дистиляційні колони, до спершу виділяється бензен, згодом етилбензен, а від залишку алкіл- та поліалкілбензенів відділяють вуглеводні, котрі піддаються переробці. Решту важких вуглеводнів (переважно дифенілметан, дифенілетан) спалюють як паливо.
Рідкофазний процес
Впровадження рідкофазного алкілювання вперше відбулося у 1990 році на заводі однієї з дочірніх компаній Nippon Steel.
Взаємодія проводиться при температурах, що не перевищують критичне значення для бензену (239 °C). Корекція тиску в реакторі здійснюється таким чином, щоб усі легкі гази знаходилися у розчині (близько 4 МПа).
Продукти реакції розділяють на дистиляційних колонах: легкокиплячий бензен виділяється і повторно подається в реакційну систему, у другій колоні виділяється етилбензен, а решта (алкілбензени та поліетилбензени) подається на третю колону, де проходить розділення важких вуглеводнів, які частково повертаються на трансалкілювання.
Окрім бензену, основними домішками тут є неароматичні сполуки (нафтени), толуен, вищі алкілбензени.
Виділення з сумішей C8
Близько 1 % отримуваного етилбензену синтезують переробкою сировини при виробництві ксиленів. В основному виділення відбувається шляхом перегонки, котра, через складність її проведення, дістала назву суперфракціонування. Зростання вартость енергоносіїв не надало цьому методу вагомого поширениня.
Лабораторні методи
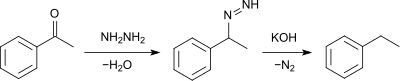
Етилбензен можна синтезувати за одним з варіантів реакції Вюрца:
Ефективним є синтез за реакцією Корі — Хауса, котра відбувається у м'якших умовах і не супроводжується утворенням побічних продуктів
Також застосовується глибоке відновлення оксосполук (бензальдегіду, бензойної кислоти) за реакцією Кіжнера — Вольфа:
Хімічні властивості
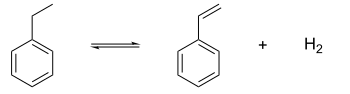
Найбільше значення з усіх властивостей етилбензену має дегідрогенізація, котра веде до утворення промислово важливого стирену:
Реакцію проводять за температури 600—660 °C у присутності каталізатору — оксиду заліза(III), промотованого калієм. До побічних реакцій відноситься деалкілювання з утворенням бензену або толуену.
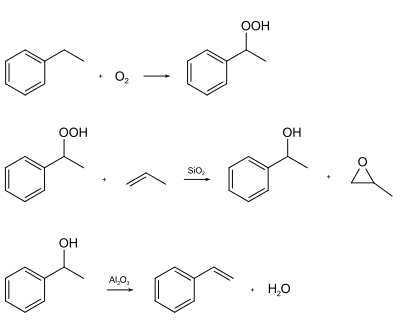
У рідкій фазі етилбензен може окиснюватися повітрям із утворенням гідропероксиду. Однак вони є нестійким і при незначному підвищенні температури розкладається. Даний гідропероксид також є сировиною для отримання стирену (за участі пропілену):
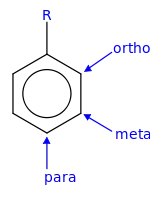
Наявна у бензеновому кільці етильна група є орієнтантом першого роду, тому приєднання до кільця інших функціональних груп здійснюються у пара- та орто-положення, із переважанням першого:
Окисненням етилбензену у присутності каталізатору ацетату марганцю отримують ацетофенон:
Токсичність
Етилбензен легко сорбується після вдихання, проковтування, а також при контакті зі шкірою. Його метаболізм, ймовірно, проходить через стадії окиснення у бічні ланцюги, про що свідчить наявність 2-фенілетанолу та 4-фенілетанолу у сечі уражених етилбензеном.[6]
Короткотривала дія етилбензену може призводити до подразнення дихальних шляхів, болю в грудях, подразнення очей та запаморочення. Довготривала дія спричинює порушення нормального функціонування нирок і печінки, про що свідчать результати тестування на тваринах. Етилбензен не є канцерогеном. [7]
Застосування
Абсолютна більшість отримуваного етилбензену використовується у виробництві стирену — промислово важливого мономеру для отримання полістирену. Незначна частка (менше 1 %) етилбензену застосовується у лакофарбовій промисловості як розчинник. Також він є вихідної сировиною для синтезу ацетофенону, діетилбензену, етилантрахінону. Етилбензен є антидетонаційною добавкою до моторного палива для збільшення його октанового числа.
Примітки
- IUPAC Provisional Recommendations. — 2004. — P. 170. (англ.)
- За тиску 101,3 кПа.
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Оскільки реакція є сильноекзотермічною, деякі елементи реактору облицюють матеріалами з великою теплоємністю, на кшталт цегли.
- Welch, Vincent A., Fallon, Kevin J., Gelbke, Heinz-Peter. Ethylbenzene // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Ethylbenzene. Hazard Summary. epa.gov. United States Environmental Protection Agency. квітень 1993. Процитовано 4 липня 2015. (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Welch, Vincent A., Fallon, Kevin J., Gelbke, Heinz-Peter. Ethylbenzene // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
- Химический энциклопедический словарь / Под ред. И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)