Щільні контакти
Щільні контакти (англ. tight junctions) — замикальні міжклітинні контакти хребетних тварин, у складі яких мембрани сусідніх клітин максимально зближені і «зшиті» спеціалізованими білками клаудинами та оклюдинами. Поширені в епітеліальних тканинах, де складають найбільш апікальну частину (лат. zonula occludens) комплексу контактів між клітинами, до якого також входять адгезивні контакти та десмосоми. Щільні контакти побудовані із кількох стрічок, що оперізують клітину і перетинаючись між собою утворюють сіткоподібну мережу. Із цитоплазматичної сторони асоційовані із актиновими філаментами[1][2].
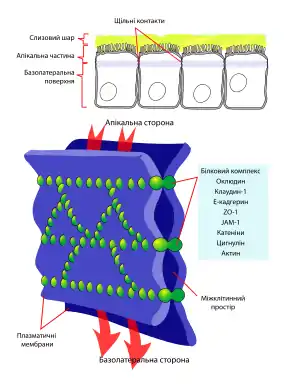
Епітеліальні тканини виконують бар’єрну і транспортну функції, для цього вони повинні бути здатними пропускати одні речовини і затримувати інші. Таку вибіркову проникність успішно забезпечують клітинні мембрани, проте між клітинами залишаються проміжки, через які може проходити так званий парацелюлярний (параклітинний) транспорт. Роль щільних контактів полягає у тому, щоб обмежувати і регулювати параклітинну дифузію: вони запобігають протіканню тканинної рідини через епітелій, але за необхідності можуть бути проникними для іонів, невеликих гідрофільних молекул і навіть макромолекул. Також щільні контакти виконують так звану функцію «загорожі», вони запобігають дифузії компонентів мембрани у її зовнішньому листку, завдяки чому підтримується різниця у складі апікальної та базолатеральної мембран. Щільні контакти задіяні у сигнальних шляхах, що регулюють проліферацію, поляризацію та диференціацію епітеліальних клітин[3].
Аналогом щільних контактів у безхребетних є септовані контакти[1].
Будова і молекулярний склад


.
Щільні контакти складаються із тонких стрічок, що перетинаючись між собою, повністю оперізують клітину і контактують із аналогічними стрічками на сусідніх клітинах. На електронних мікрофотографіях помітно, що в ділянках щільних контактів мембрани дотикаються одна до одної або навіть зливаються. Комбінація методу заморожування-сколювання із високороздільною електронною мікроскопією дозволила встановити, що стрічки щільних контактів побудовані зі білкових частинок діаметром 3—4 нм, які виступають з обидвох поверхонь мембрани. Також на користь того, що в утворенні щільних контактів ключову роль відіграють білки свідчить розділення клітин під дією протеолітичного ферменту трипсину[2].
Всього до складу щільних контактів входить близько 40 різних білків як мембранних так цитоплазматичних. Останні необхідні для прикріплення актинових філаментів, регуляції та сигналювання[3].
Мембранні білки
Мембранні білки щільних контактів можна поділити на дві групи: ті, що перетинають мембрану 4 рази, і ті, що перетинають її тільки раз. Перша група значно поширеніша, до неї входять білки клаудини, оклюдини та трицелюлін. Вони мають спільні риси будови, зокрема у них наявні чотири α-спіральні трасмембранні домени, N- і С-кінці повернуті до цитозолю, а домени, що виступають у міжклітинний простір беруть участь у гомо- або гетерофільних взаємодіях із подібними білками не сусідній клітині[3].
Основними білками щільних контактів є клаудини (від лат. claudo — закривати). Їхня роль була продемонстрована на прикладі мишей із відсутнім геном клаудину-1, в епідермі таких тварин не формуються щільні контакти і вони гинуть впродовж дня після народження через зневоднення внаслідок інтенсивного випаровування[1]. Клаудини також беруть участь у формуванні селективних каналів для транспорту іонів. В геномі людини є гени принаймні 24 різних клаудинів, експресія яких відбувається тканиноспецифічно[3].
Друге місце за поширеністю у щільних контактах займають білки оклюдини (від лат. occludo — закривати), вони регулюють транспорт маленьких гідрофільних молекул і проходження нейтрофілів через епітелій[3]. Найбільші концентрації третього білка — трицелюліну, спостерігаються у місцях контакту трьох клітини[1].
До білків щільних контактів, що перетинають мембрану один раз, належать JAM-A, -B, -C і -D (англ. junctional adhesion molecules) та споріднені з ними CAR (англ. coxsackievirus and adenovirus receptor), CLMP (англ. CAR-like membrane protein) та ESAM (англ. endothelial-cell selective adhesion molecule), що мають по два імуноглобулінові домени, а також білки CRB3 (англ. Crumbs homologue 3) та BVES[3].
Цитоплазматичні білки
Цитоплазматична пластинка щільних контактів необхідна для їх приєднання до актинових філаментів, регуляції зчеплення клітин і параклітинного транспорту, а також для передачі сигналів від поверхні всередину клітини. До її складу входять адаптерні, каркасні і цитоскелетні білки, а також елементи сигнальних шляхів (кінази, фосфатази). Найбільш вивчений білок цитоплазматичної пластинки — ZO-1, він має кілька доменів білок-білкової взаємодії, кожен із яких забезпечує контакт з іншими компонентами, зокрема три PDZ-домени (англ. PSD95–DlgA–ZO-1) — із клаудинами та іншими адаптерними білками — ZO-2 та ZO-3, GUK-домен (англ. guanylate kinase homology) — з оклюдинами, а SH3 домен — із сигнальними білками[3].
Із цитоплазматичною стороною щільних контактів також асоційовані комплекси білків PAR3/PAR6 та Pals1/PATJ, необхідні для встановлення полярності клітин та епітеліального морфогенезу[3].
Функції
Перші дослідження функцій щільних контактів призвели до уявлення, що це статичні непроникні структури, потрібні для того, щоб обмежити дифузію речовин між клітинами. Згодом було з'ясовано, що вони є вибірково проникними, до того ж їхня пропускна здатність відрізняється в різних тканинах і може регулюватись[4]. Також встановлена ще одна функція щільних контактів: роль у підтриманні полярності клітин шляхом обмеження дифузії ліпідів та білків у зовнішньому листі плазматичної мембрани. У першому десятилітті 21 століття також накопичені дані, що свідчать про участь цих структур у сигнальних шляхах, зокрема тих, що регулюють проліферацію та полярність[3].
Регулювання парацелюлярного транспорту
Непроникність щільних контактів до більшості водорозчинних сполук може бути продемонстрована у досліді із введення гідроксиду лантану (електронно густий колоїдний розчин) у кровоносні судини підшлункової залози. Через кілька хвилин після ін'єкції ацинарні клітини фіксуються і з них готуються препарати для мікроскопії. В такому випадку можна спостерігати, що гідроксид лантану дифундує із крові у простір між латеральними поверхнями клітин, але не може проникнути через щільні контакти у їх верхній частині[2]. Інші досліди показали, що щільні контакти також непроникні для солей. Наприклад при вирощуванні нирок собаки MDCK (англ. Madin-Darby canine kidney) у середовищі із дуже низькою концентрацією кальцію, вони формують моношар, проте не сполучаються між собою щільними контактами. Через такий моношар можуть вільно рухатись солі та рідини. Якщо культуру додати кальцію, то за годину формуються щільні контакти і шар стає непроникним для рідин[2].
Проте не у всіх тканинах щільні контакти є повністю непроникними, існують так звані нещільні епітелії (англ. leaky epithelia). Наприклад, епітелій тонкого кишківника пропускає в 1000 разів більше іонів Na+ ніж епітелій канальців нирок. Іони проникають через параклітинні пори діаметром 4 Å, селективні по заряду і розміру частинок, які формуються білками клаудинами[4]. Оскільки епітелії різних органів ексресують різні набори клаудинів, то відрізняється і їхня проникність для іонів. Наприклад, специфічний клаудин, присутній тільки у нирках дозволяє проходити іонам магнію у процесі реабсорбції[1].
Міжклітинний простір епітелію може бути проникним і для більших частинок, наприклад, при повторенні згаданого досліду із гідроксидом лантану на тканині епітелію тонкого кишківника кролика, можна спостерігати проходження колоїдних часточок між клітинами. Великі молекули транспортуються через спеціальні шляхи витоку (англ. leak pathway) діаметром більше 60 Å[4]. Це важливо, наприклад, для процесів всмоктування амінокислот та моносахаридів, концентрація яких у тонкому кишківнику зростає після їжі достатньо для їхнього пасивного транспорту[1].
Підтримання відмінності між апікальню та базолатеральною мембранами
Якщо у середовище, що контактує із апікальною частиною моношару MDCK клітин додати ліпосоми, що містять флуоресцентно мічені глікопротеїни, деякі з них спонтанно зливаються із клітинними мембранами. Після цього флуоресценцію можна виявити в апікальній, але не в базолатеральній частині клітин за умови цілісності щільних контактів. Якщо ж їх зруйнувати, видаливши із середовища кальцій, флуоресцентні білки дифундують і рівномірно розподіляються по всій поверхні клітини[2].
Цитозольной шар мембрани має однаковий ліпідний склад, як в апікальній так і базолатеральній ділянках, ці ліпіди можуть вільно дифундувати. З іншої сторони, ліпіди зовнішньоклітинного листка цих двох частин клітини суттєво відрізняються між собою, і обміну між ними перешкоджають щільні контакти. Наприклад всі гліколіпіди, як і білки заякорені глікозилфосфатидилінозитолом, в мембранах MDCK клітин розташовані виключно в зовнішньоклітинному листку апікальної частини, а фосфатидилхолін — майже виключно в базолатеральній частині[2].
Хвороби пов'язані зі щільними контактами
Із порушенням формування щільних контактів пов'язані деякі спадкові розлади людини, наприклад мутації у генах клаудину-16 та клаудину-19 призводять до гіпомагніємії, внаслідок надмірної втрати магнію із сечею. Мутації у гені клаудину-13 та трицелюліну спричинюють спадкову глухоту. Дисрегуляція деяких білків щільних контактів пов'язана із онкологічними захворюваннями, наприклад експресія ZO-1 та ZO-2 знижується у багатьох типах раку. Компоненти щільних контактів також можуть бути мішенями для онкогенних вірусів[3].
Деякі віруси використовують мембранні білки щільних контактів для проникнення в клітину, зокрема клаудин-1 є корецептором для вірусу гепатиту C. Інші віруси приєднуються до білків щільних контактів, щоб зруйнувати бар'єр, що відділяє їх від справжніх рецепторів на базолатеральній поврехні епітеліальних клітин, або на неепітеліальних клітинах[3].
Щільні контакти можуть бути мішенню і для бактерійних патогенів, наприклад Clostridium perfringens — збудник газової гангрени, виділяє ентеротоксин, що діє на позаклітинні домени мембранних клаудинів та оклюдинів, і спричинює протікання епітелію. Helicobacter pylori — збудник гастриту — вводить в клітини білок CagA, що взаємодіє із комплексом ZO-1-JAM-A, вважається, що це допомагає бактерії подолати захисний бар'єр шлункового епітелію[3].
Джерела
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
- Harvey Lodish et al. (2000). [http://www.ncbi.nlm.nih.gov/books/NBK21502/ 15.7 Transport across Epithelia]. Molecular Cell Biology (вид. 4th). W H Freeman. ISBN 0-7167-3136-3. — Переглянуто 20 березня 2012
- Balda MS, Matter K (2008). Tight junctions at a glance. J Cell Sci 121: 3677—82. PMID 18987354. doi:10.1242/jcs.023887.
- Shen L, Weber CR, Raleigh DR, Yu D, Turner JR (2011). Tight junction pore and leak pathways: a dynamic duo. Annu Rev Physiol. 73: 283—309. PMID 20066090. doi:10.1101/cshperspect.a002584.
Література
- Будова та молекулярний склад:
- Furuse M (2010). Molecular basis of the core structure of tight junctions. Cold Spring Harb Perspect Biol 2. PMID 20182608. doi:10.1101/cshperspect.a002907.
- Krause G, Winkler L, Mueller SL, Haseloff RF, Piontek J, Blasig IE (2008). Structure and function of claudins. Biochim Biophys Acta 1778: 631—45. PMID 18036336. doi:10.1016/j.bbamem.2007.10.018.
- Фізіологія:
- Anderson JM, Van Itallie CM (2009). Physiology and function of the tight junction. Cold Spring Harb Perspect Biol 2. PMID 20936941. doi:10.1146/annurev-physiol-012110-142150.
- Shen L, Weber CR, Raleigh DR, Yu D, Turner JR (2011). Tight junction pore and leak pathways: a dynamic duo. Annu Rev Physiol. 73: 283—309. PMID 20066090. doi:10.1101/cshperspect.a002584.
- Van Itallie CM, Anderson JM. (2006). Claudins and epithelial paracellular transport. Annu Rev Physiol 68: 403—29. PMID 16460278. doi:10.1146/annurev.physiol.68.040104.131404.
- Регуляція:
- González-Mariscal L, Tapia R, Chamorro D (2008). Crosstalk of tight junction components with signaling pathways. Biochim Biophys Acta 1778: 729—56. PMID 17950242. doi:10.1016/j.bbamem.2007.08.018.[недоступне посилання з травня 2019]
- Tsukita S, Yamazaki Y, Katsuno T, Tamura A, Tsukita S (2008). Tight junction-based epithelial microenvironment and cell proliferation. Oncogene 55: 6930–8. PMID 19029935. doi:10.1038/onc.2008.344.
- Патофізіологія:
- Förster C (2008). Tight junctions and the modulation of barrier function in disease. Histochem Cell Biol 130: 55—70. PMID 18415116. doi:10.1007/s00418-008-0424-9.[недоступне посилання з грудня 2019]
- Turner JR (2006). Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol 169: 1901—9. PMID 17148655. doi:10.2353/ajpath.2006.060681.