Імуноглобулін E
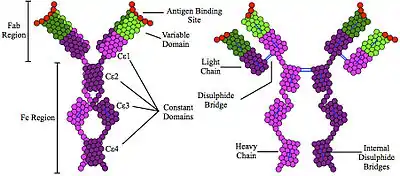
Імуноглобулін E ( IgE ) — це тип антитіла (або «ізотип» імуноглобуліну (Ig)), який був знайдений лише у ссавців. IgE синтезується плазматичними клітинами . Мономери IgE складаються з двох важких ланцюгів (ε-ланцюг) і двох легких ланцюгів, причому ε-ланцюг містить 4 Ig-подібні постійні домени (Cε1-Cε4).[1] Вважається, що IgE є важливою частиною імунної відповіді на інфекцію певними паразитичними гельмінтами, включаючи Schistosoma mansoni, Trichinella spiralis, [2] [3] і Fasciola hepatica.[4] IgE також використовується під час імунного захисту від деяких найпростіших паразитів, таких як Plasmodium falciparum.[5] В процесі еволюції IgE, можливо, розвивався як захист для захисту від отрут. [6] [7] [8]
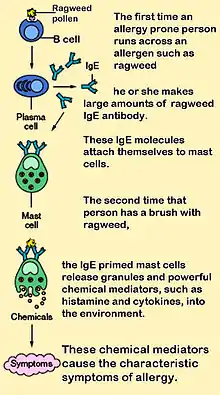
IgE також відіграє критичну роль у гіперчутливості I типу [9], яка проявляється різними алергічними захворюваннями, такими як алергічна астма, більшість типів синуситів, алергічний риніт, харчова алергія та певні типи хронічної кропив’янки та атопічного дерматиту. IgE також відіграє ключову роль у відповідях на алергени, такі як: анафілактичні реакції на ліки, укуси бджіл та антигенні препарати, що використовуються в десенсибілізаційній імунотерапії.
Хоча IgE зазвичай є найменш поширеним ізотипом — рівні IgE в сироватці крові у нормальної («неатопічної») людини становлять лише 0,05% від загальної концентрації Ig [10] порівнянні з 75% для IgG при 10 мг/мл, які є ізотипами, відповідальними за більшість класичної адаптивної імунної відповіді — він здатний викликати анафілаксію, одну з найбільш швидких і важких імунологічних реакцій. [11]
Відкриття
IgE був одночасно відкритий у 1966 та 1967 роках двома незалежними дослідницькими групами:[12] Кімісіге Ішізака та його дружина Теруко Ішізака в Інституті та лікарні дослідження дитячої астми в Денвері, штат Колорадо,[13] та Йоханссоном і Бенніхом в Упсалі, Швеція.[14] Їх спільна стаття була опублікована в квітні 1969 року [15]
Рецептори
IgE стимулює IgE-опосередковану алергічну відповідь шляхом зв’язування з рецепторами Fc, які знаходяться на поверхні тучних клітин і базофілів. Fc-рецептори також виявлені на еозинофілах, моноцитах, макрофагах і тромбоцитах у людей. Існує два типи Fcε-рецепторів:
- FcεRI (рецептор Fcε типу I), високоафінний рецептор IgE
- FcεRII (рецептор Fcε типу II), також відомий як CD23, низькоафінний рецептор IgE
IgE може посилювати експресію обох типів рецепторів Fcε. FcεRI експресується на тучних клітинах, базофілах та дендритних клітинах, що презентують антиген, як у мишей, так і у людей. Зв’язування антигенів з IgE, уже зв’язаним FcεRI на тучних клітинах, викликає перехресний зв'язок вже зв’язаного IgE та агрегацію основного FcεRI, що призводить до дегрануляції (вивільнення медіаторів) та секреції кількох типів цитокінів типу 2, таких як інтерлейкін (IL)-3 і фактор стовбурових клітин (SCF), які допомагають тучним клітинам виживати і накопичуватися в тканинах, а також IL-4, IL-5, IL-13 і IL-33, які, у свою чергу, активують вроджені лімфоїдні клітини групи 2 (ILC2 або природні клітини-хелпери). Базофіли з тучними клітинами мають загального гемопоетичного попередника; при перехресному зв'язку їх поверхневого зв’язаного IgE антигенами також вивільняють цитокіни 2 типу, включаючи IL-4 та IL-13, та інші медіатори запалення. Низькоафінний рецептор (FcεRII) завжди експресується на В-клітинах; але IL-4 може індукувати його експресію на поверхнях макрофагів, еозинофілів, тромбоцитів і деяких Т-клітин.[16] [17]
Функція
Паразитарна гіпотеза
Ізотип IgE спільно еволюціонував з базофілами та тучними клітинами для захисту від паразитів, таких як гельмінти (наприклад, шистосома), але також може бути ефективним при бактеріальних інфекціях. Епідеміологічні дослідження показують, що рівень IgE підвищується при зараженні людини Schistosoma mansoni,[18] Necator americanus,[19] і нематодами [20]. Також IgE, швидше за все, допомагає видаленню анкілостом з легенів.
Токсинова гіпотеза алергічного захворювання
У 1981 році Марджі Профет припустила, що алергічні реакції розвивалися як остання лінія захисту для захисту від отрут.[6] Хоча ця гіпотеза на той час була суперечливою, нова робота підтверджує деякі думки Профет про адаптаційну роль алергії як захисту від токсинів.[7]
У 2013 році з’ясувалося, що IgE відіграють важливу роль у набутій стійкості до отрут медоносних бджіл [8] та гадюки Рассела.[8] [21] Автори дійшли висновку, що «невелика доза бджолиної отрути надає імунітет до значно більшої, смертельної дози» і «такий вид специфічної для отрути, пов’язаної з IgE, адаптивної імунної відповіді розвинувся, принаймні в еволюційному плані, щоб захистити хазяїна від потенційно токсичні кількості отрути, наприклад, якщо тварина зіткнеться з цілим гніздом бджіл, або в разі укусу змії».[8] [22] [23] Основний алерген бджолиної отрути (фосфоліпаза А2) викликає імунну відповідь T-хелперів 2-го типу, пов’язану з виробленням антитіл IgE, які можуть «підвищити стійкість мишей до зараження потенційно смертельними дозами токсина».[24]
Рак
Хоча це ще недостатньо вивчене, IgE може відігравати важливу роль у розпізнаванні злоякісних пухлин [25] при якому можлива стимуляція сильної цитотоксичної відповіді проти клітин, які "демонструють" лише невелику кількість ранніх маркерів раку. Якщо ця гіпотеза вірна, лікування препаратами проти IgE, таке як омалізумаб (для лікування алергії), теоретично може мати деякі небажані побічні ефекти. Однак недавнє дослідження, яке було проведено на основі сукупного аналізу з використанням вичерпних даних із 67 клінічних випробувань фази I–IV омалізумабу за різними показаннями, прийшло до висновку, що причинний зв’язок між терапією омалізумабом та злоякісними новоутвореннями є малоймовірним.[26]
Роль у захворюванні
У людей з атопією рівень IgE в крові може в десять разів перевищувати нормальний рівень (як і у хворих на синдром гіпер-IgE ). Однак це може не бути обов’язковою умовою для появи симптомів, як це спостерігається у астматиків з нормальним рівнем IgE в крові — нещодавні дослідження показали, що вироблення IgE може відбуватися локально в слизовій оболонці носа.[27]
IgE, який може специфічно розпізнати алерген (як правило, це білок, наприклад пилового кліща Der p 1, котячий білок Fel d 1, пилок трав або амброзії тощо), має унікальну довготривалу взаємодію зі своїм високоафінним рецептором FcεRI, тому що базофіли і тучні клітини, здатні опосередковувати запальні реакції, стають «підготовленими», щоб виділяти хімічні речовини, такі як гістамін, лейкотрієни та певні інтерлейкіни. Вказані хімічні речовини (медіатори) викликають багато симптомів, які ми пов’язуємо з алергією, таких як звуження дихальних шляхів при астмі, місцеве запалення при екземі, посилене виділення слизу при алергічному риніті та підвищена проникність судин (необхідне для переходу у тканини інших імунних клітин), яке може призвести до потенційно смертельного падіння артеріального тиску (колапс), як при анафілаксії.
Відомо, що рівень IgE підвищується при різних аутоімунних захворюваннях, таких як системний червоний вовчак (СЧВ), ревматоїдний артрит (РА) і псоріаз, і, теоретично, має патогенетичне значення при СЧВ і РА, викликаючи реакцію гіперчутливості.[28] [29]
Вважається, що регуляція рівня IgE за допомогою контролю диференціювання В-клітин у плазматичні клітини, що секретують антитіла, включає «низькоафінний» рецептор FcεRII або CD23.[30] CD23 також може забезпечувати полегшену презентацію антигену - IgE-залежний механізм, за допомогою якого В-клітини, що експресують CD23, здатні презентувати алерген (і стимулювати) специфічні Т-хелпери, викликаючи збереження відповіді Th2, однією з ознак якої є вироблення більшої кількості антитіл. [31]
Роль в діагностиці
Діагностика алергії найчастіше проводиться шляхом вивчення історії хвороби людини та виявлення позитивного результату на наявність алерген-специфічного IgE при проведенні шкірного або аналізу крові.[32] Тест на специфічний IgE є перевіреним тестом для виявлення алергії. Немає доказів, що невибіркове тестування на IgE або тест на імуноглобулін G (IgG) може підтвердити діагноз алергії.[33]
Ліки, спрямовані на IgE-шлях
В даний час алергічні захворювання та астму зазвичай лікують одним або кількома з наступних препаратів: (1) антигістамінні та антилейкотрієнні, які є антагоністами медіаторів запалення гістаміну і лейкотрієнів, (2) місцеві або системні (пероральні або ін’єкційні) кортикостероїди, які пригнічують широкий спектр запальних механізмів, (3) бронходилататори короткої або тривалої дії, які розслаблюють гладку мускулатуру звужених дихальних шляхів при астмі, або (4) стабілізатори тучних клітин, які пригнічують дегрануляцію тучних клітин, яка зазвичай ініціюється зв’язуванням IgE до FcεRI. Відомо, що тривале застосування системних кортикостероїдів викликає багато серйозних побічних ефектів, і їх рекомендується уникати, якщо доступні альтернативні методи лікування.
Сам IgE, шлях синтезу IgE та IgE-опосередкований алергічний/запальний шлях є важливими мішенями для втручання в патологічні процеси при алергії, астмі та інших IgE-опосередкованих захворюваннях. Шлях диференціювання та дозрівання В-лімфоцитів, які в кінцевому підсумку генерують плазматичні клітини, що секретують IgE, проходить проміжні етапи: В-лімфобласти, що експресують IgE, взаємодія з В-клітинами пам’яті, що експресують IgE.
Tanox, біотехнологічна компанія, що базується в Х'юстоні, штат Техас, запропонувала в 1987 році, що шляхом націлювання на мембранно-зв'язаний IgE (mIgE) на В-лімфобластах і В-клітинах пам'яті ці клітини можна лізувати або регулювати, таким чином, досягаючи пригнічення виробництва антиген-специфічних IgE і, отже, зсуву імунного балансу в бік не-IgE механізмів.[34]
Було розроблено два підходи, спрямовані на шлях IgE, які перебувають в активній розробці. У першому підході, анти-IgE антитіло омалізумаб (торгова назва Xolair) розпізнає, IgE, не пов'язаний зі своїми рецепторами, нейтралізує існуючий IgE і не допускає його зв'язування з рецепторами на тучних клітинах і базофілах. Xolair був схвалений у багатьох країнах для лікування важкої, стійкої алергічної астми. Він також був схвалений у березні 2014 року в Європейському Союзі [35] та США [36] для лікування хронічної спонтанної кропив’янки, яку неможливо адекватно лікувати анти-H1 препаратами.
За другим підходом були отримані антитіла, специфічні для домену з 52 амінокислотних залишків, які називають CεmX або M1' (M1 prime), присутні лише на людському mIgE на В-клітинах, але не на вільному розчинному IgE. Проводились клінічні розробки з лікування алергії та астми.[37] [38] Клінічні дослідження гуманізованого антитіла проти М1' (квілізумаб) проходять фазу IIb клінічних випробувань. [39] [40]
У 2002 році дослідники з Відділу клітинної та молекулярної біофізики Рендалла визначили структуру IgE.[41] Розуміння цієї структури (яка є нетиповою для інших ізотипів, оскільки вона сильно зігнута та асиметрична) та взаємодії IgE з рецептором FcεRI дозволить розробити нове покоління ліків від алергії, які перешкоджатимуть взаємодії IgE-рецептор. Можливо, з'являться методи лікування, дешевші, ніж моноклональні антитіла (наприклад, маломолекулярні препарати), які використовують подібний підхід для інгібування зв’язування IgE з його рецептором.
Примітки
- Antibody structure. Архів оригіналу за September 6, 2008.
- Helminths, allergic disorders and IgE-mediated immune responses: where do we stand?. European Journal of Immunology 37 (5): 1170–3. May 2007. PMID 17447233. doi:10.1002/eji.200737314. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - IgE: a question of protective immunity in Trichinella spiralis infection. Trends in Parasitology 21 (4): 175–8. April 2005. PMID 15780839. doi:10.1016/j.pt.2005.02.010. Проігноровано невідомий параметр
|vauthors=(довідка) - IgE production in rat fascioliasis. Parasite Immunology 5 (6): 587–93. November 1983. PMID 6657297. doi:10.1111/j.1365-3024.1983.tb00775.x. Проігноровано невідомий параметр
|vauthors=(довідка) - Total and functional parasite specific IgE responses in Plasmodium falciparum-infected patients exhibiting different clinical status. Malaria Journal 6: 1. January 2007. PMC 1781948. PMID 17204149. doi:10.1186/1475-2875-6-1. Проігноровано невідомий параметр
|vauthors=(довідка) - The function of allergy: immunological defense against toxins. The Quarterly Review of Biology 66 (1): 23–62. March 1991. PMID 2052671. doi:10.1086/417049. Проігноровано невідомий параметр
|vauthors=(довідка) - Allergic host defences. Nature 484 (7395): 465–72. April 2012. Bibcode:2012Natur.484..465P. PMC 3596087. PMID 22538607. doi:10.1038/nature11047. Проігноровано невідомий параметр
|vauthors=(довідка) - A beneficial role for immunoglobulin E in host defense against honeybee venom. Immunity (англ.) 39 (5): 963–75. November 2013. PMC 4164235. PMID 24210352. doi:10.1016/j.immuni.2013.10.005. Проігноровано невідомий параметр
|vauthors=(довідка) - The biology of IGE and the basis of allergic disease. Annual Review of Immunology 21: 579–628. 2003. PMID 12500981. doi:10.1146/annurev.immunol.21.120601.141103. Проігноровано невідомий параметр
|vauthors=(довідка) - Immunoglobulin E: importance in parasitic infections and hypersensitivity responses. Archives of Pathology & Laboratory Medicine 124 (9): 1382–5. September 2000. PMID 10975945. doi:10.5858/2000-124-1382-IE. Проігноровано невідомий параметр
|vauthors=(довідка) - Reber, LL; Hernandez, JD; Galli, SJ (August 2017). The pathophysiology of anaphylaxis.. The Journal of Allergy and Clinical Immunology 140 (2): 335–348. PMC 5657389. PMID 28780941. doi:10.1016/j.jaci.2017.06.003.
- The discovery of IgE. Allergy 48 (2): 67–71. February 1993. PMID 8457034. doi:10.1111/j.1398-9995.1993.tb00687.x. Проігноровано невідомий параметр
|vauthors=(довідка) - Physico-chemical properties of human reaginic antibody. IV. Presence of a unique immunoglobulin as a carrier of reaginic activity. Journal of Immunology 97 (1): 75–85. July 1966. PMID 4162440. Проігноровано невідомий параметр
|vauthors=(довідка) - Immunological studies of an atypical (myeloma) immunoglobulin. Immunology 13 (4): 381–94. October 1967. PMC 1409218. PMID 4168094. Проігноровано невідомий параметр
|vauthors=(довідка) - Histamine release from human leukocytes by anti-gamma E antibodies. Journal of Immunology 102 (4): 884–92. April 1969. PMID 4181251. Процитовано 29 лютого 2016. Проігноровано невідомий параметр
|vauthors=(довідка) - The CD23a and CD23b proximal promoters display different sensitivities to exogenous stimuli in B lymphocytes. Genes and Immunity 3 (3): 158–64. May 2002. PMID 12070780. doi:10.1038/sj.gene.6363848. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - IgE receptors. Current Opinion in Immunology 13 (6): 721–6. December 2001. PMID 11677096. doi:10.1016/s0952-7915(01)00285-0. Проігноровано невідомий параметр
|vauthors=(довідка) - Evidence for an association between human resistance to Schistosoma mansoni and high anti-larval IgE levels. European Journal of Immunology 21 (11): 2679–86. November 1991. PMID 1936116. doi:10.1002/eji.1830211106. Проігноровано невідомий параметр
|vauthors=(довідка) - Immunity in humans to Necator americanus: IgE, parasite weight and fecundity. Parasite Immunology 17 (2): 71–5. February 1995. PMID 7761110. doi:10.1111/j.1365-3024.1995.tb00968.x. Проігноровано невідомий параметр
|vauthors=(довідка) - Allergen-specific IgE and IgG4 are markers of resistance and susceptibility in a human intestinal nematode infection. Microbes and Infection 7 (7–8): 990–6. June 2005. PMID 15961339. doi:10.1016/j.micinf.2005.03.036. Проігноровано невідомий параметр
|vauthors=(довідка) - IgE antibodies, FcεRIα, and IgE-mediated local anaphylaxis can limit snake venom toxicity. The Journal of Allergy and Clinical Immunology 137 (1): 246–257.e11. January 2016. PMC 4715494. PMID 26410782. doi:10.1016/j.jaci.2015.08.005. Проігноровано невідомий параметр
|vauthors=(довідка) - Sharlach, Molly (24 жовтня 2013). Bee sting allergy could be a defense response gone haywire, scientists say. Stanford Medicine News Center. Процитовано 20 листопада 2019.
- Foley, James A. (25 жовтня 2013). Severe Allergies to Bee Stings may be Malfunctioning Evolutionary Response. Nature World News.
- Testing the 'toxin hypothesis of allergy': mast cells, IgE, and innate and acquired immune responses to venoms. Current Opinion in Immunology 36: 80–7. October 2015. PMC 4593748. PMID 26210895. doi:10.1016/j.coi.2015.07.001. Проігноровано невідомий параметр
|vauthors=(довідка) - Activity of human monocytes in IgE antibody-dependent surveillance and killing of ovarian tumor cells. European Journal of Immunology 33 (4): 1030–40. April 2003. PMID 12672069. doi:10.1002/eji.200323185. Проігноровано невідомий параметр
|vauthors=(довідка) - Omalizumab and the risk of malignancy: results from a pooled analysis. The Journal of Allergy and Clinical Immunology 129 (4): 983–9.e6. April 2012. PMID 22365654. doi:10.1016/j.jaci.2012.01.033. Проігноровано невідомий параметр
|vauthors=(довідка) - Allergen drives class switching to IgE in the nasal mucosa in allergic rhinitis. Journal of Immunology 174 (8): 5024–32. April 2005. PMID 15814733. doi:10.4049/jimmunol.174.8.5024. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - The prevalence of IgE antinuclear antibodies in rheumatoid arthritis and systemic lupus erythematosus. Acta Pathologica et Microbiologica Scandinavica, Section C 86C (5): 245–9. October 1978. PMID 309705. doi:10.1111/j.1699-0463.1978.tb02587.x. Проігноровано невідомий параметр
|vauthors=(довідка) - Serum IgE concentrations, disease activity, and atopic disorders in systemic lupus erythematosus. Allergy 50 (1): 94–6. January 1995. PMID 7741196. Проігноровано невідомий параметр
|vauthors=(довідка) - CD23: an overlooked regulator of allergic disease. Current Allergy and Asthma Reports 7 (5): 331–7. September 2007. PMID 17697638. doi:10.1007/s11882-007-0050-y. Проігноровано невідомий параметр
|vauthors=(довідка) - Facilitated antigen presentation and its inhibition by blocking IgG antibodies depends on IgE repertoire complexity. The Journal of Allergy and Clinical Immunology 127 (4): 1029–37. April 2011. PMID 21377718. doi:10.1016/j.jaci.2011.01.062. Проігноровано невідомий параметр
|vauthors=(довідка) - Pearls and pitfalls of allergy diagnostic testing: report from the American College of Allergy, Asthma and Immunology/American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force. Annals of Allergy, Asthma & Immunology 101 (6): 580–92. December 2008. PMID 19119701. doi:10.1016/S1081-1206(10)60220-7. Проігноровано невідомий параметр
|vauthors=(довідка) - American Academy of Allergy, Asthma, and Immunology. Five Things Physicians and Patients Should Question. Choosing Wisely: An Initiative of the ABIM Foundation. Архів оригіналу за 3 листопада 2012. Процитовано 14 серпня 2012.
- Anti-IgE antibodies for the treatment of IgE-mediated allergic diseases. Adv. Immunol. Advances in Immunology 93. 2007. с. 63–119. ISBN 9780123737076. PMID 17383539. doi:10.1016/S0065-2776(06)93002-8.
- Novartis announces Xolair® approved in EU as first and only licensed therapy for chronic spontaneous urticaria (CSU) patients unresponsive to antihistamines. Novartis. 6 березня 2014. Архів оригіналу за 18 грудня 2014. Процитовано 4 грудня 2014.
- Novartis announces US FDA approval of Xolair® for chronic idiopathic urticaria (CIU). Novartis. 21 березня 2014. Архів оригіналу за 3 грудня 2014. Процитовано 4 грудня 2014.
- Unique epitopes on C epsilon mX in IgE-B cell receptors are potentially applicable for targeting IgE-committed B cells. Journal of Immunology 184 (4): 1748–56. February 2010. PMID 20083663. doi:10.4049/jimmunol.0902437. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - Antibodies specific for a segment of human membrane IgE deplete IgE-producing B cells in humanized mice. The Journal of Clinical Investigation 120 (6): 2218–29. June 2010. PMC 2877936. PMID 20458139. doi:10.1172/JCI40141. Проігноровано невідомий параметр
|vauthors=(довідка) - MEMP1972A. ClinicalTrials.gov. U.S. National Institutes of Health. Процитовано 4 грудня 2014.
- Targeting membrane-expressed IgE B cell receptor with an antibody to the M1 prime epitope reduces IgE production. Science Translational Medicine 6 (243): 243ra85. July 2014. PMID 24990880. doi:10.1126/scitranslmed.3008961. Проігноровано невідомий параметр
|vauthors=(довідка) - The crystal structure of IgE Fc reveals an asymmetrically bent conformation. Nature Immunology 3 (7): 681–6. July 2002. PMID 12068291. doi:10.1038/ni811. Проігноровано невідомий параметр
|vauthors=(довідка)