Гармін
Гармін — бета-карболіновий алкалоїд, вперше виділений із гармали (Peganum harmala). Трапляється в ряді різних рослин, зокрема в ребрику звичайному та Banisteriopsis caapi.[2] Гармін оборотно пригнічує моноаміноксидазу А (МАО-А), фермент, який розщеплює моноаміни, таким чином він є інгібітором моноаміноксидази. Гармін не інгібує МАО-В.[3]
| Гармін | |
|---|---|
 | |
| Назва за IUPAC | 7-Метокси-1-метил-9H |
| Ідентифікатори | |
| Номер CAS | 442-51-3 |
| PubChem | 5280953 |
| Номер EINECS | 207-131-4 |
| DrugBank | DB07919 |
| KEGG | C06538 |
| ChEBI | 28121 |
| SMILES |
COc1ccc2c(c1)[nH]c3c(C)nccc23 |
| InChI |
1/C13H12N2O/c1-8-13-11(5-6-14-8)10-4-3-9(16-2)7-12(10)15-13/h3-7,15H,1-2H3 |
| Номер Бельштейна | 178813 |
| Властивості | |
| Молекулярна формула | C13H12N2O |
| Молярна маса | 212,25 г/моль |
| Тпл | 321 |
| Розчинність (вода) | нерозчинний[1] |
| Розчинність (Диметилсульфоксид) | 100мМ[1] |
| Розчинність (Етанол) | 1 мг/мл[1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Біосинтез
Випадкові знаходження β-карболінових алкалоїдів та серотоніну в Peganum harmala вказують на наявність двох дуже схожих взаємопов'язаних біосинтетичних ланцюжків, що ускладнює остаточне визначення, чи вільний триптамін чи L-триптофан є прекурсором у біосинтезі гарміну.[4] Однак передбачається, що L-триптофан є найбільш вірогідним прекрсором, причому триптамін існує як проміжний продукт.
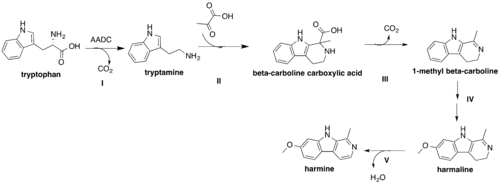
На наступному малюнку представлена запропонована схема біосинтезу для гарміну.[5] Шикіматний шлях кислоти утворює ароматичну амінокислоту, L-триптофан. Декарбоксилювання L-триптофану ароматичною L-амінокислотною декарбоксилазою (AADC) утворює триптамін (I), який утримує нуклеофільний центр у вуглеці C-2 індольного кільця завдяки сусідньому атому азоту, що дозволяє брати участь у рекції типу Манніха. Перестановки дозволяють утворити основу Шиффа з триптаміну, який потім реагує з піруватом у II, утворюючи β-карболінову карбонову кислоту. Потім β-карболінова карбонова кислота піддається декарбоксилюванню з отриманням 1-метил β-карболіну III. Гідроксилювання з подальшим метилюванням у IV дає гармалін. Показано, що порядок O-метилювання та гідроксилювання не має значення для утворення проміжного продукту гамаліну.[4] На останньому етапі V окислення гармаліну супроводжується втратою води та ефективно генерує гармін.
Складність розмежування L-триптофану та вільного триптаміну як прекурсора біосинтезу гарміну походить від присутності біосинтетичного шляху серотоніну, який дуже нагадує шлях гарміну, проте вимагає наявності вільного триптаміну як його попередника.[4] Таким чином, незрозуміло, чи декарбоксилювання L-триптофану чи включення пірувату в основну структуру триптаміну є першим кроком біосинтезу гарміну. Однак експерименти з підживленням, що передбачають згодовування одного з триптаміну волосистим кореневим культурам P. harmala, показали, що підживлення триптаміну призвело до значного підвищення рівня серотоніну з незначним або незначним впливом на рівень β-карболіну, підтверджуючи, що триптамін є попередником для серотоніну, і вказуючи на те, що він, ймовірно, є лише проміжним продуктом у біосинтезі гарміну; в іншому випадку спостерігалося б порівнянне підвищення рівня гарміну.[5]
Використання
Інгібітор моноаміноксидази
Гармін є інгібітором моноаміноксидази, оскільки він оборотно пригнічує моноаміноксидазу А (МАО-А), але не МАО-В .[3] Пероральні або внутрішньовенні дози гарміну від 30 до 300 мг можуть викликати збудження, брадикардію або тахікардію, затуманення зору, гіпотонію, парестезії. Для підтвердження діагнозу можна виміряти концентрацію гарміну в сироватці або плазмі крові. Період напіввиведення гарміну з плазми становить близько 1–3 годин.[6]
Медично значуща кількість гарміну міститься в рослинах ребрика звичайного та Banisteriopsis caapi. Ці рослини також містять помітну кількість гармаліну[2] який також є інгібітором моноаміноксидази.[3] Психоактивна заварка аяваска аяваска виготовляється з кори стебла B. caapi, як правило, у поєднанні з диметилтриптаміном (ДМТ), що містить листя Psychotria viridis. ДМТ — психоделічний препарат, але він не є перорально активним, якщо не потрапляє в організм разом з інгібітором моноаміноксидази. Це робить гармін життєво важливим компонентом заварки аяваска з огляду на його здатність викликати психоделічний досвід.[7] Ребрик звичайний або синтетичний гармін іноді використовується для заміщення B. caapi при пероральному застосуванні ДМТ.[8]
Інше

Гармін — корисний флуоресцентний індикатор рН. Зі збільшенням рН місцевого середовища емісія флуоресценції гарміну зменшується.
Завдяки специфічному зв'язуванню з МАО-А, мічений вуглецем-11 гармін можна використовувати в позитронно-емісійній томографії для вивчення порушення регуляції МАО-А при ряді психічних та неврологічних захворювань.[9]
Гармін застосовувався як протипаркінсонічний засіб з кінця 1920-х до початку 1950-х. Його замінили інші ліки.
Дослідження
Протиракові
«Гармін продемонстрував цитотоксичність щодо клітинних ліній HL60 та K562. Це може пояснити цитотоксичну дію Peganum harmala на ці клітини».[10] Інгібітори бета-карболіну МАО, такі як гармін, зв'язуються з ДНК, а також виявляють протипухлинні властивості. Доведено, що гармін зв'язується в сто разів ефективніше, ніж його близький аналог гармалін. Наслідки цього в даний час недостатньо зрозумілі.[11]
Вплив на кістки та хрящі
Показано, що гармін сприяє диференціації остеобластів (кісткоутворюючих клітин),[12] та хондроцитів (клітин у хрящі).[13] Також було показано, що гармін пригнічує утворення остеокластів (клітин, що розсмоктують кістки).[14]
Проліферація клітинних острівців підшлункової залози
В даний час гармін є єдиним відомим препаратом, який підвищує проліферацію (швидкий мітоз та подальший ріст маси ) клітин підшлункової залози альфа (α) та бета (β) у дорослих людей.[15] Ці субклітинні острівці, як правило, дуже стійкі до стимуляції росту на дорослому етапі життя людини, оскільки плато клітинної маси досягається приблизно у віці 10 років і з цього часу залишається практично незмінним. Інші подібні препарати успішно стимулювали проліферацію бета-клітин у щурів/мишей та свиней, однак ці препарати були дуже обмеженими і не мали успіху на людях. Встановлено, що гармін на короткий час збільшує зменшену масу бета-клітин хворих на цукровий діабет до клінічно значущих рівнів: ця властивість виявляється дуже корисною при можливому лікуванні на основі гарміну як для діабету 1, так і для типу 2.
Відомо, що гармін є потужним інгібітором ферментного шляху DYRK1A. Вважається, що це головний механізм, за допомогою якого гармін може викликати проліферацію альфа- та бета-клітин in vivo. DYRK1A — фермент, який відіграє певну роль у придушенні/регуляції проліферації клітин, тому має сенс, що часткове блокування DYRK1A збільшує ріст деяких клітин, включаючи клітини α та β підшлункової залози. Зміни багатьох інших ферментів та генів, які беруть участь у проліферації клітин, не показали значних результатів у людини, отже, досі невідомо, чому інгібування DYRK1A може змусити клітини α та β ділитися та рости.
Інше
Встановлено, що гармін, що міститься в кореневих виділеннях Oxalis tuberosa, має інсектицидні властивості.[16]
Встановлено, що гармін підвищує експресію глутаматного насоса EAAT2 у центральній нервовій системі, отже, зменшує токсичність глутамату.[17]
Природні джерела
Гармін міститься в різних організмах, більшість з яких є рослинами.
Олександр Шульгін перелічує близько тридцяти різних видів, які, як відомо, містять гармін, у тому числі сім видів метеликів з родини Nymphalidae.[18]
До рослин, що містять гармін, належать тютюн, Peganum harmala, два види пасифлори та багато інших. Меліса лікарська містить гармін.[19]
На додаток до B. caapi, принаймні три представники мальпігієвих містять гармін, включаючи ще два види Banisteriopsis та рослину Callaeum antifebrile.[20]
Родина парнолистові, до якого належить P. harmala, містить принаймні дві інші рослини, що містять гармін Peganum nigellastrum та паролист звичайний.
Примітки
- Harmine - CAS 442-51-3. scbio.de. Santa Cruz Biotechnology, Inc. Процитовано 27 жовтня 2015.
- Banisteriopsis caapi, a Forgotten Potential Therapy for Parkinson's Disease?. Movement Disorders Clinical Practice 3 (1): 19–26. 2015. PMC 6353393. PMID 30713897. doi:10.1002/mdc3.12242.Djamshidian A, et al. (2015).
- The Therapeutic Potentials of Ayahuasca: Possible Effects against Various Diseases of Civilization. Frontiers in Pharmacology 7. 2016. PMC 4773875. PMID 26973523. doi:10.3389/fphar.2016.00035.
- Berlin Jochen; Rugenhagen Christiane; Greidziak Norbert; Kuzovkina Inna; Witte Ludger; Wray Victor (1993). Biosynthesis of Serotonin and Beta-carboline Alkaloids in Hairy Root Cultures of Peganum Harmala. Phytochemistry 33 (3): 593–97. doi:10.1016/0031-9422(93)85453-x.
- Nettleship Lesley; Slaytor Michael (1974). Limitations of Feeding Experiments in Studying Alkaloid Biosynthesis in Peganum Harmala Callus Cultures. Phytochemistry 13 (4): 735–42. doi:10.1016/s0031-9422(00)91406-7.
- R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, 2008, pp. 727—728.
- Ayahuasca: Psychological and Physiologic Effects, Pharmacology and Potential Uses in Addiction and Mental Illness. Current Neuropharmacology 17 (2): 108–128. 2019. PMC 6343205. PMID 29366418. doi:10.2174/1570159X16666180125095902.
- Toxicological Aspects and Determination of the Main Components of Ayahuasca: A Critical Review. Medicines 6 (4): 106. 2019. PMC 6963515. PMID 31635364. doi:10.3390/medicines6040106.
- Nathalie Ginovart; Jeffrey H. Meyer; Anahita Boovariwala; Doug Hussey; Eugenii A. Rabiner; Sylvain Houle; Alan A. Wilson (2006). Positron emission tomography quantification of [11C]-harmine binding to monoamine oxidase-A in the human brain. Journal of Cerebral Blood Flow & Metabolism 26 (3): 330–344. PMID 16079787. doi:10.1038/sj.jcbfm.9600197.
- Jahaniani, F; Ebrahimi, SA; Rahbar-Roshandel, N; Mahmoudian, M (July 2005). Xanthomicrol is the main cytotoxic component of Dracocephalum kotschyii and a potential anti-cancer agent. Phytochemistry 66 (13): 1581–92. PMID 15949825. doi:10.1016/j.phytochem.2005.04.035.
- Nafisi, Shohreh; Bonsaii, Mahyar; Maali, Pegah; Khalilzadeh, Mohammad Ali; Manouchehri, Firouzeh (2010). β-Carboline alkaloids bind DNA. Journal of Photochemistry and Photobiology B: Biology 100 (2): 84–91. PMID 20541950. doi:10.1016/j.jphotobiol.2010.05.005.
- Harmine promotes osteoblast differentiation through bone morphogenetic protein signaling. Biochemical and Biophysical Research Communications 409 (2): 260–265. 2011. PMID 21570953. doi:10.1016/j.bbrc.2011.05.001.
- Novel chondrogenic and chondroprotective effects of the natural compound harmine. Biochimie 95 (2): 374–81. 2013. PMID 23116713. doi:10.1016/j.biochi.2012.10.016.
- The small molecule harmine regulates NFATc1 and Id2 expression in osteoclast progenitor cells. Bone 49 (2): 264–274. 2011. PMID 21504804. doi:10.1016/j.bone.2011.04.003.
- Wang, P. (2015). Induction of human pancreatic beta cell replication by inhibitors of dual specificity tyrosine regulated kinase. Nature Medicine 21: 383–388. PMC 4690535. doi:10.1038/nm.3820. Процитовано 19 травня 2021.
- Pal Bais, Harsh; Park, Sang-Wook; Stermitz, Frank R.; Halligan, Kathleen M.; Vivanco, Jorge M. (18 червня 2002). Exudation of fluorescent β-carbolines from Oxalis tuberosa L. roots. Phytochemistry 61 (5): 539–543. PMID 12409020. doi:10.1016/S0031-9422(02)00235-2. Архів оригіналу за 5 вересня 2008. Процитовано 2 лютого 2008.
- Li Y; Sattler R; Yang EJ; Nunes A; Ayukawa Y; Akhtar S; Ji G; Zhang PW та ін. (18 червня 2011). Harmine, a natural beta-carboline alkaloid, upregulates astroglial glutamate transporter expression. Neuropharmacology 60 (7–8): 1168–75. PMC 3220934. PMID 21034752. doi:10.1016/j.neuropharm.2010.10.016.
- Shulgin, Alexander; Shulgin, Ann (1997). TiHKAL: The Continuation. Transform Press. ISBN 0-9630096-9-9.
- Natalie Harrington (2012). Harmala Alkaloids as Bee Signaling Chemicals. Journal of Student Research 1 (1): 23–32. doi:10.47611/jsr.v1i1.30.
- Callaway J. C.; Brito G. S.; Neves E. S. (2005). Phytochemical analyses of Banisteriopsis caapi and Psychotria viridis. Journal of Psychoactive Drugs 37 (2): 145–150. PMID 16149327. doi:10.1080/02791072.2005.10399795.