Глікогенфосфорилаза
Глікоге́нфосфорила́за (1,4-α-D-глюкан: ортофосфат α-глікозилтрансфераза) — фермент, що каталізує лімітуючу стадію процесу глікогенолізу: розщеплення глікогену до глюкозо-1-фосфату шляхом фосфоролізу.
| Глікоген фосфорилаза | |
|---|---|
 | |
| Ідентифікатори | |
| Символ | людські ізоферменти PYGM, PYGL, PYGB |
| Номер CAS | |
| Інша інформація | |
| Шифр КФ | |
Глікогенфосфорилазу інколи називають просто фосфорилазою, через те що це перший відкритий фермент із фосфорилазною активністю.
Історія дослідження
Глікогенфосфорилаза була першим відкритим ферментом класу фосфорилаз. Під час її дослідження вперше встановлено можливість регуляції ферменту шляхом фосфорилювання/дефосфорилювання. Глікогенфосфорилаза також була одним із перших відомих алостеричних ферментів, і першим, для якого були встановлені точні тримірні структури активної та інактивованої форми за допомогою рентгеноструктурного аналізу[1].
У 1930-х роках Карл та Герті Корі встановили, що гілкогенфосфорилаза скелетних м'язів може перебувати у двох формах, що перетворюються одна в одну: каталітично активна фосфорилаза a та неактивна фосфорилаза b. Подальші дослідження цього ферменту проводив Ерл Сазерленд, який з'ясував, що фосфорилаза b переважає у м'язах в стані спокою, в той час як фосфорилаза a — під час активних скорочень. Перетворення неактивної форми в активну відбувається під впливом адреналіну[1]. 1959 року Едвін Кребс та Едмонд Фішер встановили, що a- та b- форми фосфорилази відрізняються наявністю фосфатної групи, приєднаної до залишку серину 14[2]. Високороздільний рентгеноструктурний аналіз обидвох форм провели Роберт Флеттерік та Луї Джонсон[3].
Структура глікогенфосфорилази
Глікогенфосфорилаза — це димер двох ідентичних субодиниць довжиною по 842 амінокислотні залишки (97 кДа)[4]. До складу кожної субодиниці входить амінокінцевий (залишки 1—484) та карбоксикінцевий домени (залишки 485–842). Амінокінцевий домен у свою чергу поділяється на два субдомени, один із яких містить місце ковалентної модифікації (Сер14), алостеричні сайти, та поверхню взаємодії із іншим мономером в димері. Другий субдомен містить сайт зв'язування глікогену (залишки 316–484)[3].
Активний центр розташований у центрі субодиниці між N- і C-кінцевим доменами. Він віддалений від сайту зв'язування глікогену приблизно на 30 Å і сполучений із ним вузькою щілиною, в яку поміщається 4—5 залишків глюкози. Ця щілина має радіус кривини, відповідний до радіуса спіральної гілки глікогену і є надто вузькою, щоб захопити місце галуження ((α1→6)-зв'язок)[3][5].
Розділення активного сайту та сайту зв'язування глікогену дозволяє ферменту каталізувати розщеплення багатьох глікозидних зв'язків в одній молекулі глікогену без потреби від'єднуватись і знову приєднуватись до неї. Таким чином збільшується процесивність ферменту[5].
Механізм реакції
Глікогенфосфорилаза каталізує реакцію, в якій ортофосфатна кислота атакує (α1→4)-глікозидний зв'язок між останнім та передостаннім залишками глюкози із нередукуючого кінця гілки глікогену, внаслідок чого виділяється глюкозо-1-фосфат. Ця реакція дозволяє зберегти більшу частину енергії глікозидного зв'язку завдяки формуванню естеру[6].

Реакція повинна відбуватись таким чином, щоб виключити наявність води в активному центрі, оскільки в протилежному випадку замість фосфоролізу відбудеться гідроліз, і на фосфорлиювання утвореної глюкози потрібно буде затратити АТФ[7].
Кілька експериментальних спостережень дозволяють робити припущення про механізм реакції. По-перше як субстрат (гілкоген) так і продукт (глюкозо-1-фосфат) реакції перебувають у α-конфігурації. Якщо б відбувалась пряма атака ортофосфату на глікозидний зв'язок, це супроводжувалось би інвертуванням конфігурації C-1 (утворювався би β-глюкозо-1-фосфат), через те що реакція проходила б через пентаковалентинй проміжний стан. Оскільки α-кофігурація зберігається, реакція повинна відбуватись у парну кількість етапів (у напростішому випадку — два), найбільш імовірно, через формування проміжної сполуки карбкатіону[5] (резонує із іоном оксонію[8]).
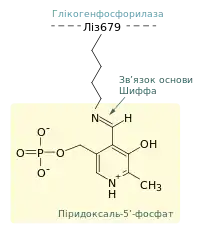
По-друге для протікання реакції фосфоролізу необхідна присутність кофактора піридоксаль-5'-фосфату (ПЛФ) (похідного вітаміну B6), приєднаного до Ліз679 через формування основи Шиффа. Структурний аналіз показав, що ортофосфат займає положення між 5'-фосфатною групою ПЛФ та глікогеном. 5'-фосфатна група ПЛФ може відігравати роль загального кислотно-основного каталізатора, спочатку донуючи протон, а потім перетворюючись у його акцептор[5].
Можливий такий механізм реакції: ортофосфат (у формі HPO2-4) донує протон атому Оксигену, що утворює (α1→4)-зв'язок, і одночасно набуває протона від фосфатної групи ПЛФ. Таким чином формується перехідна сполука карбоній-оксоній катіон у конформації півкірсла. Він атакується ортофосфатом, внаслідок чого відбувається утворення глюкозо-1-фосфату та повернення протона до ПЛФ[8][5][9].
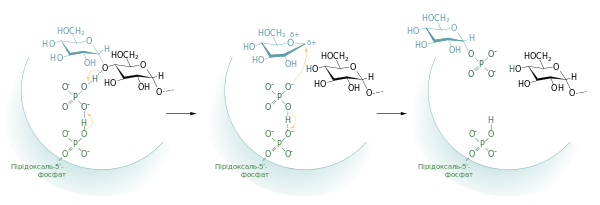
Глікогенфосфорилаза відщеплює по одному залишку глюкози від нередукуючого кінця, поки не наближається до точки галуження ((α1→6)-зв'язку) на відстань чотирьох залишків, де її активність припиняється і може бути відновлена тільки після дії дерозгалужуючого ферменту[10].
Термодинаміка фосфорилазної реакції
У реакції, каталізованій глікогенфосфорилазою, велика частина енергії глікозидного зв'язку зберігається завдяки формуванню естеру із фосфатною кислотою. Через це стандартна зміна вільної енергії (ΔG0') є невеликою і реакція може протікати (+3,1 кДж/моль[11]) in vitro як у прямому так і зворотному напрямку. За pH 6,8 рівновага встановлюється при співвідношенні [ортофосфат]/[глюкозо-1-фосфат] близько 3,6. Проте за реальних умов in vivo це співвідношення переважно перевищує 100, через що рівновага сильно зміщується в сторону розщеплення глікогену[12], а реальна зміна вільної енергії ΔG = −8 кДж/моль. Тобто фосфороліз глікогену є екзергонічним процесом[11].
Регулювання активності ферменту
Активність глікогенфосфорилази є об'єктом багаторівневих механізмів регулювання. По-перше, вона приводиться у відповідність потребам клітини завдяки дії алостеричних модудяторів. По-друге, фермент може активуватись/інактивуватись шляхом ковалентної модифікації (фосфорилювання), що здійснюється під впливом гормонів (глюкагону, адреналіну та інсуліну), таким чином активність глікогенфосфорилази змінюється в залежності від потреб цілого організму. По-третє, ізоферментний склад глікогенфосфорилази відрізняється у різних органах, зокрема в людини є печінкова, м'язова та мозкова форми, кожна із яких має свої особливості регулювання. Це пов'язане із тим, що функції глікогенолізу не однакові у різних тканинах: наприклад, у м'язах він потрібний для забезпечення їх енергією під час скорочень, а у печінці — для підтримання стабільного рівня глюкози в крові.
Форми глікогенфосфорилази
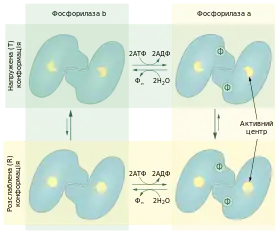
Існує дві форми глікогенфосфорилази, що перетворюються одна в одну: переважно активна (фосфорильована) фосфорилаза a та переважно неактивна (нефосфорильована) фосфорилаза b. Кожна із цих форм у свою чергу може перебувати в одній із двох конформацій: каталітично активній розслабленій R (від англ. relaxed) та каталітично неактивній напруженій T (від англ. tense). Для фосфорилази a рівновага зміщена в сторону переходу в R-стан, тоді як більшість фосфорилази b перебуває у T-стані[13].
Конформаційний перехід від T- до R-стану передбачає поворот мономерів на 10° навколо осі симетрії другого порядку димеру. Внаслідок чого відбувається зміна розташування α-спіралей і вихід із активного центру петлі, що закривала його у T-стані і перешкоджала зв'язуванню субстрату[14][15]. Окрім того відбувається поворот бічного ланцюга залишку аргініну 569 поблизу піридоксль-5'-фосфату, через що збільшується спорідненість ферменту до ортофосфату[15]. Перехід між напруженою та розслабленою формами ферменту регулюється зв'язуванням алостеричних модуляторів, які відрізняються у різних тканинах.
Алосетрична регуляція глікогенфосфорилази
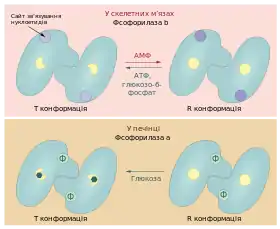
У розслаблених м'язах фосфорилаза b переважає над a формою. Більшість молекул фосфорилази b перебувають у неактивному T-стані, проте вони можуть переходити у R-конформацію під впливом позитивного алостеричного модулятора: АМФ, високий рівень якого свідчить про низький енеретичний статус клітини. Алостеричним інгібіторами глікогенфосфорилази b є АТФ, що конкурує із АМФ за зв'язування з ферментом, та глюкозо-6-фосфат, який забезпечує негативний зворотний зв'язок у цьому метаболічному шляху (кінцевий продукт пригнічує активність першого ферменту). Під впливом гормональних сигналів може відбуватись фосфорилювання глікогенфосфорилази, внаслідок чого вона переходить в a форму, активність якої не залежить від алостеричних модуляторів[16][15].
Іншим шляхом відбувається регуляція активності глікогенфосфорилази у печінці. Оскільки завданням цього органу є підтримання сталого рівня глюкози в крові, то печінковий ізофермент інгібується високими концентраціями глюкози. При чому алостеричний модулятор діє на a-, а не на b-форму. Глікогенфосфорилаза печінки не чутлива до концентрації АТФ та АМФ, оскільки у гепатоцитах не відбувається такої різкої зміни запасів енергії як у м'язових волокнах[14].
Регуляція шляхом ковалентної модифікації
Окрім алостеричних модуляторів на каталітичну активність глікогенфосфорилази впливає ковалентна модифікація, що відбувається у відповідь на дію гормонів. Перетворення переважно неактивної фосфорилази b у переважно активну фосфорилазу a здійснюється завдяки фосфорилюванню по залишку серину 14 кіназою фосфорилази. Для зворотного переходу необхідна активність фосфопротеїнфосфатази 1 (фосфатази фосфорилази a). Ці ферменти у свою чергу також підлягають складним механізмам реглуювання.
Активація фосфорилази під впливом глюкагону та адреналіну
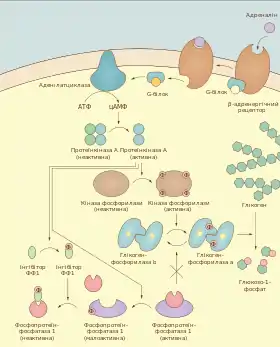
Гормони глюкагон та адреналін активують глікогенфосфорилазу через каскад сигнальних реакцій. Перший із них виділяється під час голодування, другий — під час фізичної активності або її очікування. Глікогеноліз у печінці чутливіший до дії глюкагону, а у м'язах — до адреналіну[17].
Обидва гормони діють через G-білокспряжені рецептори: β-адренергічний рецептор у м'язах та печінці та глюкагоновий рецептор у печінці. Після зв'язування із лігандом рецептори передають сигнал тримерному Gs-білку. Останній активує мембранний фермент аденілатциклазу, що каталізує утворення циклічного АМФ із АТФ. Підвищена концентрація цАМФ викликає суттєве збільшення каталітичної активності протеїнкіанзи А (цАМФ-залежної протеїнкінази), а та у свою чергу фосфорилює кіназу фосфорилази. Після цього кіназа фосфорилази модифікує глікогенфосфорилазу b і перетворює її в a-форму[18].
Окрім фосфорилювання кіназа фосфорилази може активуватись також і підвищеними концентраціями кальцію у цитоплазмі, оскільки містить у своєму складі кальмодулін як регуляторну субодиницю. У м'язах рівень кальцію зростає під час скорочень, тоді як у печінці це може відбуватись під впливом адреналіну, що діє через α-адренергічний рецептор[18].
Одночасно із активацією кінази фосфорилази відбувається інкативація фосфопротеїнфосфатази 1. Цей білок має у своєму складі регуляторну субодиницю, у м'язах — GM, а в печінці GL. Ці поліпептиди кріплять каталітичну субодиницю ФФ1 до її субстратів та глікогену. У м'язових волокнах GM регулюється шляхом фосфорилювання: протеїнкіаназа А приєднує залишок фосфатної кислоти у специфічному сайті 2 (можливе також фосфорилювання іншими кіназами по сайту 1, що має протилежний ефект), що призводить до дисоціації ФФ1 у цитоплазму, де вона не має доступу до фосфорилази a та кінази фосфорилази. Крім того у цитоплазмі ФФ1 зв'язується із інгібіторними бліками, також модифікованими протеїнкіназою А, внаслідок чого її каталітична активність додатково пригнічується[19][20].
У печінці регуляторна субодиниця GL ФФ1 не контролюється шляхом фосфорилювання. Проте ФФ1 міцно приєднується до фосфорилази a в R-формі і в такому стані є неактивною, аж поки не відбудеться перехід R → T, зокрема під впливом високих концентрацій глюкози[21].
Каскад ферментативних реакцій, що виникає під впливом гормонів, забезпечує значне підсилення сигналу: x молекул гормону викликають вивільнення в кров 10 000x молекул глюкози гепатоцитами[22]. Після завершення дії гормонів глікогеноліз повинен швидко зупинятись, це забезпечується фосфопротеїнфосфатазою 1, що дефосфорилює як глікогенфосфорилазу, так і кіназу фосфорилази[18].
Інактивація глікогенфософилази під впливом інсуліну та глюкози
Гормон інсулін є антагоністом глюкагону, він виділяється у кров у відповідь на значне підвищення концентрації глюкози, і стимулює її захоплення і використання клітинами, в тому числі і для біосинтезу глікогену. Одночасно із активацією глікогенезу інсулін пригнічує глікогеноліз, а саме його ключовий фермент — глікогенфосфорилазу. У м'язах під впливом цього гормону активується інсулін-стимульована протеїнкіназа, що фосфорилює регуляторну GM-субодиницю фосфопротеїнфосфатази 1 по сайту 1 (відмінний від сайту 2, який є субстратом для протеїнкінази А), що у свою чергу викликає її активацію. ФФ1 забезпечує перетворення активної фосфорилази a в неактивну b-форму[20].
У печінці окрім інсуліну важливе значення для пригнічення глікогенолізу має власний «сенсор глюкози» — гілкогенфосфорилаза a. В активному R-стані вона міцно зв'язує ФФ1 та пригнічує її каталітичну активність, під впливом підвищених концентрацій глюкози фосфорилаза a переходить у T-конформацію, внаслідок чого фосфорильований Сер14 стає зручним субстратом для дефосфорилювання ФФ1. Одночасно знімається інгібування ФФ1, яка тепер може дефосфорилювати інші білки[23][21].
Еволюція глікогенфосфорилази
Порівняння амінокислотної послідовності глікогенфосфорилази кишкової палички, дріжджів, слизовика Dictyostelium, картоплі, пацюків та людини показало наявність трьох консервативних послідовностей, що зазнали дуже мало змін впродовж еволюції: 15 амінокислотних залишків, що контактують із глюкозою в активному центрі, майже ідентичні у всіх досліджених організмів, дещо більш варіабельними є 15 амінокислот, що зв'язують пріридоксальфосфат та сайт зв'язування глікогену. Такі результати свідчать про те, що каталітичний механізм не змінився у процесі еволюції[24].
З іншого боку, в регуляторних сайтах спостерігаються суттєві відмінності. В той час як найпростіший тип регулювання — інгібування глюкозо-6-фосфатом, що забезпечує негативний зворотний зв'язок, наявний у більшості досліджених організмів, амінокислоти, необхідні для фосфорилювання ферменту і зв'язування нуклеотидів, є тільки у глікогенфосфорилазі ссавців. Отже, складніші механізми контролю ферментативної активності в процесі еволюції виникли пізніше[24].
Примітки
- Nelson et al, 2008, с. 603.
- Voet et al, 2011, с. 651.
- Voet et al, 2011, с. 640.
- Voet et al, 2011, с. 639.
- Berg et al, 2007, с. 597.
- Nelson et al, 2008, с. 595.
- Berg et al, 2007, с. 596.
- Watson KA, McCleverty C, Geremia S, Cottaz S, Driguez H, Johnson LN (1999). Phosphorylase recognition and phosphorolysis of its oligosaccharide substrate: answers to a long outstanding question. EMBO J 18: 4619–32. PMID 10469642. doi:10.1093/emboj/18.17.4619.
- Voet et al, 2011, с. 642.
- Nelson et al, 2008, с. 596.
- Voet et al, 2011, с. 643.
- Berg et al, 2007, с. 594.
- Berg et al, 2007, с. 598.
- Berg et al, 2007, с. 600.
- Voet et al, 2011, с. 648.
- Berg et al, 2007, с. 599.
- Berg et al, 2007, с. 601.
- Berg et al, 2007, с. 603.
- Berg et al, 2007, с. 609.
- Voet et al, 2011, с. 659.
- Berg et al, 2007, с. 610.
- Nelson et al, 2008, с. 604.
- Voet et al, 2001, с. 662.
- Berg et al, 2007, с. 604.
Джерела
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Voet D., Voet J.G. (2011). Biochemistry (вид. 4th). Wiley. с. 487—496. ISBN 978-0470-57095-1.
Посилання
- David Goodsell Glycogen Phosphorylase — Molecule of the Month на сайті PDB, 2001. — Переглянуто 20 червня 2012 року.
