Каліфорній
Каліфорній (Cf) — штучно одержаний радіоактивний хімічний елемент; належить до актиноїдів. символ Cf, атомне число 98, електронна конфігурація [Rn]5f107s2; період 7, f-блок (актиноїд). Відомо 15 ізотопів. Найстабільніші ізотопи 251Cf (900 років), 249Cf (360 років), 250Cf (13,08 років), 252Cf (961 днів). Звичайний ступінь окиснення +3 (пр., Cf2О3), є ще +2 і +4 (пр., CfBr2, CfO2, CfF4). Проста речовина — каліфорній.
Історія

Починаючи з 1944 року група Гленна Сіборга в Університеті Каліфорнії (Берклі) почала займатися пошуками і синтезом трансуранових елементів, і в кінці того ж року змогла виявити 95-й і 96-й елементи — америцій і кюрій. Після їх виявлення стало зрозуміло, що ці елементи утворюють сімейство (подібне до до сімейства лантаноїдів), що отримало назву актиноїди. Після цього стало простіше передбачати хімічні властивості ще не відкритих елементів, а отже і виділяти їх. Також, під час роботи з цими елементами були розроблені методики ультрамікрохімічного аналізу.[5]
Протягом наступних п'яти років було накопичено кілька мікрограм кюрію[6], що дозволило зробити наступний крок. У 1950 році Сіборг, С. Дж. Томпсон і А. Гіорсо опромінили мішень з кюрію розігнанними на 60-дюймовому циклотроні альфа-частинками з енергією 35 МеВ, отримавши близько 5000 атомів елементу номер 98[7], за такою реакцією:
Період напіврозпаду цього ізотопу становить лише 44 хвилини, тому ідентифікація його була надзвичайно важкою. Вона була здійснена за допомогою методу іонообмінноі адсорбції на смолі дауекс-50, з послідуючою елюцією. Остаточно отримання елементу номер 98 було підтверджене 9 лютого 1950 року. [8]
Елемент отримав назву на честь штату Каліфорнія, де він був отриманий. Також, автори статті, у якій вони описували відкриття нового елементу, пов'язували його назву з назвою диспрозію (що з давньогрецької перекладається як важкодосяжний), що є рідкоземельним аналогом каліфорнію. Вони вказували, що отримати новий елемент було так само важко, як першим поселенцям було важко дістатись до Каліфорнії.[9]
Отримати вагові кількості каліфорнію вдалося лише у 1958 році Каннінгему і Томпсону[10] після тривалого опромінення плутонію нейтронами, а першу хімічну сполуку — 0,3 мкг CfOCl (хлорид оксиду каліфорнію), лише у 1960 році, Каннінгему і Джеймсу Уолману. У тому ж році були отримані окис(Cf2O3) і трихлорид каліфорнію.[11]
Присутність в природі
Наразі невідомі природні шляхи отримання каліфорнію, тому весь існуючий на Землі каліфорній є синтезованим.
Деяка кількість каліфорнію утворилася після ядерних випробувань. Концентрація такого каліфорнію у воді, ймовірно, в 500 разів нижча, ніж у ґрунті. Втім, загальна кількість утвореного каліфорнію є незначною.[12]
Через присутність у випромінюванні наднових типа І компоненти, інтенсивність якої падає вдвічі кожні 55 днів, що збігається з періодом напіврозпаду каліфорнію-254, існувала гіпотеза, що велика кількість цього ізотопу утворюється при вибухах наднових[13]. Проте, пізніші дослідження показали, що випромінювання належить нікелю-56. [14]
Фізичні властивості
Каліфорній — м'який сріблястий метал, з густиною 15,1 г/см3, що плавиться при 900±30°C. Температура кипіння невідома, проте з теоретичних міркувань вона має бути близькою до 1745°C. Ентальпія сублімації становить 196,23±1,26 кДж/моль.[15]
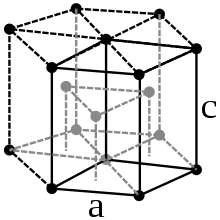
Каліфорній має подвійну гексагональну щільно упаковану кристалічну ґратку з параметрами a=3,4Å і c=11Å. При високому тиску (більше 16 ГПа) і температурі 600-800°C зафіксований перехід до іншої алотропної модифікації, що має кубічну гранецентровану ґратку з періодом 4,9Å. Згідно деяких досліджень, при тиску у 48 ГПа, каліфорній переходить до ромбічної форми[16].
Каліфорній-252 у 3,09% випадків розпадається спонтанно, випромінюючи нейтрони (в середньому, 3,767 нейтрона), через що цей ізотоп є одним з найактивніших джерел нейтронів — 1 мікрограм каліфорнію-252 випромінює 2,314 мільйона нейтронів за секунду[17].
Модуль всебічного стиску каліфорнію становить 50±5 ГПа, втричі менше ніж у сталі[18].
Хімічні властивості
Хімічні властивості каліфорнію ще не повністю зрозумілі, в першу чергу через те, що достеменно не відома роль 5f електронів у хімічних взаємодіях. Ймовірно, деякі з цих електронів можуть переходити на 6d-орбіталь[19]. Загалом, каліфорній займає проміжну позицію між двовалентними і тривалентними металами, тому легко переходить між цими станами. Навіть всередині одного шматка каліфорнію, частина атомів (ті, що знаходяться біля його поверхні) можуть бути двовалентними, а частина — тривалентними.
Загалом, спостерігалися сполуки каліфорнію, в яких він мав ступені окисненя +2, +3 і +4. Існують повідомлення про спостереження ступеня окиснення +5, проте вони є дискусійними. Каліфорній добре реагує з газоподібним воднем і кислотами. На повітрі швидко утворює оксидну плівку. Відомі оксиди каліфорнію Cf2O3, CfO2, Cf2O, Cf7O12. Синтезовані фторид, бромід, хлорид, йодід, карбід каліфорнію — у більшості з цих сполук каліфорній має ступінь окиснення +3[20].
Поліборат каліфорнію цікавий своєю люмінесценцією — він випромінює зелене світло[21]. Загалом, багато сполук каліфорнію мають зелений колір.
У станах окиснення +2 і +3 ефективний магнітний момент каліфорнію становить 9,14 магнетонів Бора[22].
Отримання
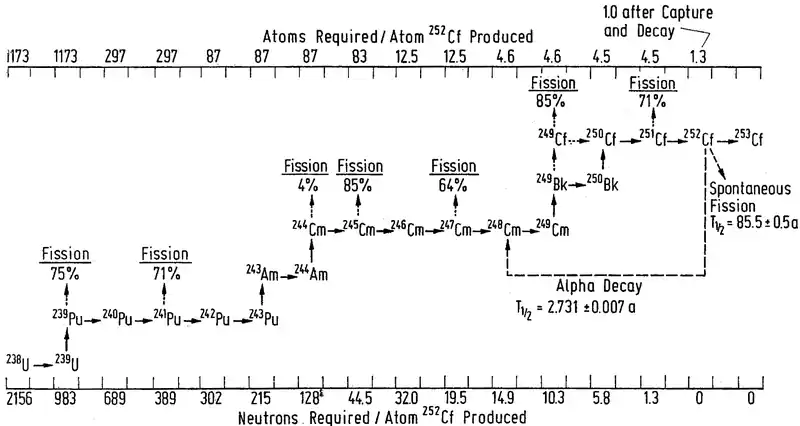
На практиці, каліфорній утворюється при тривалому (кілька років) опроміненні плутонію-239 нейтронами в спеціальних ядерних реакторах по ланцюжку плутоній-америцій-кюрій-берклій-каліфорній (на цьому шляху плутоній захоплює 13 нейтронів і зазнає 4 бета-розпадів). Для цього мішень зі сплаву алюмінію і плутонію опромінюють в реакторах з великою щільністю потоку нейтронів, після чого мішень розчиняють у розплаві NaOH і екстрагують з неї плутоній та інші актиноїди за допомогою органічних розчинників, після чого відділяють каліфорній від інших трансуранових елементів аніонним обміном, промиваючи колонку хлоридом літію і соляною кислотою.[23]
Вихід каліфорнію при реакції дуже малий — з 10 кілограмів плутонію утворюється лише три грами каліфорнію. Отриманий таким чином каліфорній має наступний ізотопний склад: 4,3% 249Cf, 49% 250Cf, 11% 251Cf, 36% 252Cf.[24]
Наразі каліфорній виробляється у двох місцях: національна лабораторія Оук-Ридж у Теннессі (90% світового виробництва) і реактори у Димитровграді (Росія).[25]
Згідно даних лабораторії Оук-Рідж, до 1995 року було вироблено 8.5 грам каліфорнію-252, щорічне виробництво становить близько 500 мг. [26]
Використання
.jpg.webp)

Каліфорній є найважчим елементом з тих, що мають комерційне використання. До 1995 року близько 500 міліграм каліфорнію було продано[26]. У 2000 році ціна на каліфорній становила 66 доларів за мікрограм[27] (для порівняння, ціна золота в 2000 році становила 300 доларів за грам, тобто в 220 тисяч разів менше).
Каліфорній-252 є потужним і компактним джерелом нейтронів, і використовується в цій якості в багатьох галузях:
- Ініціюючі джерела нейтронів для ядерних реакторів[28].
- Лікування раку — каліфорній використовується для брахітерапії (вид терапії раку, при якому джерело випромінювання розміщується всередині тіла)[29].
- Нейтронно-активаційний аналіз — методика, за допомогою якої можна визначити склад речовини.
- Нейтронна радіографія — метод неруйнівного дослідження за допомогою пучка нейтронів. З допомогою нейтронної радіографії можна встановити неоднорідності розподілу домішок або внутрішні дефекти у зразку. Використовується, наприклад, при перевірці на дефекти літаків і зброї [30]
У наукових цілях каліфорній використовується для пошуку нових елементів — бомбардуючи каліфорній ядрами легких елементів можна отримати більш важкі ядра. Таким чином був відкритий, наприклад, оганесон, елемент номер 118.
Через малу критичну масу каліфорнію-252 (2,91 кг) і каліфорнію-251 (2,45 кг)[31] існують проекти використання його для створення ультракомпактних ядерних боєприпасів[32], проте наразі загальна кількість накопиченого людством каліфорнію в тисячі разів менше, ніж необхідно для створення хоча б однієї каліфорнієвої бомби.
Також, у деяких джерелах критична маса каліфорнію невірно наведена як кілька грам, через що робляться припущення про можливість створення "ядерних набоїв"[33]. Можливо, вперше ця помилка з'явилася у журналі "Popular Science" у 1961 році[34].
Ізотопи
| Масове число | Спін | Період напіврозпаду | Реакція отримання[35] | Основні канали розпаду[36] | Продукти розпаду |
|---|---|---|---|---|---|
| 237 | 5/2 | 2.1с | 206Pb(34S,3n)[37] | Поділ(10%) | Різноманітні |
| β+ | Берклій-237 | ||||
| α | Кюрій-233 | ||||
| 238 | 0 | 21.1мс | 207Pb(34S,3n) | Поділ | Різноманітні |
| 239 | 5/2 | 39с | α-розпад 243Fm | β+ | Берклій-239 |
| α | Кюрій | ||||
| 240 | 0 | 57.6с | 233U(12C,5n) | α(98%) | Кюрій-236 |
| Поділ(2%) | Різноманітні | ||||
| 241 | 7/2 | 3.8 хв | 233U(12C,4n) | β+(75%) | Берклій-241 |
| α(25%) | Кюрій | ||||
| 242 | 0 | 3.7 хв | 233U(12C,3n) | β+(20%) | Берклій-242 |
| α(80%) | Кюрій | ||||
| 243 | 1/2 | 10.7 хв | 235U(12C,4n) | β+(86%) | Берклій-243 |
| α(14%) | Кюрій | ||||
| 244 | 0 | 19.4 хв | 244Cm(α,4n) 236U(12C,4n) | α | Кюрій-240 |
| 245 | 5/2 | 45 хв | 244Cm(α,3n), 238U(12C,5n) | β+(64%) | Берклій-245 |
| α(36%) | Кюрій | ||||
| 246 | 0 | 35.7 год | 244Cm(α,2n), 246Cm(α,4n) | α | Кюрій-242 |
| 247 | 7/2 | 3.1 год | 244Cm(α,n), 246Cm(α,3n) | ε | Берклій-247 |
| 248 | 0 | 333.5 діб | 246Cm(α,2n) | α | Кюрій-244 |
| 249 | 9/2 | 351 рік | β--розпад 249Bk | α | Кюрій-245 |
| 250 | 0 | 13.08 років | 249Bk + n[38] | α | Кюрій-246 |
| 251 | 1/2 | 898 років | 250Cf + n | α | Кюрій-247 |
| 252 | 0 | 2.645 років | 251Cf + n | α(96.908%) | Кюрій-248 |
| Поділ(3.092%) | Різноманітні | ||||
| 253 | 7/2 | 17.81 діб | 252Cf + n | β- | Ейнштейній-253 |
| 254 | 0 | 60.53 діб | 253Cf + n | Поділ | Різноманітні |
| 255 | 7/2 | 85 хв | 254Cf(n, gamma) | β- | Ейнштейній-255 |
| 256 | 0 | 12.3 хв | 254Cf(t, p)[39] | Поділ | Різноманітні |
Примітки
- Californium (Cf) - Discovery, Occurrence, Production, Properties and Applications of Californium(англ.)
- Californium(англ.)
- Californium: radii of atoms and ions(англ.)
- Californium: physical properties(англ.)
- СИБОРГ (Seaborg), Гленн Теодор(рос.)
- Сиборг, 1965, с. 32.
- Курс неорганической химии(рос.)
- Сиборг, 1965, с. 34.
- Сиборг, 1965, с. 35.
- Калифорний(рос.)
- Сиборг, 1965, с. 37.
- Radiological and Chemical Fact Sheets to Support Health Risk Analyses for Contaminated Areas
- Californium-254 and Supernovae(англ.)
- Ruiz-Lapuente, Canal, Isern, 1997, с. 274.
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1523.
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1519.
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1505.
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1522.
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1527.
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1530.
- Going Back to Californium: A Changing View of Covalency(англ.)
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1542.
- Несмеянов, 1978, с. 384.
- Несмеянов, 1978, с. 383.
- Californium(англ.)
- Californium-252: a remarkable versatile radioisotope(англ.)
- Proposed revision of 10CFR Part 71, DOCKET NUMBER Compatibility with ST-I(англ.)
- What is Californium Used For in Everyday Life?(англ.)
- Californium-252 neutron brachytherapy combined with external beam radiotherapy for esophageal cancer: long-term treatment results(англ.)
- About Californium(англ.)
- INSTITUT DE RADIOPROTECTION ET DE SÛRETÉ NUCLÉAIRE DÉPARTEMENT DE PRÉVENTION ET D'ÉTUDE DES ACCIDENTS(англ.)
- Californium Atomic Bullet Архівовано 15 грудня 2018 у Wayback Machine.(англ.)
- Nuclear Bullets: the Most Dangerous Soviet Project(англ.)
- Popular Science(англ.)
- Yoshida, Johnson, Kimura, Krsul, 2010, с. 1499.
- Isotopes of Californium(англ.)
- Бомбардування ядер свинцю ядрами сульфуру, з подальшим випромінюванням трьох миттєвих нейтронів
- захоплення нейтрона
- Бомбардування ядер каліфорнію-254 ядрами тритію, з подальшим випромінюванням протона
Література
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Zenko Yoshida, Stephen G. Johnson, Takaumi Kimura, John R. Krsul. NEPTUNIUM // The Chemistry of the Actinide and Transactinide Elements / L.R. Morss, Norman M. Edelstein, Jean Fuger. — 4. — Дордрехт, Нідерланди : Springer Science & Business Media, 2010. — Т. 6. — 4503 с. — ISBN 9789400702110.
- Г. Сиборг. Искусственные трансурановые элементы. — М. : Атомиздат, 1965. — 168 с.
- Несмеянов А. Радиохимия. — 2. — М. : Химия, 1978. — 560 с.
- P. Ruiz-Lapuente, R. Canal, J. Isern. Thermonuclear Supernovae. — 1. — Дордрехт : Springer Science & Business Media, 1997. — 890 с. — ISBN 9780792343592.
