Селінексор
Селінексор (англ. Selinexor), відомий під брендовою назвою Експовіо та низкою інших — синтетичний лікарський препарат, який відноситься до групи селективних інгібіторів нуклеарного експорту, які застосовуються як протипухлинні засоби. Механізм дії препарату полягає в інгібуванні експортину-1[1], а також блокуванні транспорту низки білків, пов'язаних із ростом пухлинних клітин з ядра клітини до цитоплазми, що спричинює зупинку клітинного циклу, наслідком чого стає апоптоз клітин.[2] Селінексор є першим препаратом з таким механізмом дії.[3][4]
 | |
| Систематична назва (IUPAC) | |
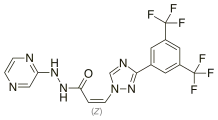
| (2Z)-3-{3-[3,5-Bis(trifluoromethyl)phenyl]-1,2,4-triazol-1-yl}-N′-pyrazin-2-ylprop-2-enehydrazide | |
| Ідентифікатори | |
| Номер CAS | |
| Код ATC | L01 |
| PubChem | |
| DrugBank | |
| Хімічні дані | |
| Формула | C17H11F6N7O |
| Мол. маса | 443,313 г/моль |
| SMILES | & |
| Фармакокінетичні дані | |
| Біодоступність | НД |
| Метаболізм | гепатичний |
| Період напіврозпаду | 6-8 год. |
| Виділення | НД |
| Терапевтичні застереження | |
| Кат. вагітності |
? |
| Лег. статус | |
| Використання | перорально |
Найбільш поширеними побічними ефектами препарату є нудота (або позиви на нудоту), блювання, зниження апетиту, втрата ваги, діарея, втома, тромбоцитопенія, анемія, лейкопенія та гіпонатріємія.[1]
У липні 2019 року Управління з продовольства і медикаментів США (FDA) за пришвидшеною процедурою схвалило селінексор для застосування в комбінації з кортикостероїдним гормоном дексаметазоном для лікування дорослих з рецидивом рефрактерної множинної мієломи, які отримували принаймні 4 інші методи лікування, та чиї хвороба стійка до кількох інших форм лікування, включаючи щонайменше два інгібітори протеасоми, щонайменше два імуномодулюючі засоби, та моноклональне антитіло проти CD38.[5] У грудні 2020 року FDA схвалило селінексор у комбінації з бортезомібом і дексаметазоном для лікування дорослих з множинною мієломою, які отримували принаймні один попередній курс терапії.[6] За даними клінічних досліджень, це було пов'язано з високою частотою серйозних побічних ефектів, включаючи тромбоцитопенію і гіпонатріємію.[4][7][8]
Управління з контролю за продуктами і ліками США (FDA) вважає його першим у своєму класі препаратом.[9] Селінексор був схвалений для медичного застосування в Європейському Союзі в березні 2021 року.[1]
Медичне застосування
Селінексор схвалений у комбінації з бортезомібом і дексаметазоном для лікування дорослих з множинною мієломою, які отримували принаймні один попередній курс терапії.[10] Селінексор також схвалений для застосування в комбінації з дексаметазоном у хворих з рецидивом або рефрактерною множинною мієломою, які отримували принаймні 4 попередні курси терапії, та чия хвороба рефрактерна до принаймні двох інгібіторів протеосом, принаймні двох імуномодулюючих засобів, та моноклонального антитіла проти CD38 (так звана «квадрефрактерна» або «пента-рефрактерна» мієлома)[11], для якої немає інших варіантів лікування.[4][7] Це перший препарат, схвалений для цього показу.[12]
У червні 2020 року FDA схвалило додаткові покази до застосування селінексору, зокрема для лікування дорослих з рецидивом або рефрактерною дифузною великоклітинною лімфомою, не зазначеної як інша хвороба, включаючи дифузну великоклітинну лімфому, що виникає внаслідок фолікулярної лімфоми, принаймні після 2 курсів системної терапії.[13]
У Європейському Союзі селінексор показаний у комбінації з дексаметазоном для лікування множинної мієломи у дорослих, які отримували принаймні 4 попередні методи лікування, та чия хвороба рефрактерна до принаймні двох інгібіторів протеасоми, двох імуномодулюючих засобів та моноклонального антитіла проти CD38 , і в яких спостерігається прогресування захворювання під час останньої терапії.[1]
Побічні ефекти
У клінічному дослідженні (дослідження BOSTON), яке проводилося для підтвердження схвалення FDA у хворих із множинною мієломою після принаймні одного попереднього курсу терапії (один раз на тиждень у комбінації з бортезомібом та дексаметазоном один раз на тиждень), найпоширенішими побічними реакціями були цитопенія, шлунково-кишкові та конституційні симптоми та відповідали тим, про які повідомлялося раніше в інших дослідженнях селінексору. Більшість побічних реакцій можна було зменшити за допомогою модифікації дози та/або стандартної підтримуючої терапії. Найпоширенішими негематологічними побічними реакціями були втома (59 %), нудота (50 %), зниження апетиту (35 %) та діарея (32 %), які могли бути віднесеними переважно до 1 та 2 ступеня важкості. Найчастішими побічними реакціями, які можна було б віднести до 3 і 4 ступеня важкості, були тромбоцитопенія (43 %), лімфопенія (38 %), втома (28 %) та анемія (17 %).[14]
Найпоширенішими побічними реакціями (з частотою більшою або рівною 20 %) у хворих з дифузною великоклітинною В-клітинною лімфомою, за винятком змін у лабораторних аналізом, були втома, нудота, діарея, зниження апетиту, зниження ваги, запор, блювота та підвищення температури тіла. Зміни в лабораторних аналізах 3-4 ступеня у більш ніж 15 % випадків були представлені тромбоцитопенією, лімфопенією, нейтропенією, анемією та гіпонатріємією. Серйозні побічні реакції спостерігалися у 46 % осіб, найчастішими з яких були інфекційні ускладнення. [14] Тромбоцитопенія була основною причиною зміни дози препарату. Шлунково-кишкова токсичність виникла у 80 % хворих, а гіпонатріємія будь-якого ступеня — у 61 %. Побічні реакції з боку центральної нервової системи спостерігалися у 25 % хворих, включаючи запаморочення та зміни психічного стану.[13]
Інструкція препарату містить попередження та запобіжні заходи щодо тромбоцитопенії, нейтропенії, шлунково-кишкової токсичності, гіпонатріємії, серйозних інфекцій, неврологічної токсичності та токсичності для ембріона і плода.[15][13]
Механізм дії
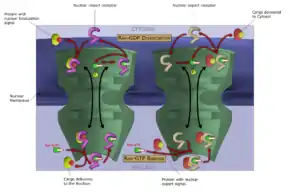
Як і інші селективні інгібітори нуклеарного експорту, селінексор діє шляхом зв'язування з експортином-1(також відомим як XPO1 або CRM1). XPO1 — це каріоферин, який здійснює нуклеарний транспорт кількох білків, включаючи пухлинні супресори, онкогени та білки, які беруть участь у регулюванні росту клітин, від ядра клітини до цитоплазми; і часто цей процес надмірно виражений, і він неправильно регулюється при кількох типах раку. Інгібуючи протеїн XPO1, інгібітори нуклеарного експорту призводять до накопичення пухлинних супресорів у ядрі злоякісних клітин, і знижують рівень онкогенних продуктів, які стимулюють проліферацію клітин. Це в кінцевому підсумку призводить до зупинки клітинного циклу та загибелі ракових клітин шляхом апоптозу.[2][3][15] В умовах in vitro цей ефект не діє на нормальні (незлоякісні) клітини.[2][16]
Інгібування XPO1 впливає на багато різних клітин організму, що може пояснити частоту побічних реакцій на селінексор. Зокрема, тромбоцитопенія є механічним і дозозалежним ефектом, який виникає у зв'язку з тим, що селінексор спричинює накопичення фактора транскрипції STAT3 в ядрі гемопоетичних стовбурових клітин, запобігаючи їх диференціювання в зрілі мегакаріоцити (клітини, що виробляють тромбоцити), і таким чином уповільнюючи вироблення нових тромбоцитів.[3]
Хімічна структура
Селінексор — це повністю синтетична низькомолекулярна сполука, розроблена за допомогою процесу конструювання ліків на основі структури, відомого як індукована підгонка. Він зв'язується із залишком цистеїну в борозенці нуклеарного експортного сигналу експортину-1. Хоча цей зв'язок є ковалентним, він є частково оборотним.[2]
Історія
Селінексор був розроблений компанією" Karyopharm Therapeutics" — фармацевтичною компанією, яка зосереджена на розробці ліків, спрямованих на нуклеарний транспорт. Препарат був схвалений у США в липні 2019 року[17][5][18] на основі клінічного дослідження фази IIb з однією групою. FDA вирішило надати прискорене схвалення селінексору, незважаючи на попередню рекомендацію консультативного комітету FDA, яка проголосувала зі співвідношенням 8–5 за відкладення схвалення препарату до тих пір, поки не будуть відомі результати дослідження фази III, що ще тривала.[4]
Селінексор у комбінації з дексаметазоном отримав прискорене схвалення та отримав статус орфанного препарату. FDA надало схвалення препарату компанії «Karyopharm Therapeutics» під назвою Експовіо.[5]
У червні 2020 року FDA схвалило додаткові показання до застосування селінексору для лікування дорослих з рецидивом або рефрактерною дифузною великоклітинною лімфомою, не зазначеної як інша, включаючи дифузну великоклітинну лімфому, що виникла внаслідок фолікулярної лімфоми, принаймні після двох курсів системної терапії.
Схвалення препарату було засновано на SADAL — багатоцентровому відкритому клінічному дослідженні з одною групою учасників із дифузною великоклітинною лімфомою після 2—5 курсів лікування за стандартними схемами. Учасники отримували селінексор у дозі 60 мг перорально в перший і третій дні кожного тижня.[13]
У грудні 2020 року FDA розширило показання для застосування селінексора, включивши його комбінацію з бортезомібом і дексаметазоном для лікування дорослих з множинною мієломою, які отримували принаймні один попередній курс стандартної терапії.
Суспільство і культура
Юридичний статус
28 січня 2021 року Комітет лікарських препаратів для людей Європейського агентства з лікарських засобів прийняв позитивний висновок, рекомендуючи надати умовну реєстраційну ліцензію на лікарський засіб «Нексповіо» (селінексор), призначений для лікування рецидивів та рефрактерних випадків множинної мієломи. Заявником цього лікарського засобу виступила компанія «Karyopharm Europe GmbH».[19]
Клінічні дослідження
Під кодовою назвою KPT-330 селінексор проходив дослідження на кількох доклінічних моделях раку на тваринах, включаючи рак підшлункової залози, рак молочної залози, недрібноклітинний рак легень, лімфоми, та гострі та хронічні лейкемії. Ранні клінічні випробування (фаза I) на людях були проведені на неходжкінській лімфомі, бластному кризі, та широкому спектрі поширених або рефрактерних солідних пухлин, включаючи рак товстої кишки, рак голови та шиї, меланому, рак яєчника, і рак простати. Також повідомлялося про застосування препарату як терапії відчаю у пацієнтів з гострим мієлоїдним лейкозом.[20]
Основним клінічним дослідженням, яке підтвердило схвалення селінексору для хворих із рецидивуючою або рефрактерною множинною мієломою, було відкрите дослідження 122 пацієнтів, відоме як дослідження STORM.[15] Усі зареєстровані хворі отримували середньозважений курс з 7 попередніх схем лікування, включаючи звичайну хіміотерапію, цільову терапію бортезомібом, карфілзомібом, леналідомідом, помалідомідом та моноклональними антитілами (даратумумаб або ізатуксимаб)[11]; майже всі також перенесли трансплантацію гемопоетичних стовбурових клітин, але в усіх хвороба продовжувала прогресувати.[15] Загальний рівень відповіді на лікування становив 26 %, включаючи дві виражені повні відповіді; 39 % хворих мали мінімальну відповідь або дещо кращу. Середня тривалість відповіді становила 4,4 місяця, медіана виживання без прогресування — 3,7 місяця, а медіана загальної виживаності — 8,6 місяця.[21]
Станом на 2019 рік тривали дослідження у фазі I/II і III[4][20][22], включаючи використання селінексора при інших видах раку, та в комбінації з іншими препаратами, що використовуються для лікування множинної мієломи.[3]
У листопаді 2020 року в журналі «The Lancet» були опубліковані результати багатоцентрового рандомізованого клінічногодослідження III фази (NCT03110562), в якому оцінювали результати лікування 402 учасників з рецидивом або рефрактерною множинною мієломою, які отримували від 1 до 3 попередніх курсів стандартної терапії.[23] Дослідження було розроблено для порівняння ефективності, безпеки та певних параметрів якості життя, пов'язаних зі здоров'ям, при застосуванні селінексору один раз на тиждень у комбінації з прийомом бортезомібу один раз на тиждень та з низькою дозою дексаметазону, а також з дворазовим прийомом бортезомібу і низькими дозами дексаметазону. Первинною кінцевою точкою дослідження була виживаність без прогресування, а ключовими вторинними кінцевими точками були загальна частота відповіді, частота периферичної нейропатії та інші. Крім того, дослідження BOSTON дозволило пацієнтам з контрольної групи Vd перейти на групу SVd після об'єктивного (кількісного) прогресування захворювання, підтвердженого незалежним комітетом з огляду. Дослідження BOSTON проводилося в більш ніж 150 клінічних центрах по всьому світу.
Хоча у дослідженні була одна з найвищих часток пацієнтів із цитогенетикою високого ризику (~50 %) у порівнянні з іншими дослідженнями Velcade щодо попередньо лікованої мієломи, медіана PFS у групі SVd становила 13,93 місяця порівняно з 9,46 місяцями у групі SVd. Група Vd, що представляє збільшення медіанної виживаності без прогресування на 4,47 місяця (47 %) (відношення ризику [HR]=0,70; p=0,0075). Група SVd також продемонструвала значно більшу частоту загальної відповіді на лікування порівняно з групою Vd (76,4 % проти 62,3 %, p=0,0012). Хворі, які отримували лише одну попередню лінію терапії, також продемонстрували вищу загальну частоту відповіді в групі SVd порівняно з Vd (80,8 % проти 65,7 %, p=0,0082). Важливо, що терапія SVd порівняно з терапією Vd показала збільшення частоти виживання та більшу частоту загальної відпвіді у кількох важливих підгрупах.[23]
Станом на травень 2020 року селінексор проходив клінічні дослідження для лікування COVID-19 у низці закладів, зокрема лікарні Ліхай-Веллі в [[Аллентаун (Пенсільванія)|]Аллентауні] в Пенсільванії.[24]
Примітки
- Nexpovio EPAR. European Medicines Agency (EMA). 25 січня 2021. Процитовано 27 травня 2021. (англ.)
- Fung HY, Chook YM (Серпень 2014). Atomic basis of CRM1-cargo recognition, release and inhibition. Seminars in Cancer Biology 27: 52–61. PMC 4108548. PMID 24631835. doi:10.1016/j.semcancer.2014.03.002. (англ.)
- Gandhi UH, Senapedis W, Baloglu E, Unger TJ, Chari A, Vogl D, Cornell RF (травень 2018). Clinical Implications of Targeting XPO1-mediated Nuclear Export in Multiple Myeloma. Clinical Lymphoma, Myeloma & Leukemia 18 (5): 335–345. PMID 29610030. doi:10.1016/j.clml.2018.03.003. (англ.)
- Feuerstein, Adam (3 липня 2019). FDA approves new multiple myeloma drug despite toxicity concerns. STAT. Процитовано 6 липня 2019. (англ.)
- FDA approves new treatment for refractory multiple myeloma. U.S. Food and Drug Administration (FDA) (прес-реліз). 3 липня 2019. Архів оригіналу за 20 листопада 2019. Процитовано 20 листопада 2019. (англ.)
- Karyopharm Announces FDA Approval of XPOVIO® (Selinexor) as a Treatment for Patients with Multiple Myeloma After at Least One Prior Therapy. (англ.)
- Mulcahy, Nick (3 липня 2019). FDA Approves Selinexor for Refractory Multiple Myeloma. Medscape. Процитовано 6 липня 2019. (англ.)
- Drug Trials Snapshots: Xpovio. U.S. Food and Drug Administration (FDA). 16 липня 2019. Архів оригіналу за 20 листопада 2019. Процитовано 20 листопада 2019. (англ.)
- New Drug Therapy Approvals 2019. U.S. Food and Drug Administration. 31 грудня 2019. Процитовано 15 вересня 2020. (англ.)
- Karyopharm Announces FDA Approval of XPOVIO® (Selinexor) as a Treatment for Patients with Multiple Myeloma After at Least One Prior Therapy. (англ.)
- Chim CS, Kumar SK, Orlowski RZ, Cook G, Richardson PG, Gertz MA, Giralt S, Mateos MV, Leleu X, Anderson KC (Лютий 2018). Management of relapsed and refractory multiple myeloma: novel agents, antibodies, immunotherapies and beyond. Leukemia 32 (2): 252–262. PMC 5808071. PMID 29257139. doi:10.1038/leu.2017.329. (англ.)
- Barrett, Jennifer (3 липня 2019). New Treatment for Refractory Multiple Myeloma Granted FDA Approval. Pharmacy Times. Процитовано 7 липня 2019. (англ.)
- FDA approves selinexor for relapsed/refractory diffuse large B-cell ly. U.S. Food and Drug Administration. 22 червня 2020. Процитовано 24 червня 2020. (англ.)
- Prescribing Information (англ.)
- Xpovio- selinexor tablet, film coated. DailyMed. 19 серпня 2019. Процитовано 20 листопада 2019. (англ.)
- Chen C, Siegel D, Gutierrez M, Jacoby M, Hofmeister CC, Gabrail N, Baz R, Mau-Sorensen M, Berdeja JG, Savona M, Savoie L, Trudel S, Areethamsirikul N, Unger TJ, Rashal T, Hanke T, Kauffman M, Shacham S, Reece D (Лютий 2018). Safety and efficacy of selinexor in relapsed or refractory multiple myeloma and Waldenstrom macroglobulinemia. Blood 131 (8): 855–863. PMID 29203585. doi:10.1182/blood-2017-08-797886. (англ.)
- Drug Approval Package: Xpovio. U.S. Food and Drug Administration (FDA). 26 липня 2019. Процитовано 24 червня 2020. (англ.)
- Xpovio (selinexor) FDA Approval History. Drugs.com. 3 липня 2019. Процитовано 20 листопада 2019.
- Nexpovio: Pending EC decision. European Medicines Agency (EMA). 29 січня 2021. Процитовано 1 лютого 2021. (англ.)
- Parikh K, Cang S, Sekhri A, Liu D (Жовтень 2014). Selective inhibitors of nuclear export (SINE)--a novel class of anti-cancer agents. Journal of Hematology & Oncology 7: 78. PMC 4200201. PMID 25316614. doi:10.1186/s13045-014-0078-0. (англ.)
- Chari A, Vogl DT, Gavriatopoulou M, Nooka AK, Yee AJ, Huff CA, Moreau P, Dingli D, Cole C, Lonial S, Dimopoulos M, Stewart AK, Richter J, Vij R, Tuchman S, Raab MS, Weisel KC, Delforge M, Cornell RF, Kaminetzky D, Hoffman JE, Costa LJ, Parker TL, Levy M, Schreder M, Meuleman N, Frenzel L, Mohty M, Choquet S, Schiller G, Comenzo RL, Engelhardt M, Illmer T, Vlummens P, Doyen C, Facon T, Karlin L, Perrot A, Podar K, Kauffman MG, Shacham S, Li L, Tang S, Picklesimer C, Saint-Martin JR, Crochiere M, Chang H, Parekh S, Landesman Y, Shah J, Richardson PG, Jagannath S (серпень 2019). Oral Selinexor-Dexamethasone for Triple-Class Refractory Multiple Myeloma. The New England Journal of Medicine 381 (8): 727–738. PMID 31433920. doi:10.1056/NEJMoa1903455. (англ.)
- KPT-330 OR Selinexor Clinical Trials. ClinicalTrials.gov. Процитовано 20 листопада 2019. (англ.)
- Grosicki, Sebastian; Simonova, Maryana; Spicka, Ivan; Pour, Ludek; Kriachok, Iryrna; Gavriatopoulou, Maria; Pylypenko, Halyna; Auner, Holger W.; Leleu, Xavier; Doronin, Vadim; Usenko, Ganna; Bahlis, Nizar J.; Hajek, Roman; Benjamin, Reuben; Dolai, Tuphan K.; Sinha, Dinesh K.; Venner, Christopher P.; Garg, Mamta; Gironella, Mercedes; Jurczyszyn, Artur; Robak, Pawel; Galli, Monica; Wallington-Beddoe, Craig; Radinoff, Atanas; Salogub, Galina; Stevens, Don A.; Basu, Supratik; Liberati, Anna M.; Quach, Hang; Goranova-Marinova, Vesselina S.; Bila, Jelena; Katodritou, Eirini; Oliynyk, Hanna; Korenkova, Sybiryna; Kumar, Jeevan; Jagannath, Sundar; Moreau, Phillipe; Levy, Moshe; White, Darrell; Gatt, Moshe E.; Facon, Thierry; Mateos, Maria V.; Cavo, Michele; Reece, Donna; Anderson, Larry D.; Saint-Martin, Jean-Richard; Jeha, Jacqueline; Joshi, Anita A.; Chai, Yi; Li, Lingling; Peddagali, Vishnuvardhan; Arazy, Melina; Shah, Jatin; Shacham, Sharon; Kauffman, Michael G.; Dimopoulos, Meletios A.; Richardson, Paul G.; Delimpasi, Sosana (14 листопада 2020). Once-per-week selinexor, bortezomib, and dexamethasone versus twice-per-week bortezomib and dexamethasone in patients with multiple myeloma (BOSTON): a randomised, open-label, phase 3 trial. The Lancet 396 (10262): 1563–1573. PMID 33189178. doi:10.1016/S0140-6736(20)32292-3. (англ.)
- LVHN Among Early Participants to Test Cancer Drug as COVID-19 Treatment (англ.)
