Софосбувір
Софосбувір (англ. Sofosbuvir, лат. Sofosbuvirum) — синтетичний противірусний препарат з групи нуклеозидних аналогів для перорального застосування.[2] Софосбувір був розроблений американською компанією «Pharmasset», під назвою «Совалді». А з 2012 року, після викуплення акцій «Pharmasset» компанією «Gilead Sciences»[3], подальша розробка і маркетинг препарату проводяться «Gilead Sciences».[4] У 2013 році Управління з продовольства і медикаментів США (FDA) схвалило використання софобусвіра, в комбінації з рибавірином, для лікування гепатиту C, спричиненого вірусом гепатиту С 2 і 3 генотипів; а також для потрійної терапії разом із пегільованим інтерфероном і рибавірином, для лікування гепатиту С, спричиненого вірусом гепатиту С 1 і 4 генотипів[5], — на основі 4 клінічних досліджень ІІІ фази, які проводились на території США.[6] У 2014 році FDA також схвалило застосування софобусвіра у комбінації з іншим противірусним препаратом — ледіпасвіром[7] — на основі клінічних досліджень, проведених на території США, та опублікованих на сайті британського журналу «The Lancet» у листопаді 2013 року.[8] Згідно із попередніми результатами досліджень, ця комбінація має високу ефективність у лікуванні хворих, які інфіковані вірусом гепатиту С 1-го генотипу, який є найбільш поширеним у США, Європі та Японії.[9] У 2014 році «Gilead Sciences» уклала угоду про надання ліцензії сімом індійським фармацевтичним компаніям на виробництво генеричних препаратів софобусвіра та ледіпасвіра на території Індії, та їх продаж на території 91 країни світу. Ця угода була розкритикована міжнародними організаціями, які займаються питаннями лікування і захисту хворих на гепатит С та СНІД, як така, що не дає можливості пацієнтам з гепатитом С у тих країнах, які не увійшли до списку країн із дозволом на продаж генеричного софобусвіру, лікуватись дешевшим аналогом препарату.[10] Україна також не входила в перелік країн, в яких дозволено продаж генеричного софосбувіру. Але вже у 2015 році генеричний препарат софосбувіру був зареєстрований в Україні та включений до переліку лікарських препаратів, що закуповуються за бюджетні кошти.[11][12] У 2016 році оригінальний препарат софосбувіру зареєстрований у Росії[13], яка також не увійшла до попереднього переліку країн, де дозволений продаж генеричного софосбувіру.
 | |
|---|---|
Софосбувір
| |
| Систематизована назва за IUPAC | |
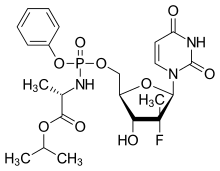
| Isopropyl (2S)-2-[[[(2R,3R,4R,5R)-5-(2,4-dioxopyrimidin-1-yl)-4-fluoro-3-hydroxy-4-methyl-tetrahydrofuran-2-yl]methoxy-phenoxy-phosphoryl]amino]propanoate | |
| Класифікація | |
| ATC-код | J05 |
| PubChem | |
| CAS | |
| DrugBank | |
| Хімічна структура | |
| Формула | C22H29FN3O9P |
| Мол. маса | 529,453 г/моль |
| Фармакокінетика | |
| Біодоступність | 92% |
| Метаболізм | Печінка |
| Період напіввиведення | 24 хв. (софосбувір), 27 год.(метаболіт) |
| Екскреція | Нирки, фекалії |
| Реєстрація лікарського засобу в Україні | |
| Назва, фірма-виробник, країна, номер реєстрації, дата | СОВАЛДІ, «Гілеад Сайєнсиз, Інк.», США UA/14706/01/01 09.10.2015-09.10.2020 ГРАТЕЦІАНО, «ЮРОПІЕН ІДЖІПШЕН ФАРМАС’ЮТІКАЛ ІНДАСТРІЗ»,Єгипет UA/14761/01/01 18.11.2015-18/11/2020 [1] |
Всесвітня організація охорони здоров'я включила софосбувір до списку життєво необхідних лікарських засобів.[14]
Фармакологічні властивості
Софосбувір — синтетичний противірусний препарат з групи нуклеозидних аналогів. Механізм дії препарату полягає в утворенні активного метаболіту препарату (уридинаналогового трифосфату, що має кодову назву GS-461203), який інгібує РНК-полімеразу NS5B вірусу гепатиту С[15] та гальмує реплікацію вірусу гепатиту С 1, 2, 3 та 4 генотипів (згідно даних in vitro, софосбувір гальмує реплікацію вірусів також і 5 та 6 генотипів, які є менш розповсюдженими).[2] Софосбувір, як і інші інгібітори РНК-полімераз вірусу гепатиту С, мають високу стійкість до розвитку толерантності вірусу до препарату в порівнянні з іншими противірусними препаратами (зокрема інгібіторами протеаз), при застосуванні яких частіше спостерігається неефективність лікування гепатиту С.[16][17] Активний метаболіт софосбувіру GS-461203 не є інгібітором РНК- та ДНК-полімерази людини, а також не інгібує мітохондріальну РНК-полімеразу.[2] Софосбувір може ефективно застосовуватись у комбінації з рибавірином в подвійній терапії або разом із рибавірином і пегільованим інтерфероном альфа-2а в потрійній терапії гепатиту С[6], а також у комбінації з іншим нуклеотидним аналогом ледіпасвіром (інгібітором РНК-полімерази NS5A) (у тому числі у випадках неефективності подвійної або потрійної терапії гепатиту С) при меншій кількості побічних ефектів.[8][18] Окрім меншої кількості побічних ефектів, софосбувір має більш високу ефективність у порівнянні з раніше синтезованими противірусними препаратами, а також потребує у 2—4 рази коротшого терміну застосування для ефективної елімінації вірусу гепатиту С.[19][20][21]
Фармакокінетика
Софосбувір швидко всмоктується при пероральному застосуванні, біодоступність препарату складає 92 %. Максимальна концентрація софосбувіру в крові досягається протягом 0,5—2 годин після прийому препарату. Софосбувір швидко метаболізується з утворенням неактивного метаболіту під кодовою назвою GS-331007, максимальна концентрація якого досягається протягом 2—4 годин після перорального прийому софосбувіру. Прийом софосбувіру з жирною їжею сповільнює всмоктування препарату, але збільшує об'єм його всмоктування. Софосбувір добре, на 85 % зв'язується з білками плазми крові[2] (згідно даних фірми-основного виробника, зв'язування з білками складає 61—65 %[22]). Неактивний метаболіт софосбувіру концентрується в печінці, де метаболізується з утворенням активного метаболіту під кодовою назвою GS-461203 шляхом гідролізу частини етеру карбонової кислоти із відщепленням фосфорамідату протеїном, який зв'язує тривалентний гістиннуклеотид 1 (HINT1), що супроводжується фосфорилюванням із утворенням піримідинового нуклеотиду.[2][22] Виводиться софосбувір із організму переважно (на 80 %) з сечею у вигляді метаболітів, частково виводиться з калом. у незначній кількості виводиться також із повітрям, яке видихається. Період напіввиведення софосбувіру в середньому становить 24 хвилини (0,4 год.) по основному препарату і 27 годин по основному метаболіту, даних за збільшення цього часу при печінковій та нирковій недостатності, а також у літніх людей, немає.[2][22]
Показання до застосування
Софосбувір застосовують при хронічному вірусному гепатиті C у дорослих у комбінації з іншими противірусними препаратами[2][22] (рибавірином та пегільованим інтерфероном[6], ледіпасвіром[8], даклатасвіром[23][24][25]). Монотерапію софосбувіром не проводять.[2][22] Софосбувір можна застосовувати також при поєднаній інфекції ВІЛ та гепатиту С.[2][22]
Побічна дія
При застосуванні софосбувіру побічні ефекти спостерігають рідше, ніж при застосуванні інших противірусних засобів, частіше при спільному застосуванні з рибавірином.[8][18] При застосуванні софосбувіру (у комбінації з іншими противірусними препаратами) можливі наступні побічні ефекти[2][22]:
- З боку травної системи — дуже часто (більше 10 %) нудота, блювання, діарея, зниження апетиту; часто (1—10 %) запор, сухість у роті, похудіння, диспепсія, гастроезофагеальний рефлюкс.
- З боку нервової системи — дуже часто (більше 10 %) головний біль, запаморочення, безсоння, підвищена втомлюваність, подразливість; часто (1—10 %) загальна слабість, депресія, нечіткість зору, зниження концентрації уваги, мігрень.
- З боку дихальної системи та ЛОР-органів — дуже часто (більше 10 %) кашель, задишка, часто (1—10 %) ринофарингіт або грипоподібні захворювання, біль у грудях.
- З боку опорно-рухового апарату — дуже часто (більше 10 %) міалгії, артралгії; часто (1—10 %) спазм м'язів, біль у спині.
- Інші побічні ефекти — дуже часто (більше 10 %) гарячка.
- Зміни в лабораторних аналізах — дуже часто (більше 10 %) анемія, нейтропенія, лімфопенія, тромбоцитопенія, підвищення концентрації білірубіну в крові.
Взаємодія з іншими лікарськими препаратами
При одночасному застосуванні софосбувіру (найчастіше у комбінації з ледіпасвіром, даклатасвіром або симепревіром) та антиаритмічного препарату аміодарону спостерігають симптоматичну брадикардію, у тому числі зі смертельними випадками та потребою застосування штучного водія ритму серця.[26][27] При одночасному застосуванні софосбувіру з інгібіторами P-глікопротеїну — рифампіцином та іншими препаратами з групи рифаміцинових антибіотиків, карбамазепіном, фенітоїном або звіробоєм — може знижуватися концентрація софосбувіру в крові При одночасному застосуванні софосбувіру з типранавіром також можна спостерігати зниження концентрації софосбувіру в крові.[2][22] Даних за взаємодію софосбувіру з іншими лікарськими засобами, включно з циклоспорином, дарунавіром, ефавірензом, емтрицитабіном, метадоном, ралтегравіром, рілпівірином, такролімусом,тенофовіром і пероральними контрацептивами, не виявлено.[28][2][22]
Протипокази
Софосбувір протипоказаний при підвищеній чутливості до препарату. Препарат не рекомендований до застосування при вагітності та годуванні грудьми, а також у дитячому віці.[2][22]
Форми випуску
Софосбувір випускають у вигляді таблеток по 0,4 г.[2][22] Софосбувір випускають також у комбінації з іншим противірусним препаратом ледіпасвіром по 0,4 г софосбувіру та 0,09 г ледіпасвіру під торговельною назвою «Харвоні».[8][18]
Див. також
Примітки
- Державний реєстр лікарських засобів України
- http://compendium.com.ua/info/255035 (рос.)
- Staton, Tracy (14 липня 2014). Riled by $84,000 Sovaldi, Senate panel digs into Gilead's Pharmasset buy. Fierce Pharma. Процитовано 27 жовтня 2015.
- PSI-7977. Gilead Sciences. (англ.)
- Tucker M (December 6, 2013). FDA Approves 'Game Changer' Hepatitis C Drug Sofosbuvir. Medscape. (англ.)
- Новый препарат софосбувир для лечения вирусного гепатита С (рос.)
- FDA approves first combination pill to treat hepatitis C. (англ.)
- Предварительные данные по клиническим исследованиям комбинации препаратов Софосбувир и Ледипасвир (рос.)
- www.gilead.com. (англ.)
- Лицензия «Гилеад» на препараты против гепатита С, софосбувир и ледипасвир: плохая сделка (рос.)
- Інноваційне лікування гепатиту С стане доступним українським пацієнтам вже цього року
- Впровадження в Україні програми лікування вірусного гепатиту С із застосуванням препарату софосбувір. Архів оригіналу за 17 червня 2016. Процитовано 21 травня 2016.
- Софосбувир зарегистрирован в России (рос.)
- Essential Medicines WHO Model List, 19th edition, April 2015. World Health Organization. 2015. Процитовано 2015. (англ.)
- Fung, A; Jin, Z; Dyatkina, N; Wang, G; Beigelman, L; Deval, J (2014). Efficiency of incorporation and chain termination determines the inhibition potency of 2'-modified nucleotide analogs against hepatitis C virus polymerase. Antimicrobial Agents and Chemotherapy 58 (7): 3636–45. PMC 4068585. PMID 24733478. doi:10.1128/AAC.02666-14. (англ.)
- Chae HB, Park SM, Youn SJ (2013). Direct-acting antivirals for the treatment of chronic hepatitis C: open issues and future perspectives. ScientificWorldJournal 2013: 704912. PMC 3687480. PMID 23844410. doi:10.1155/2013/704912.
- Wu S, Kanda T, Nakamoto S, Imazeki F, Yokosuka O (Грудень 2013). Hepatitis C virus protease inhibitor-resistance mutations: Our experience and review. World J. Gastroenterol. 19 (47): 8940–8948. PMC 3870547. PMID 24379619. doi:10.3748/wjg.v19.i47.8940. (англ.)
- Харвони (рос.)
- Berden FA, Kievit W, Baak LC, et al. (Жовтень 2014). Dutch guidance for the treatment of chronic hepatitis C virus infection in a new therapeutic era. Neth J Med 72 (8): 388–400. PMID 25387551.
- Cholongitas E, Papatheodoridis GV (2014). Sofosbuvir: a novel oral agent for chronic hepatitis C. Ann Gastroenterol 27 (4): 331–337. PMC 4188929. PMID 25332066.
- Tran TT (Грудень 2012). A review of standard and newer treatment strategies in hepatitis C. Am J Manag Care 18 (14 Suppl): S340–9. PMID 23327540.
- Совалді. Інструкція для застосування (англ.)
- AASLD 2012: Sofosbuvir and daclatasvir dual regimen cures most people with HCV genotypes 1, 2, or 3. News. European Liver Patients Association. 21 листопада 2012. Архів оригіналу за 6 жовтня 2015. Процитовано 22 травня 2016. (англ.)
- Childs-Kean, Lindsey (16 січня 2015). Simeprevir and Sofosbuvir for Treatment of Chronic Hepatitis C Infection. Clinical Therapeutics 37 (2): 243–67. PMID 25601269. doi:10.1016/j.clinthera.2014.12.012. (англ.)
- Smith, Michael (16 грудня 2014). Interferon-/Ribavirin-Free Regimen for Chronic Hepatitis C Virus Infection. Annals of Pharmacotherapy 49 (3): 343–50. PMID 25515863. doi:10.1177/1060028014563952. Архів оригіналу за 27 лютого 2015. (англ.)
- «Gilead Warns After Hepatitis Patient on Heart Drug Dies» (англ.)
- FDA Drug Safety Communication. 24 березня 2015. Процитовано 24 березня 2015. (англ.)
- Karageorgopoulos DE, El-Sherif O, Bhagani S, Khoo SH., Curr Opin Infect Dis. 2014 Feb;27(1):36-45. doi: 10.1097/QCO.0000000000000034. Review. Drug interactions between antiretrovirals and new or emerging direct-acting antivirals in HIV/hepatitis C virus confection (англ.)
Посилання
- Софосбувір на сайті mozdocs.kiev.ua
- Approval of Sovaldi (sofosbuvir) tablets for the treatment of chronic hepatitis C (англ.). FDA. Процитовано 25 січня 2016.
- Sofosbuvir (англ.). drugs.com. Процитовано 25 січня 2016.
- Сайт препарату в Україні