Хвороба котячих подряпин
Хворо́ба котя́чих подря́пин (син. хвороба котячої подряпини, хвороба від котячих подряпин, феліно́з, доброякісний лімфоретикульо́з, підгострий регіонарний лімфаденіт, гарячка від котячої подряпини, англ. cat-scratch disease[2],Teeny's Disease, inoculation lymphoreticulosis, subacute regional lymphadenitis, фр. La maladie des griffes de chat) — зооноз, який спричинюють бартонели внаслідок контактної передачі від заражених котів. У типових випадках перебігає у вигляді доброякісного лімфаденіту, рідше з появою тривалої гарячки, ураження печінки, головного мозку, тяжких проявів у людей з імунодефіцитом.
| Хвороба котячих подряпин | |
|---|---|
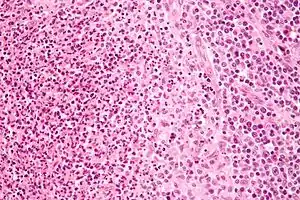 Біоптат лімфатичного вузла з великою кількістю Bartonella henselae, з гранульомами (бліді клітини у правій частині зображення) й мікроабсцесами з нейтрофілів зліва від центру. (фарбування гематоксилін-еозином, велике збільшення) Біоптат лімфатичного вузла з великою кількістю Bartonella henselae, з гранульомами (бліді клітини у правій частині зображення) й мікроабсцесами з нейтрофілів зліва від центру. (фарбування гематоксилін-еозином, велике збільшення) | |
| Спеціальність | інфекційні хвороби |
| Симптоми | озноб[1] |
| Причини | Bartonella henselaed[1] |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 1B98 |
| МКХ-10 | A28.1 |
| DiseasesDB | 2173 |
| MedlinePlus | 001614 |
| eMedicine | emerg/84 |
| MeSH | D002372 |
| | |
Історія відкриття збудника
Вважають, що першим зробив опис стану, що пов'язаний із хворобою котячих подряпин, французький невролог й офтальмолог А. Паріні у 1889 році, коли він зафіксував передачу від кота до хворої людини захворювання, що перебігало з гарячкою разом з фолікулярним кон'юнктивітом та одностороннім реґіонарним привушним лімфаденітом[3]. Надалі, у медичній літературі це стали називати окулогландулярним синдромом Паріні. Тепер відомо, що подібні випадки частіше спричиняються саме хворобою котячих подряпин, хоча такі прояви при ній взагалі то зустрічаються досить рідко[4]. Однак такий клінічний синдром може формуватися й через ураження вірусом герпесу I типу, збудниками туляремії та ін. У 1950 році французький педіатр Р. Дебре детально описав типові прояви хвороби котячих подряпин, пов'язавши її виникнення з пошкодженнями шкіри людини, що були нанесені котами, та давши їй сучасну назву[5].
Питання про збудника, що породжує захворювання, тривало дискутувалося. Спочатку хворобу котячих подряпин вважали одним з можливих проявів туляремії, згодом, оскільки виділити збудник від хворих не вдавалося, висувалися найрізноманітніші версії — що хвороба спричинена гіпотетичним вірусом, потім — що збудник хвороби належить до хламідій[6]. У 1983 р. в США при дослідженні хворих з хворобою котячих подряпин в стінці кровоносних судин, розташованих поблизу уражених лімфатичних вузлів, поза зоною некрозу, в кон'юнктивальних гранульомах, а також в пунктатах з печінки й селезінки метод сріблення за Вортін-Старрі були виявлені плеоморфні дрібні бактерії[7]. Саме ці мікроорганізми спочатку були об'явлені причиною хвороби котячої подряпини і отримали назву Afipia felis[8],[9]. Тривалий час вважали, що саме так це і є, однак у хворих людей не виявляли жодних антитіл до цього збудника. Й тільки в 1990 році Р. Регнері з співавторами з крові котів був виділений збудник[10],[11],[12], який у 1992 р. був знайдений й у лімфовузлах хворої людини[13]. У 1993 році, після вивчення будови його рибосомної РНК, цей мікроб був зарахований до бартонел та отримав сучасну назву Bartonella henselae (на честь Дайян Хенсел, яка виокремила багато штамів у пацієнтів в Оклахомі). В той період у хворих на хворобу котячих подряпин людей були знайдені антитіла до цієї бартонели в досить великих титрах[14]. ПЛР із застосуванням специфічних праймерів до Bartonella spp. і A. felis у хворих з хворобою котячої подряпини встановила, що в 96 % випадків у них виявлялася ДНК Bartonella, тоді як ДНК A. felis не виявлялася в жодному разі[15]. Схожі дані, яки підтвердили ключову роль саме B. henselae в розвитку хвороби котячої подряпини, були отримані й при подальших імунологічних дослідженнях[16],[17]. А в 1994 р. Джілл Кларрідж із співавторами виділила з крові хворого в Техасі та від його кота нову бартонелу, що спричиняла хворобу з передачею від котячих[18], яку на честь першовідкривача назвали Bartonella clarridgeiae[19].
Актуальність
Захворювання поширене практично всюди, де є домашні та бродячі, повторно здичавілі коти, які можуть обмінюватися збудниками з природно дикими котячими. Зважуючи на те, що натепер в світі є приблизно 500 млн домашніх котів, цієї «тварини-компаньона» людей, то поширеність хвороби котячих подряпин має бути значною. Є країни, де домашніх котів практично немає — Перу, Габон, але є держави з значною кількістю котів: в Австралії 9 з 10 родин мають котів, в США в середньому в кожній третій сім'ї є ця домашня тварина. Тому в цих країнах вважають хворобу котячих подряпин найчастішою бартонельозною хворобою, що приводить до необхідності надання медичної допомоги. У США щорічно через неї звертаються амбулаторно по лікарську допомогу 22-25 тисяч хворих, а 2-2,5 тисячі потребують стаціонарного лікування[20]. Взагалі, світова статистика кількості випадків цієї хвороби невідома, але експерти ВООЗ вважають її дуже значною. А з моменту виявлення факту того, що бартонельози взагалі, а хвороба котячих подряпин зокрема, часто призводить до тяжких випадків у імунодепресивних пацієнтів, інтерес до неї в медичній спільноті значно зріс. Вважають, що хвороба котячих подряпин це тільки «верхівка айсберга бартонельозних інфекцій, що передаються від котів»[21].
Етіологія
? Бартонели, що спричиняють хворобу котячих подряпин. | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Біологічна класифікація | ||||||||||||||
| ||||||||||||||
| Bartonella henselae і Bartonella clarridgeiae (Regnery et al. 1992) і (Lawson and Collins 1996[22]) | ||||||||||||||
Посилання | ||||||||||||||
| ||||||||||||||
Нині існують вагомі підтвердження того, що хворобу котячих подряпин спричинюють два види бактерій з роду Bartonella, родини Bartonellaceae — B. henselae і В. clarridgeiae. Перша спричинює більшість випадків цієї інфекції. Це грамнегативні бактерії, що мають форму паличок, факультативні внутрішньоклітинні паразити, рухомі, спор і капсул не утворюють, анаероби, малочутливі до дезінфекційних засобів. Їх важко вирощувати на штучних поживних середовищах. Поза організмом людини і гризунів культивування може здійснюватися в котячих блохах, а також на твердих і напіврідких поживних середовищах, збагачених 5-10 % крові людини або тварин при температурі від 35 до 37°С, з 5-10 % вуглекислого газу і 40 % вологістю[23]. Виділення бартонел значно полегшується, якщо використовувати лінії ендотеліальних клітин, а також лізис-центрифугування крові. Мікроорганізми не проявляють гемолітичних властивостей, інертні до вуглеводів. Ідентифікація виділеного збудника проводиться з використанням специфічних антисироваток, визначенням профілю жирних кислот клітинної стінки або молекулярно-генетичним методом. Бартонел можна виявити в тканинах за допомогою методу імпрегнації сріблом, при цьому вони розташовуються у вигляді розгалужених ланцюжків поблизу колагенових волокон, кровоносних судин, ділянок некрозу. Для Bartonella henselae описані не до кінця прояснені властивості у вигляді дії на лейкоцити людини із зниженням їх оксидативної функції, спонукання проліферації ендотелію. Бартонели хвороби котячої подряпини здатні стимулювати виділення деяких прозапальних цитокінів й мають токсичні ліпополіцукриди, а також фактори, що пригнічують імунну відповідь.
Епідеміологічні особливості
Джерело та резервуар інфекції
Джерелом й резервуаром інфекції є дрібні представники родини котячих, серед яких за близькістю до людини найперше місце посідає домашня кішка. Серед котячих інфекція передається за допомогою їхніх бліх Ctenocephalides felis. Було встановлено, що за відсутності бліх інфікування здорових котячих не відбувається, але є можливість інфікування котячих шляхом внутрішньошкірної інокуляції (як правило, при вилизуванні шерсті) інфікованих випорожнень бліх. B. henselae виявляється в кишечнику бліх протягом 9 днів після інфікування, що свідчить про її розмноження і персистенцію в організмі бліх — тобто того, що блохи є головним резервуаром й джерелом цієї інфекції. Блохи протягом свого життєвого циклу харчуються багато разів і нерозбірливі відносно свого хазяїна, що їх прогодовує. Внаслідок цього вони по черзі присмоктуються до котячих й легко заражаються бартонелами[24]. Встановлено, що резервуаром B. henselae можуть бути й собаки, проте достовірно підтверджених випадків зараження від них людей доки не описано[25]. Останніми роками молекулярно-генетичними методами було продемонстровано, що ДНК B. henselae може виявлятися в іксодових кліщах видів Ixodes persulcatus и Dermacentor reticulatus, хоча їх роль як вектора передачі збудника хвороби котячої подряпини не вивчена[26].
Широке поширення інфекції в теплому й вологому кліматі пояснюється більшою зараженістю котячих, тому що такі кліматичні умови сприяють кращій циркуляції бліх. Котячі переносять хворобу або у легкій формі, а частіше, взагалі, інапарантно, хоча бартонели в їхній крові присутні у значній кількості. Частота бактеріємії в домашніх котів складає до 68,1 %, особливо серед тварин (до 89 %) з тих сімей, в яких власники котів перенесли хворобу котячої подряпини[27]. Більшість з тих котів, що хворіють скрито, носять в собі збудників роками. Бартонели у великій кількості накопичуються у слинних залозах котячих. Зважуючи на механізм полювання цих тварин, що полюють завжди поодинці, а це вимагає прихованого підкрадання до здобичі, через що будь-які котячі згідно вродженого рефлексу ретельно вилизують свої шерсть та кігті, аби максимально зняти свій запах. Тому у заражених котів завжди на них є залишки слини, що містять бартонели.

Механізм і шляхи передачі
Головний механізм передачі інфекції від котів людям — контактний. Передавання йде через укуси, маленькі садна, подряпини, що наносяться котами, а також при потраплянні слини цих домашніх тварин на пошкодження шкіри, що вже існували. Котам властиве вилизувати руки хазяїна, через що й відбувається певна кількість випадків зараження. Навіть якщо сильно погладити зараженого кота долонею, на якій є пошкодження, це може призвести до зараження людини. Найчастіше передача інфекції відбувається від котів до 1 року, тому що серед молодих тварин йде найбільша циркуляція збудників, старіші тварини вже набувають імунітет. Відомо, що господарі кошенят, вік яких менше 12 місяців, піддаються в 15 разів більшому ризику зараження в порівнянні з власниками дорослих котів, ще й тому що кошенятам більш властиве нанесення подряпин та укусів через високий ступінь грайливості. Вважають, що ризик зараження хазяїв котів із наявністю бліх у 29 разів вищий за можливість зараження хазяїв котів без бліх не через можливість укусу блохами, а часте зараження самих котів. Обговорюється рідка можливість трансмісивної передачі інфекції людям від котячих через укуси бліх. Всі шляхи інфікування людини від котів ще до кінця не встановлені, але від хворих людей до інших хвороба не передається. Описані поодинокі випадки проникнення збудників через дихальні шляхи (з пилом) з подальшим розвитком медіастиніту, первинної атипової пневмонії, через мигдалики (первинний афект є там, а регіонарний лімфаденіт формується у підщелепній ділянці), через травний тракт (що супроводжується збільшенням мезентерійних лімфовузлів та клінічною картиною гострого живота)[28]. Але такі варіанти перебігу трапляються вкрай рідко.
Сприйнятливий контингент та імунітет
Сприйнятливість дуже висока, але ступінь відповіді на інфекцію залежить від імунного статусу людини. Хворіють частіше діти (близько 75-80 %), що обумовлено їх більшою схильністю до активних ігор з котами. Найтяжчі форми виникають у імуносупресивних осіб (онкологічних хворих, осіб, які перенесли трансплантацію, ВІЛ-інфікованих тощо)[29]. Після перенесеної хвороби котячих подряпин у імунокомпетентних осіб виникає стійкий імунітет, повторні випадки вкрай рідкі.
Патогенез
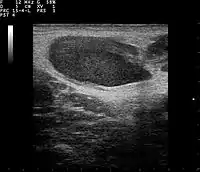
Через крайню рідкість летальних випадків патогенез вивчений недостатньо. Після потрапляння збудників у шкіру там розігрується обмежений некроз, який оточують численні макрофаги, часто багатоядерні гігантські клітини, лімфоцити та еозинофіли. Утворюються регіонарний до місця входження збудників лімфаденіт. Гістологічні зміни в уражених лімфовузлах характеризуються проліферацією гістіоцитів і В-лімфоцитів (стадія ретикулоклітинної гіперплазії), що приводить до утворення гранульом (гранульоматозна стадія) з подальшою нейтрофільною інфільтрацією і розвитком центрального або зірчастого некрозу (стадія мікроабсцедування). При дослідженні біоптатів типовою є комбінація в одній пробі гранульом та мікроабсцесів.
Потрібно відзначити, що у осіб із нормальним станом фонового імунітету хворобі котячих подряпин притаманні гранульоматозні та обмежені гнійні ураження, тоді як у людей з імуносупресивними станами відбувається переважно проліферативні пошкодження судин, особливо виразні при ангіоматозі. При пеліозному гепатиті відбувається дилатація синусоїдів з утворенням численних, різного розміру, заповнених кров'ю лакунарних просторів з наявністю розриву ретикулярних волокон, що підтримують гепатоцити та синусоїди.
Клінічні прояви
Перебіг у імунокомпетентних осіб
Згідно МКХ 10 перегляду виділяють «Хворобу котячих подряпин» А28.1. Інкубаційний період становить від 3 до 30 днів. Хвороба у імунокомпетентних людей перебігає часто скрито, інапарантно, але в типових випадках відбувається поєднане ураження шкіри та регіонарного лімфатичного вузла. На місці проникнення збудника (інокуляції) виникає червоно-коричнева безболісна папула від 3 до 10 мм в діаметрі. Зрідка їх буває декілька уздовж котячої подряпини. Іноді є ексудативний компонент — формується везикула, навіть іноді — пустула. Через 1-3 тижні розвивається однобічний, регіонарний до місця утворення шкірного прояву лімфаденіт. Через часті котячі подряпини, укуси на руці найчастіше виникає відповідний пахвовий лімфаденіт. Рідше пошкодження трапляються на обличчі, тому шийний або підщелепний лімфаденіт спричиняється вдвічі рідше. Лімфатичний вузол або кілька лімфовузлів як правило щільно-еластичні, до 1,0-1,5 см в діаметрі (рідко більше), часто чутливі при пальпації. У невеличкій частині випадків вони болючі, потім розм'якшуються, при цьому біль зменшується, відбувається нагноєння. Може утворитися навіть свищ на поверхню з відходженням гною. Зустрічається генералізація лімфаденопатії, але ураження більше трьох послідовно розташованих груп лімфовузлів вкрай рідке[30]. Захворювання прогресує повільно. Стан пацієнтів, як правило, задовільний, спостерігаються легкі неспецифічні прояви, такі як субфебрилітет, нездужання. Часто процес іде взагалі без підвищення температури та інших проявів, окрім місцевих, регіонарного лімфаденіту. Тривалість інфекційного процесу зазвичай не перевищує 6 місяців[31].
.jpg.webp)
Нетипові прояви в імунокомпетентних осіб
У окремих хворих з фоновою імунокомпетенцією виникають більш тяжкі прояви:
- вже названий вище окуло-гландулярний синдром Паріні;
- нейроретиніт[32], що характеризується втратою зору на одне око з наявністю центральної скотоми, виявами набряку зорового диска та виникнення зіркоподібних змін у макулярній ділянці райдужної оболонки. Все це розвивається без болю в ураженому оці. Зір пацієнта зазвичай відновлюється повністю протягом 1-3 місяців[33];
- гострий енцефаліт: переважаючим симптомом є швидкий розвиток головного болю до летаргії й коми. У таких хворих інколи мають місце судоми. Як правило, відбувається видужання без неврологічних ускладнень, але вкрай рідко можлива й смерть хворого[34],[35];
- ураження кісток і суглобів: остеомієліт (особливо хребетний) та/або різного роду артропатії[36];
- гранульоматозний гепатит, що перебігає доброякісно разом із шкірно-лімфатичними змінами або без них[37];
- різні нетипові шкірні прояви включають неспецифічні висипання, еритему й васкуліт[38];
У окремих групах хворих на хворобу котячих подряпин припадає до 5 % випадків гарячки неясного ґенезу. У таких пацієнтів підвищена ШОЕ, проте лімфаденопатія спостерігається менш ніж в половині випадків[39]. Зрідка хвороба виявляється розвитком міокардиту. Крім того, в хворих можливі різні гематологічні прояви: гемолітична анемія (звичайно поєднується з гепатоспленомегалією)[40], тромбоцитопенічна пурпура (можлива й нетромбоцитопенічна пурпура)[41]. Є випадки розвитку селезінкових абсцесів[40], навіть спонтанного розриву селезінки[42].
Перебіг у осіб з скомпрометованою імунною системою
У осіб із імуносупресією з'являються ендокардит, ураження печінки (пеліозний гепатит), ангіоматоз. У них, як правило, шкірні ураження на місці інокуляції мінімальні, регіонарний лімфаденіт відсутній. Вважають, що бартонельозний ендокардит відбувається у осіб з помірною імуносупресією на тлі хронічного алкоголізму, дефіциту ваги та харчування. Він за клінічними проявами не відрізняється від ендокардиту, що спричинений не бартонелами. При класичному перебігу у хворого виникає гарячка, озноб, слабкість, задишка, пітливість, кашель, шкірний висип, блювання, біль у грудній клітці, в подальшому, втрата ваги, формування пальців у вигляді «барабанних паличок». Але частіше висипання відсутні, у багатьох температура тіла може бути нормальною. При аускультації виявляють серцеві шуми. Швидко прогресує серцева недостатність. Іноді ендокардит поєднується зі змінами нирок і селезінки. Пеліозний гепатит розвивається при виразному ступені імунодефіциту і характеризується тривалою гарячкою, збільшенням печінки, помірними больовими відчуттями внаслідок як подразнення розтягнутої глисонової капсули, так і наявності мезентеріального лімфаденіту, можливий розвиток гострої печінкової недостатності, розрив лакунарних утворень з появою внутрішньопечінкової кровотечі. Нерідко при цьому процесі має місце й пеліозне ураження селезінки, поєднання процесу з ангіоматозом. При ангіоматозі так само розвивається тривала гарячка, виразна інтоксикація, схуднення, формуються великі болючі пухлини шкіри, сполучної тканини, кісток, кісткового мозку, дихальних шляхів, травної системи, лімфатичних вузлів і мозку. У ВІЛ-інфікованих подібні атипові бартонельозні ураження перебігають часто разом з іншими опортуністичними інфекціями та ВІЛ-індикаторними хворобами, тому рідко розпізнаються.
Ускладнення
У імунокомпетентних осіб прогноз, зазвичай, сприятливий, смертельні випадки казуїстичні. Ускладнення рідкі: нагноєння лімфатичних вузлів, рубцеві дефекти шкіри, мезентеріальний лімфаденіт, пневмонії, тромбоцитопенічна пурпура, внутрішньокісткові дефекти, атланто-осьова дислокація (синдром Грізела), епідуральні абсцеси внаслідок остеомієліту, рубцеві зміни й помутніння рогівки, тривалі когнітивні зміни з боку ЦНС. У імуносупресивних осіб при атипових формах хвороби прогноз несприятливий. При ендокардиті часто відбувається розвиток недостатності клапанів із формуванням серцевої недостатності.
Діагностика
Клінічна й загальна діагностика
У типових випадках діагностика виключно клініко-епідеміологічна, ґрунтується на факту наявності контакту з котами, нанесених ними подряпин, саден та укусів, шкірних змін та реґіонарного лімфаденіту. Для типових випадків хвороби котячої подряпини лабораторні зміни не характерні. При гепатиті відбувається помірне підвищення активності амінотрансфераз, при енцефаліті в лікворі незначний лімфоцитарний плеоцитоз із наявністю помірної білково-клітинної дисоціації. У імуносупресивних осіб при цій хворобі відбувається у загальному аналізі крові незначний лейкоцитоз із нейтрофільозом, хоч у ВІЛ-інфікованих, зазвичай лейкопенія. При ураженні печінки проводиться УЗД, КТ.
Специфічна діагностика
Ґрунтується на проведенні РНІФ, ІФА, при цьому чотирикратне зростання титру антитіл у парних сироватках або однократний титр 1:512 чи більше є підтвердженням діагнозу. У розвинених країнах доступна ПЛР. Може проводитися біопсія лімфовузлів, печінки з імпрегнацію сріблом та виявленням в тканинах відповідних бартонел.
Лікування
Типовий перебіг
При типовому перебігу без ускладнень практично не виникає необхідності в проведенні антибактерійної терапії, потрібне лише підтримуюче лікування. Навіть при наявності типового перебігу хвороби котячих подряпин у імуносупресивних осіб доцільність призначення антибактерійних засобів потрібно вирішувати індивідуально у кожному випадку. Для етіотропного лікування використовують азитроміцин по 0,5 г 1 раз в 1-й день, та по 0,25 г раз на день з 2-го по 5-й день. Можливе також застосування доксицикліну по 0,1 г в день тривалістю від 7 до 21-го дня в залежності від клінічної ситуації. Ципрофлоксацин також може бути призначений по 0,25 г 2 рази на день 5-10 днів згідно особливостей перебігу цієї хвороби. Лікування проводять часто в амбулаторних умовах, хворим з імунодефіцитом потрібна більш інтенсивна підтримуюча терапія. Обов'язково проводити ретельне обстеження і антибактерійне лікування в разі погіршення стану, зберігання лімфаденопатії більше ніж 2 місяці.
Атиповий перебіг
При тяжкому атиповому перебігу виникає нерідко необхідність в комбінації антибіотиків, введенні їх парентерально, а тривала антибактерійна терапія дозволяє знизити ризик летального наслідку. Так рекомендують у таких випадках азитроміцин 0,5 г 1 раз на день протягом 1-го тижня, та по 0,25 г в день протягом 4-8 тижнів. Доксициклін рекомендують в указаній вище добовій дозі протягом 3-х місяців. При ендокардиті рекомендують доксициклін по 0,1 г 2 рази на день до 6 тижнів в комбінації з гентаміцином по 0,8-1,2 г 2 рази на день в/в протягом 14 днів. Велике значення має протезування клапанів серця.
Профілактика
Вакцини проти хвороби наразі не існує. Постійно мають проводитися заходи, що направлені на запобігання зараження домашніх котів блохами. Людям треба уникати ранового контакту з бродячими котами. Особам з імунодефіцитами доцільно вибирати як компаньйонів не маленьких кошенят, а тварин, що старші 1 року. Людям потрібно негайно промивати водою з милом та обробляти дезінфікуючими засобами місця укусів та подряпин, що нанесені котами. Обговорюється можливість превентивного антибактерійного лікування доксицикліном осіб, що мають імуносупресивний стан, та отримали пошкодження, яке нанесене котом. Вакцинація, лікування котів, а також їх планове культуральне чи серологічне обстеження вважають нераціональними.
Примітки
- Disease Ontology — 2016.
- Нерідким є написання англ. catscratch disease
- Parinaud H. Conjunctivite infectieuse transmise par les animaux. Ann d'Oculistique1889;101 :252-253
- Grando D, Sullivan LJ, Flexman JP, Watson MW, Andrew JH. Bartonella henselae associated with Parinaud's oculoglandular syndrome. Clin Infect Dis.1999;28 (5):1156-1158
- Debre R, Lamy M, Jammet M, Costil L, Mozzicona P. La maladie des griffes de chat. Bull Mem Soc Med Hop Paris.1950;66 :76-79
- Spoonemore К.J. Cat scratch Disease [Electronic resource] / К.J. Spoonemore, J. McKenzie, G.J. Raugi // eMedicine — Medical Reference. — Updated: Apr. 4, 2008. — Mode of access: http://emedicine.medscape.com/article/1051992-overview
- Wear DJ, Margileth AM, Hadfield TL, Fischer GW, Schlagel CJ, King FM. Cat-scratch disease: a bacterial infection. Science.1983;221 (4618):1403- 1405
- Afipia — створена назва по перших буквах науково-дослідного інституту, де відбулися дослідження(Armed Forces Institute of Pathology), з доданням до благозвучності ia, лат. felis — котяча
- Florin TA, Zaoutis TE, Zaoutis LB (2008). «Beyond cat scratch disease: widening spectrum of Bartonella henselae infection». Pediatrics 121 (5): e1413-25. doi:10.1542/peds.2007-1897
- Тоді його назвали Rochalimaea henselae
- Regnery RL, Olson JG, Perkins BA, Bibb W. Serological response to «Rochalimaea henselae» antigen in suspected cat-scratch disease. Lancet.1992;339 (8807):1443- 1445
- До речі, обидва мікроорганізми A. felis і B. henselae належать до одного підкласу α2-протеобактерій, мають однаковий вигляд при мікроскопії й однаково забарвлюються за Вортін-Старрі, що може й призводило до того часу до можливих помилок при обстеженні.
- Perkins BA, Swaminathan B, Jackson LA et al. Case 22-1992: pathogenesis of cat-scratch disease. N Engl J Med.1992;327(22):1599-1601
- Nadal D. Serology to Bartonella (Rochalimaea) henselae may replace traditional diagnostic criteria for cat-scratch disease [Text] / D. Nadal, R. Zbinden // Eur. J. Pediatr. — 1995. — N 154. — P. 906—908.
- Etiology of cat scratch disease: comparison of polymerase chain reaction detection of Bartonella (formerly Rochalimaea) and Afipia felis DNA with serology and skin tests [Text]/ A.M.C. Bergmans, J. W. Groothedde, J.F.P. Schetlekens [et al.]//J. Infect. Dis. — 1995. — N 171. — P. 916—923.
- Pitfalls and fallacies of cat scratch disease serology: evaluation of Bartonella henselae-based indirect fluorescence assay and enzyme-linked immunoassay [Text] / A.M.C. Bergmans, M.F. Peeters, J.F.P. Schellekens [et al.] // J. Clin. Microbiol. −1997. — N 35. — P. 1931—1937.
- Zeaiter Z, Fournier PE, Raoult D. Genomic variation of Bartonella henselae strains detected in lymph nodes of patients with cat scratch disease. J Clin Microbiol.2002;40 (3):1023-1030
- Clarridge JE, Raich TJ, Pirwani D, Simon B, Tsai L, Rodriguez-Barradas MC, Regnery R, Zollo A, Jones DC, Rambo C, 1995. Strategy to detect and identify Bartonella species in routine clinical laboratory yields Bartonella henselae from human immunodeficiency virus-positive patient and unique Bartonella strain from his cat. J Clin Microbiol 33: 2107—2113.
- LAWSON (P.A.) and COLLINS (M.D.): Description of Bartonella clarridgeiae sp. nov. isolated from the cat of a patient with Bartonella henselae septicemia. Med. Microbiol. Lett., 1996, 5, 64-73
- Jackson LA, Perkins BA, Wenger JD. Cat scratch disesae in the United States: an analysis of three national databases. Am J Public Health.1993;83 (12):1707-1711
- Reynolds MG, Holman RC, Curns AT, O'Reilly M, McQuiston JH, Steiner CA. Epidemiology of cat-scratch disease hospitalizations among children in the United States. Pediatr Infect Dis J.2005;24 (8):700-704
- LPSN bacterio.net
- А. В. Бондаренко, С. І. Похил, О. В. Бондаренко та ін. Бактеріологічний метод діагностики бартонельозної інфекції. Лабораторная диагностика. — 2007. — № 2 (40). — С. 51-56.
- Chomel BB, Abbott RC, Kasten KA, et al. Experimental transmission of Bartonella henselae by the cat flea. J Clin Microbiol.1996;34 (8):1952-1956
- Solano-Gallego L, Bradley J, Hegarty B, Sigmon B, Breitschwerdt E. Bartonella henselae IgG antibodies are prevalent in dogs from southeastern USA. Vet Res.2004;35 (5):585-595
- Y.O. Sanogo, Z. Zeaiter, G. Caruso et al. Bartonella henselae in Ixodes ricinus ticks (Acari: Ixodida) removed from humans, Belluno province, Italy. Emerg. Infect. Dis. — 2003. — N 9. — P. 329—332.
- Smith D.L. Cat-scratch disease and related clinical syndromes. Amer. Fam. Physician. — 1997. — N 55(5). — P. 1783—1789.
- Losanoff JE, Sauter ER, Rider KD. Cat scratch disease presenting with abdominal pain and retroperitoneal lymphadenopathy. J Clin Gastroenterol.2004;38 (3):300-301
- Resto-Ruiz S, Burgess A, Anderson BE. The role of the host immune response in pathogenesis of Bartonella henselae. DNA Cell Biol.2003;22 (6):431-440
- García CJ, Varela C, Abarca K, Ferres M, Prado P, Vial PA. Regional lymphadenopathy in cat-scratch disease: ultrasonographic findings. Pediatr Radiol.2000;30 (9):640-643
- Massei F, Gori L, Macchia P, Maggiore G. The expanded spectrum of bartonellosis in children. Infect Dis Clin North Am.2005;19 (3):691-711
- лат. retina — сітківка ока
- Suhler EB, Lauer AK, Rosenbaum JT. Prevalence of serologic evidence of cat-scratch disease in patients with neuroretinitis. Ophthalmology.2000;107 (5):871-876
- Carithers HA, Margileth AM. Cat-scratch disease: acute encephalopathy and other neurologic manifestations. Am J Dis Child.1991;145 (1):98-101
- Gerber JE, Johnson JE, Scott MA, Madhusudhan KT. Fatal meningitis and encephalitis due to Bartonella henselae bacteria. J Forensic Sci.2002;47 (3):640-644
- Heye S, Matthijs P, Wallon J, van Campenhoudt M. Cat-scratch disease osteomyelitis. Skeletal Radiol.2003;32 (1):49-51
- Malatack JJ, Jaffe R. Granulomatous hepatitis in three children due to cat-scratch disease without peripheral adenopathy: an unrecognized cause of fever of unknown origin. Am J Dis Child.1993;147 (9):949-953
- Chian CA, Arrese JE, Pierard GE. Skin manifestations of Bartonella infections. Int J Dermatol.2002;41 (8):461-466
- Jacobs RF, Schutze GE. Bartonella henselae as a cause of prolonged fever and fever of unknown origin in children. Clin Infect Dis.1998;26 (1):80-84
- Arisoy ES, Correa AG, Wagner ML, Kaplan SL. Hepatosplenic cat-scratch disease in children: selected clinical features and treatment. Clin Infect Dis.1999;28 (4):778-784
- Borker A, Gardner R. Severe thrombocytopenic purpura as a complication of cat-scratch disease. Clin Pediatr (Phila).2002;41 (2):117-118
- Daybell D, Paddock CD, Zaki SR, et al. Disseminated infection with Bartonella henselae as a cause of spontaneous splenic rupture. Clin Infect Dis.2004;39(3): e21-e24
Джерела
- Інфекційні хвороби (підручник) (за ред. О. А. Голубовської). — Київ: ВСВ «Медицина» (2 видання, доповнене і перероблене). — 2018. — 688 С. + 12 с. кольор. вкл. (О. А. Голубовська, М. А. Андрейчин, А. В. Шкурба та ін.) ISBN 978-617-505-675-2
- Stephen J Nervi. Catscratch Disease. Medscape. Infectious Diseases Sections. Skin and Soft-Tissue Infections. Chief Editor: Michael Stuart Bronze. Updated: Mar 14, 2014 (англ.)