Інгібітори ацетилхолінестерази
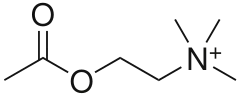
Ацетилхолінестераза — це фермент, який є основним членом сімейства ферментів холінестерази.[1] Інгібітор ацетилхолінестерази (AChEI) сповільнює розщеплення ацетилхолінестеразою ацетилхоліну на холін і ацетат, тим самим підвищуючи рівень і тривалість дії нейромедіатора ацетилхоліну в центральній нервовій системі, вегетативних гангліях і нервово-м'язових з'єднаннях, які багаті рецепторами ацетилхоліну.[2] Інгібітори ацетилхолінестерази являють собою один з двох типів інгібіторів холінестерази; інший тип — інгібітори бутирилхолінестерази.
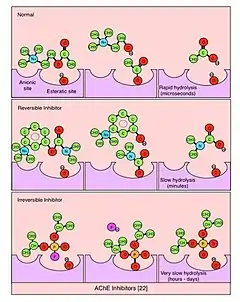
Інгібітори ацетилхолінестерази класифікуються як оборотні, необоротні або квазінеоборотні (також звані псевдонеоборотні).[3][4]
Механізм дії
Органофосфати, такі як ТЕПФ і зарин, інгібують холінестерази, ферменти, які гідролізують нейромедіатор ацетилхолін. Активний центр холінестераз має дві важливих ділянки, а саме аніонну ділянку і естеразну ділянку. Після зв'язування ацетилхоліну з аніонною ділянкою холінестерази ацетильна група ацетилхоліну може зв'язуватися з естеразною ділянкою. Важливими амінокислотними залишками в естеразній ділянці є глутамат, гістидин і серин. Ці залишки впливають на гідроліз ацетилхоліну.
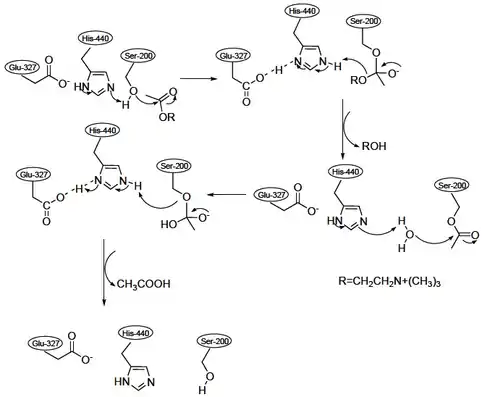
У естеразній ділянці ацетилхолін розщеплюється, що призводить до утворення вільної холінової частини і ацетильованої холінестерази. Цей ацетильований стан вимагає гідролізу для власної регенерації.[3][5]
Інгібітори, такі ТЕПФ, змінюють залишок серину в естеразній ділянці холінестерази.
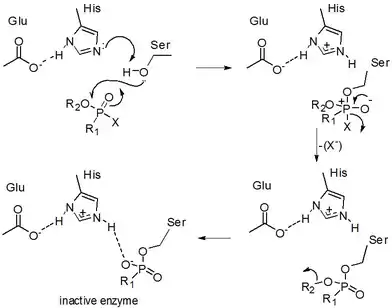
Дане фосфорилювання інгібує зв'язування ацетильної групи ацетилхоліну з естеразною ділянкою холінестерази. Оскільки ацетильная група не може зв'язувати холінестерази, ацетилхолін не може розщеплюватися. Таким чином, ацетилхолін залишиться недоторканим і буде накопичуватися в синапсах. Це призводить до постійної активації рецепторів ацетилхоліну, що призводить до гострих симптомів отруєння, наприклад, ТЕПФ.[6] Фосфорилювання холінестерази ТЕПФ (або будь-яким іншим органофосфатом) необоротно. Це робить інгібування холінестерази перманентним.[3][5]
Холінестераза необоротно фосфорилюється за наступною схемою реакції
На цій схемі реакції E позначає холінестерази, PX — молекулу ТЕПФ, E — PX — оборотну фосфорильовану холінестеразу, k3 — швидкість реакції другої стадії, EP — фосфорильовану холінестеразу, а X — групу ТЕПФ, що йде.
Необоротне фосфорилювання холінестерази відбувається в два етапи. На першому етапі холінестераза оборотно фосфорилюється. Ця реакція дуже швидка. Потім відбувається друга стадія. Холінестераза утворює дуже стабільний комплекс з ТЕПФ, в якому ТЕПФ ковалентно зв'язаний з холінестеразою. Поточна стадія є повільною реакцією. Але після цієї стадії холінестераза необоротно пригнічується.[3]
Залежне від часу необоротне інгібування холінестерази можна описати наступним рівнянням.[3]
У цій формулі E — залишена активність ферменту, E0 — початкова активність ферменту, t — часовий інтервал після змішування холінестерази і ТЕПФ, KI — константа дисоціації комплексу холінестераза-ТЕПФ (E-PX) і I — концентрація ТЭПФ.
Механізм реакції і наведена вище формула також сумісні з іншими органофосфатами. Процес відбувається точно так само.
Крім того, деякі органофосфати можуть викликати OPIDN — відстрочену полінейропатію, індуковану органофосфатами. Це захворювання, яке характеризується дегенерацією аксонів у периферичній і центральній нервовій системі. Це захворювання проявиться через декілька тижнів після зараження органофосфатами. Вважається, що neuropathy target esterase(NTE) залежить від органофосфата, який викликає захворювання. Проте не знайдено жодних доказів, які вказують на те, що ТЕПФ є одним з органофосфатів, які можуть викликати OPIDN.[7]
Використання
Інгібітори ацетилхолінестерази:[3]
- Зустрічаються в природному середовищі у вигляді отрут (наприклад, онхідал)
- Використовуються в якості зброї (нервово-паралітичні речовини)
- Використовуються як інсектициди (наприклад, малатіон)
- У лікувальних цілях використовуються:
- Для лікування міастенії. При міастенії вони використовуються для посилення нервово-м'язової передачі
- Для лікування глаукоми
- Для лікування синдрома постуральної тахикардії
- Як протиотрута при холінолітичних отруєннях
- Щоб відкотити ефект недеполяризуючих міорелаксантів
- Для лікування психоневрологічних симптомів таких захворювань, як хвороба Альцгеймера, особливо апатії
- Для збільшення шансів на усвідомлені сновидіння (шляхом подовження фази швидкого сну)[8]
- Для лікування деменції з тільцями Леві і хвороби Паркінсона. При цих нейродегенеративних захворюваннях AChEI головним чином використовуються для лікування когнітивних (в основному, порушень пам'яті та здатності до навчання) симптомів деменції. Ці симптоми послаблюються завдяки ролі ацетилхоліну в пізнавальній діяльності в ЦНС. Є деякі свідчення того, що AChEI можуть послаблювати психотичні симптоми (особливо зорові галюцинації) при хворобі Паркінсона[9]
- Для лікування когнітивних порушень у хворих на шизофренію. Є деякі дані, що свідчать про ефективність лікування позитивних, негативних та афективних симптомів[10][11][12]
- Для лікування аутизму і для збільшення відсотка фази швидкого сну у дітей, хворих на аутизм, згідно з механізмом, з допомогою якого вони стимулюють усвідомлені сновидіння[13][14]
Керівництва та рекомендації
У клінічних рекомендаціях по медикаментозному лікуванню людей з деменцією рекомендується випробувати AChE інгібітор у людей з ранньою і середньою стадіями деменції. Ці керівні принципи, відомі як Medication appropriateness tool for co‐morbid health conditions in dementia criteria (MATCH-D), припускають, що ці ліки, принаймні, розглядаються до застосування.[15]
Побічні ефекти
| Можливі побічні ефекти інгібіторів ацетилхолінестерази[16][17] | |||
|---|---|---|---|
| м'які — зазвичай проходять | потенційно серйозні | ||
| |||
Деякі основні ефекти інгібіторів холінестерази:
- Вплив на парасимпатичну нервову систему (парасимпатична гілка вегетативної нервової системи) може викликати брадикардію, гіпотензію, гіперсекрецію, бронхоспазм, діарею і зниження внутрішньоочного тиску, підвищення тонусу нижнього стравохідного сфінктера (НПС).
- Холінергічний криз.
- Ефекти неостигміну на післяопераційну нудоту і блювання суперечливі, і в клінічній практиці немає чіткого зв'язку, однак є переконливі докази, що підтверджують зниження ризику при застосуванні антихолінергічних засобів.[18]
Призначення оборотних інгібіторів холінестерази протипоказано тим, у кого є затримка сечі через обструкцію уретри .
Передозування
Гіперстимуляція нікотинових та мускаринових рецепторів.[3]
Фаза титрування
При використанні в центральній нервовій системі для полегшення неврологічних симптомів, як при використанні ривастигміна при хворобі Альцгеймера, всі інгібітори холінестерази вимагають поступового збільшення доз протягом декількох тижнів, і це зазвичай називається фазою титрування. Багато інших видів медикаментозного лікування можуть зажадати фазу титрування або підвищення. Ця стратегія використовується для формування толерантності до побічних ефектів або для досягнення бажаного клінічного ефекту.[17] Це також запобігає випадковому передозуванню і тому рекомендується при початку лікування надзвичайно сильнодіючими і/або токсичними препаратами (препаратами з низьким терапевтичним індексом).
Приклади
Оборотний інгібітор
Сполуки, які діють як оборотні конкурентні або неконкурентні інгібітори холінестерази, найбільш ймовірно знайдуть терапевтичне застосування. Вони включають в себе:
- Деякі органофосфати, не перераховані нижче в розділі «Необоротні»
- Карбамати
- Фізостигмін
- Неостигмін
- Піридостигмін
- Амбеноній
- Демекаріум
- Ривастигмін
- Похідні фенантрена
- Кофеїн — неконкурентний (також антагоніст аденозинових рецепторів)[19]
- Розмаринова кислота — ефір кавової кислоти. Зустрічається в рослинах видів родини Lamiaceae.[20]
- Альфа-пинен — неконкурентний оборотний[21][22]
- Пиперидини
- Такрин, також відомий як тетрагідроаминоакридин (THA')
- Едрофоніум
- Гуперзин А[23][24]
- Ладостигіл
- Унгеремін[25]
- Лактукопікрин
- Акотиамід
- Гібридні/битопні ліганди[26]
Порівняльна таблиця
| Інгібітор | Тривалість | Головне місце дії | Клінічне використання | Побічні ефекти |
|---|---|---|---|---|
| Едрофоніум | коротка (10 хв.)[27] | нервовом*язове з'єднання | діагностика міастенії | |
| Неостигмін | середня (1-2 ч.) | нервовом*язове з'єднання | нейтралізація нервово-м'язового блоку (внутрішньовенно);
лікування міастенії (перорально) |
вісцеральні |
| Фізостигмін | середня (0.5–5 ч.) | постгангліонарні волокна парасимпатичної системи | лікування глаукоми (очні краплі) | |
| Піридостигмін | середня (2-3 ч.) | нервовом*язове з'єднання | лікування міастенії (перорально) | |
| Дифлос | тривала | постгангліонарні волокна парасимпатичної системи | історично ним лікували глаукому (очні краплі) | токсичний |
| Ехотіофат (оборотний) | тривала | постгангліонарні волокнапарасимпатичної системи | лікування глаукоми (очні краплі) | системні ефекти |
| Паратіон (оборотний) | тривала | немає | токсичний |
Квазінеоборотний інгібітор
Сполуки, які діють як квазінеоборотні інгібітори холінестерази, що найбільш ймовірно можуть бути використані в ролі хімічної зброї чи пестицидів.
Див. також
Примітки
- Seth. 23 // Textbook of pharmacology. — Third edition. — New Delhi, 2009. — С. III.87. — ISBN 8131211584.
- Brett A. English, Andrew A. Webster. Acetylcholinesterase and its Inhibitors // Primer on the Autonomic Nervous System. — Elsevier, 2012. — 23 January. — P. 631–633. — ISBN 978-0-12-386525-0. — DOI:.
- Colović MB, Krstić DZ, Lazarević-Pašti TD, Bondžić AM, Vasić VM. Acetylcholinesterase inhibitors: pharmacology and toxicology // Current Neuropharmacology. — 2013. — Vol. 11, no. 3 (5). — P. 315—335. — DOI:. — PMID:.
- McGleenon, Dynan, Passmore. Acetylcholinesterase inhibitors in Alzheimer’s disease // British Journal of Clinical Pharmacology. — 2001. — Vol. 48, iss. 4 (12). — P. 471–480. — DOI:. — PMID:.
- Richard D. O'Brien. Toxic Phosphorus Esters: Chemistry, Metabolism, and Biological Effects. — Elsevier, 2016-07-29. — 447 с. — ISBN 978-1-4832-7093-7.
- Stephen M. Roberts, Robert C. James, Phillip L. Williams. Principles of Toxicology: Environmental and Industrial Applications. — John Wiley & Sons, 2014-12-08. — 499 с. — ISBN 978-1-118-98248-8.
- Marcello Lotti, Angelo Moretto. Organophosphate-Induced Delayed Polyneuropathy: // Toxicological Reviews. — 2005. — Vol. 24, iss. 1 (1). — P. 37–49. — ISSN 1176-2551. — DOI:. — PMID:.
- Yuschak, Thomas. Advanced lucid dreaming : the power of supplements : how to induce high level lucid dreams & out of body experiences. — [United States?] : Lulu Enterprises, 2006. — 183 pages с. — ISBN 978-1-4303-0542-2, 1-4303-0542-8.
- Taylor, David, 1946 November 28-. The Maudsley prescribing guidelines in psychiatry. — 11th edition. — Chichester, West Sussex — 1 online resource (682 pages) с. — ISBN 978-0-470-97969-3, 0-470-97969-0, 978-1-118-32325-0, 1-118-32325-4, 9786613497017, 6613497010.
- Salma R.I. Ribeiz, Débora P. Bassitt, Jony A. Arrais, Renata Avila, David C. Steffens. Cholinesterase Inhibitors as Adjunctive Therapy in Patients with Schizophrenia and Schizoaffective Disorder: A Review and Meta-Analysis of the Literature // CNS Drugs. — 2010. — Vol. 24, iss. 4 (4). — P. 303–317. — ISSN 1172-7047. — DOI:. — PMID:.
- Kee-Hong Choi, Til Wykes, Matthew M. Kurtz. Adjunctive pharmacotherapy for cognitive deficits in schizophrenia: meta-analytical investigation of efficacy // British Journal of Psychiatry. — 2013. — Vol. 203, iss. 3 (9). — P. 172–178. — ISSN 1472-1465 0007-1250, 1472-1465. — DOI:. — PMID:.
- Jasvinder Singh, Kamalpreet Kour, Mahesh B Jayaram. Acetylcholinesterase inhibitors for schizophrenia / Cochrane Schizophrenia Group // Cochrane Database of Systematic Reviews. — 2012. — Vol. 1 (1). — DOI:. — PMID:.
- Benjamin L. Handen, Cynthia R. Johnson, Sarah McAuliffe-Bellin, Patricia Jo Murray, Antonio Y. Hardan. Safety and Efficacy of Donepezil in Children and Adolescents with Autism: Neuropsychological Measures // Journal of Child and Adolescent Psychopharmacology. — 2011. — Vol. 21, iss. 1 (1 February). — P. 43–50. — ISSN 1557-8992 1044-5463, 1557-8992. — DOI:. — PMID:.
- Ashura Williams Buckley, Kenneth Sassower, Alcibiades J. Rodriguez, Kaitlin Jennison, Katherine Wingert. An Open Label Trial of Donepezil for Enhancement of Rapid Eye Movement Sleep in Young Children with Autism Spectrum Disorders // Journal of Child and Adolescent Psychopharmacology. — 2011. — Vol. 21, iss. 4 (1 August). — P. 353–357. — ISSN 1557-8992 1044-5463, 1557-8992. — DOI:. — PMID:.
- A. T. Page, K. Potter, R. Clifford, A. J. McLachlan, C. Etherton‐Beer. Medication appropriateness tool for co‐morbid health conditions in dementia: consensus recommendations from a multidisciplinary expert panel // Internal Medicine Journal. — 2016. — Vol. 46, iss. 10 (10). — P. 1189–1197. — ISSN 1444-0903. — DOI:. — PMID:.
- Kevin Loria (2012-05). What Really Works to Preserve Brainpower (PDF). Consumer Reports (англ.). Best Buy Drugs: 2. Архів оригіналу за 5 вересня 2012. Процитовано 25 серпня 2020.
- F. Inglis. The tolerability and safety of cholinesterase inhibitors in the treatment of dementia // International Journal of Clinical Practice. Supplement. — 2002. — Вип. 127 (6). — С. 45–63. — ISSN 1368-504X.
- Barash PG, Cullen BF, Stoelting RK, Cahalan MK, Stock MC. Clinical anesthesia. — [Seventh edition]. — Philadelphia, PA — С. 552—554. — ISBN 978-1-4698-3027-8, 1-4698-3027-2.
- Naif Karadsheh, Paul Kussie, D.Scott Linthicum. Inhibition of acetylcholinesterase by caffeine, anabasine, methyl pyrrolidine and their derivatives // Toxicology Letters. — 1991. — Vol. 55, iss. 3 (3). — P. 335–342. — DOI:. — PMID:.
- Sanda Vladimir-Knežević, Biljana Blažeković, Marija Kindl, Jelena Vladić, Agnieszka D. Lower-Nedza. Acetylcholinesterase Inhibitory, Antioxidant and Phytochemical Properties of Selected Medicinal Plants of the Lamiaceae Family // Molecules. — 2014. — Vol. 19, iss. 1 (1). — P. 767–782. — ISSN 1420-3049. — DOI:. — PMID:.
- Mitsuo Miyazawa, Chikako Yamafuji. Inhibition of Acetylcholinesterase Activity by Bicyclic Monoterpenoids // Journal of Agricultural and Food Chemistry. — 2005. — Vol. 53, iss. 5 (3). — P. 1765–1768. — ISSN 1520-5118 0021-8561, 1520-5118. — DOI:. — PMID:.
- Nicolette S. L. Perry, Peter J. Houghton, Anthony Theobald, Peter Jenner, Elaine K. Perry. In-vitro Inhibition of Human Erythrocyte Acetylcholinesterase by Salvia lavandulaefolia Essential Oil and Constituent Terpenes // Journal of Pharmacy and Pharmacology. — 2000. — Vol. 52, iss. 7 (7). — P. 895–902. — DOI:. — PMID:.
- Bauer BA. Can Huperzine A treat Alzheimer's?. Mayo Clinic (англ.). Архів оригіналу за 19 серпня 2012. Процитовано 25 серпня 2020.
- Bai-song Wang, Hao Wang, Zhao-hui Wei, Yan-yan Song, Lu Zhang. Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer’s disease: an updated meta-analysis // Journal of Neural Transmission. — 2009. — Vol. 116, iss. 4 (4). — P. 457–465. — ISSN 1435-1463 0300-9564, 1435-1463. — DOI:. — PMID:.
- In Kyung Rhee, Natalie Appels, Bertil Hofte, Bahadir Karabatak, Cornelis Erkelens. Isolation of the Acetylcholinesterase Inhibitor Ungeremine from Nerine bowdenii by Preparative HPLC Coupled On-Line to a Flow Assay System // Biological & Pharmaceutical Bulletin. — 2004. — Т. 27, вип. 11 (11). — С. 1804–1809. — ISSN 1347-5215 0918-6158, 1347-5215. — DOI:. — PMID:.
- Regina Messerer, Clelia Dallanoce, Carlo Matera, Sarah Wehle, Lisa Flammini. Novel bipharmacophoric inhibitors of the cholinesterases with affinity to the muscarinic receptors M1 and M2 // MedChemComm. — 2017. — Vol. 8, iss. 6 (4). — P. 1346–1359. — ISSN 2040-2503. — DOI:. — PMID:.
- Pharmacology. Edinburgh: Churchill Livingstone. 2003. ISBN 978-0-443-07145-4. Page 156