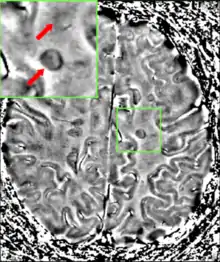
Розсіяний склероз
Розсіяний склероз, або множинний склероз (МС, або лат. encephalomyelitis disseminata) — хронічне запальне захворювання центральної нервової системи, при якому власні імунні клітини організму хворого атакують мієлін, «ізолюючу оболонку», котра оточує нервові волокна. Мієлінова оболонка відіграє вирішальну роль в роботі центральної нервової системи. Це спеціалізована збагачена ліпідами мембрана, яка забезпечує швидку й ефективну передачу електричних імпульсів. При розсіяному склерозі автоімунна атака на мієлінову оболонку спричиняє різні неврологічні розлади, в першу чергу втрату моторної функції. При розсіяному склерозі відбувається одночасне ураження відразу декількох відділів нервової системи, що в підсумку призводить до появи найрізноманітніших неврологічних симптомів. Втрата мієліну порушує зв'язок частин нервової системи, в результаті чого виникає значна кількість ознак та симптомів,[10][11] включаючи фізичні, розумові,[11] та, іноді, психічні проблеми.[12] МС може мати кілька форм, в яких нові симптоми проявляються окремими приступами (форми з рецидивами) чи накопичуються з часом (прогресуючі форми).[13] В періоди між приступами симптоми можуть повністю зникати; однак, часто мають місце постійні неврологічні проблеми, особливо з розвитком хвороби.[13]
| Множинний склероз | |
|---|---|
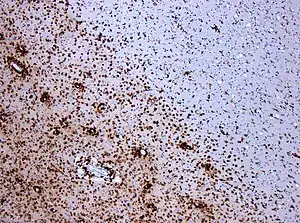 Демієлінізація при розсіяному склерозі. ЗабарвленаCD68 тканина показує кілька макрофагів у зоні ураження. Вихідний масштаб 1:100 Демієлінізація при розсіяному склерозі. ЗабарвленаCD68 тканина показує кілька макрофагів у зоні ураження. Вихідний масштаб 1:100 | |
| Спеціальність | неврологія |
| Симптоми | хронічний нейропатичний більd[1] |
| Метод діагностики | МРТ, позитрон-емісійна томографія і люмбальна пункція |
| Препарати | мітоксантрон[2][3], dantrolened[2], hydroxocobalamind[2], азатіоприн[2], баклофен[2][3], interferon beta-1ad[2][3], interferon beta-1bd[2][3], циклофосфамід[2], ціанокобаламін[2], кладрибін[2], teriflunomided[3], фінґолімод[3], апреміласт[3], алемтузумаб[3], ритуксимаб[3], dalfampridined[3], габапентин[3], Даклізумаб[3], модафініл[3], наталізумаб[3], армодафініл[3], метилпреднізолон[3], dimethyl fumarated[3], прегабалін[3], dalfampridined[4], бетаметазон[5], monomethyl fumarated[6], фінґолімод[7], teriflunomided[8] і АКТГ[9] |
| Частота | 0.032% (світ), 0.1671% (Ісландія) |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 8A40 |
| МКХ-10 | G35 |
| OMIM | 126200 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| eMedicine |
neuro/228 oph/179 emerg/321 pmr/82 radio/461 |
| MeSH | D009103 |
| | |
Хоча на сьогодні остаточна причина захворювання не з'ясована, основним механізмом розвитку розсіяного склерозу вважають руйнування імунною системою мієлінової оболонки та клітин, що виробляють мієлін.[14]. Дослідники вважають, що причини такого явища включають генетичні фактори та фактори зовнішнього середовища, зокрема інфекції.[11][15] МС зазвичай діагностують на основі наявних ознак та симптомів та за результатами інструментальної діагностики.
На даний момент майже всі існуючі способи лікування спрямовані на відновлення після приступу та попередження нових приступів.[11] Ліки, що застосовуються для лікування МС, мають невисоку ефективність, можуть негативно впливати на організм та в багатьох випадках не дуже добре переносяться хворими. Деякі з пацієнтів застосовують альтернативні способи лікування, незважаючи на те, що їхню ефективність не було доведено. У довгостроковій перспективі передбачати результати дуже складно. Кращі результати частіше спостерігали у жінок, у яких хвороба проявилася в молодому віці; пацієнтів із рецидивним характером захворювання; у хворих, в яких з самого початку було небагато приступів.[16] Середня тривалість життя хворих на розсіяний склероз на 5-10 років менша, ніж у людей, які не хворіють на це захворювання.[10]
Станом на 2008 р. близько 2-2,5 млн людей у всьому світі були уражені цією хворобою. Показники з різних частин світу та різних категорій населення значно відрізнялися.[17][18] Зазвичай, хвороба починається у віці від 20 до 50 років. Жінки хворіють вдвічі частіше, ніж чоловіки.[19] Назва множинний склероз стосується шрамів (склери — більш відомих, як бляшки чи ушкодження) безпосередньо у білій речовині головного мозку та спинного мозку.[20] У 1868 році МС вперше описав Жан Мартін Шарко.[20] На даний момент розроблюється велика кількість нових способів лікування та діагностування.
Ознаки та симптоми
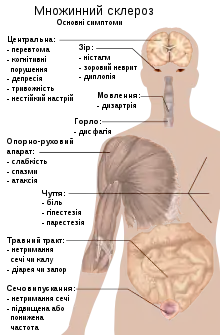
Людина, хвора на МС, може мати майже будь-які неврологічні симптоми чи ознаки, включаючи проблеми з вегетативною нервовою системою, зором, моторикою та чуттям, що бувають найбільш поширеними.[10] Симптоми залежать від місця розташування пошкоджень нервової системи та можуть включати втрату сенситивності або зміни у відчуттях, такі як поколювання, оніміння, слабкість у м'язах, дуже яскраво виражені рефлекси, спазми в м'язах, ускладнення при рухах; труднощі з координацією та балансом (атаксія); проблеми з мовленням або ковтанням, проблеми з зором (нистагм, неврит зорового нерва або двоїння в очах), втому, гострий або хронічний біль, проблеми з травленням.[10] Також часто мають місце проблеми з мисленням та емоційні проблеми, такі як депресія чи нестабільний настрій.[10] Феномен Утхоффа, погіршення симптомів під впливом температури, що перевищує звичайну, та ознака Лермітта, електричне подразнення, що проходить по спині при згинанні шиї, характерні для МС.[10] Основним способом оцінки порушення функцій та серйозності стану є розширена шкала інвалідизації (РШІ), при цьому все більше у дослідженнях використовують інші методи оцінки, такі як комплексна функціональна шкала множинного склерозу.[21][22][23]
Ця хвороба у 85 % випадків починається як клінічно ізольований синдром, що триває протягом деякого часу, при цьому 45 % хворих мають проблеми з моторикою чи сенсорикою, 20 % — неврит лицьового нерва, а 10 % — симптоми, пов'язані з дисфункцією стовбуру мозку, тоді як у 25 %, що залишилися, спостерігають більше одного з вищевказаних симптомів.[24] Спочатку симптоми протікають одним із двох шляхів: як епізоди неочікуваного погіршення, що тривають від кількох днів до місяців (їх називають рецидиви, загострення, припадки, приступи чи спалахи) після яких слідує покращення (85 % випадків), або ж як поступове погіршення без періодів відновлення (10-15 % випадків).[19] Також можливі їхні комбінації,[13] або ж спочатку у пацієнтів можуть спостерігатися рецидиви та ремісії, що прогресують з часом.[19] Зазвичай, рецидиви не можна передбачити, і вони відбуваються без будь-яких попереджувальних ознак.[10] Загострення хвороби дуже рідко відбувається частіше ніж двічі на рік.[10] Однак, деяким рецидивам передують тригерні фактори, характерні для весни та літа.[25] Аналогічно, вірусні інфекції, серед яких застуда, грип, гастроентерит підвищують ризик рецидивів.[10] Стрес також може спровокувати приступ.[26] Вагітність знижує ризик рецидивів; однак, в перші ж місяці після народження дитини ризик підвищується.[10] Загалом, наскільки наразі відомо, вагітність не впливає на хворобу в довгостроковій перспективі.[10] Згідно з результатами досліджень, інші фактори, що не впливають на рецидиви, включають вакцинацію[джерело?], грудне вигодовування,[10] фізичні травми[27] та феномен Утхоффа.[25]
Причини
Наразі причини МС невідомі; однак, вважається, що захворювання може спровокувати комбінація природних факторів, таких як збудники інфекцій та генетика.[10] На основі теорій, вчені намагаються поєднати дані в можливі пояснення, але жодне з них не стало вичерпним. Оскільки існує кілька природних факторів ризику та деякі з них можна частково змінити, подальші дослідження необхідні для того, щоб визначити чи може їх усунення запобігти МС.[28]
Географія
МС більш поширений серед людей, що живуть у віддаленні від екватора, хоча з цього правила також є винятки.[10][29] Вони включають етнічні групи для яких характерний низький ризик, попри віддалення від екватора, такі як саами, корінні американці, канадські хуттерити, новозеландські маорі,[30] та канадські інуїти,[19] а також групи з порівняно високим ризиком, попри наближення екватору, такі як жителі Сардинії,[19] палестинці та парси.[30] Причина такої географії невідома.[19] Хоча такий розподіл на півдні-півночі зменшується,[29] в 2010 році він все ще присутній.[19] МС поширеніший у регіонах з північноєвропейським населенням,[10] а географічні коливання можуть просто відображати глобальний розподіл такого населення, що становить групу високого ризику.[19] Зменшення впливу сонячного світла, в результаті чого знижується вироблення вітаміну D, також пропонувалося як пояснення.[31][32] Зв'язок між сезоном народження та МС підтримує цю ідею, оскільки менше людей, народжених в північній півкулі в листопаді, захворюють пізніше у житті порівняно з народженими в травні.[33] Природні фактори також можуть впливати на людину в дитинстві; згідно деяким дослідженням, люди що переїхали в інший регіон до 15 років, одержують ризик захворювання на МС, притаманний новому регіону. Якщо міграція мала місце пізніше ніж в 15 років, актуальними залишаються ризики рідного регіону.[10][28] Існують також свідчення того, що переїзд може впливати і на людей старших 15 років.[10]
Генетика
МС не вважається спадковою хворобою; однак, декілька генетичних варіацій продемонстрували вплив на підвищення ризику.[34] Вірогідність захворювання значно вища у родичів людей хворих на МС, при чому ризик вищий для близьких родичів.[11] У повних близнюків ступінь ризику для обох становить 30 %, в той час як для неповних близнюків цей показник становить близько 5 %, в однокровних братів та сестер — 2,5 %, а в братів та сестер, в яких спільний лише один з батьків, цей показник ще нижчий. .[10][11][35] Якщо обоє батьків уражені, для їхніх дітей ризик буде в 10 разів вищим ніж в середньому серед популяції.[19] Також у деяких етнічних групах МС поширеніший ніж в інших.[36]
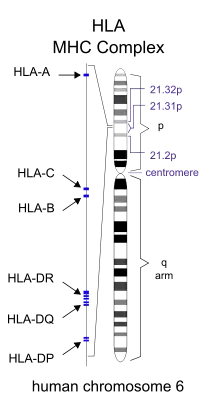
Специфічні гени, що пов'язують з МС, включають різницю в системі людського лейкоцитарного антигену (HLA) — групі генів хромосоми 6, що слугує основним комплексом гістосумісності (ОКГ).[10] Такі зміни в ділянці HLA пов'язані зі схильністю до захворювання, що відома вже більше тридцяти років,[37] та, додатково, ця ж ділянка бере участь в розвитку інших автоімунних захворювань, таких як діабет типу I та системний еритематозний вовчак.[37] Найбільш послідовними результатами є зв'язок між множинним склерозом та алелями ОКГ, визначеним як DR15 та DQ6.[10] Інші локуси показали захисний ефект, наприклад, HLA-C554 та HLA-DRB1*11.[10] Загалом, згідно з оцінками, до зміни HLA належить 20-60 % генетичної схильності.[37] Завдяки сучасним генетичним методам (дослідження геному) відкрито принаймні дванадцять інших генів поза областю HLA, що помірно підвищують можливість МС.[37]
Збудники інфекцій
На роль тригерів розсіяного склерозу пропонувалося чимало мікроорганізмів, але участь жодного з них не було доведено.[11] Переїзд в ранньому віці з одного місця світу в інше змінює в подальшому ризик МС для людини.[15] Поясненням цього може бути те, що певна форма інфекції, яку викликає поширений мікроб, радше ніж рідкісний, пов'язана з хворобою.[15] Пропоновані механізми включають в себе гігієнічну гіпотезу і гіпотезу поширеності. Гігієнічна гіпотеза припускає, що вплив деяких збудників інфекції на початку життя має захисну функцію, а хвороба виникає як реакція на пізній контакт з такими збудниками.[10] Гіпотеза поширеності припускає, що захворювання пов'язане з інфекційним збудником, поширенішим у регіонах, де часто зустрічається МС і де у більшості людей він викликає постійну інфекцію без симптомів. Лише в деяких випадках і після багатьох років це викликає демієлінізацію.[15][38] Гігієнічна гіпотеза отримала більшу підтримку, ніж гіпотеза поширеності.[15]
Докази, що свідчать на користь вірусів як фактору розвитку РС, включають: наявність олігоклональних груп у мозку і спинномозковій рідині у більшості людей з МС, зв'язок декількох вірусів з демієлінізацією у людини енцефаломієліт, і виникнення демієлінізації у тварин, викликане певною вірусною інфекцією.[39] Віруси герпесу людини — одні з можливих збудників хвороби. Люди, які ніколи не були заражені вірусом Епштейна-Барра, мають знижений ризик захворіти на МС, тоді як ті, що були інфіковані в юні роки, піддаються більшому ризику, ніж ті, хто був заражений ним у дитячому віці.[10][15] Хоча деякі вважають, що це йде врозріз з гігієнічної гіпотезою, оскільки неінфіковані, ймовірно, зростали у більш гігієнічних умовах,[15] інші вважають, що немає жодного протиріччя, оскільки саме перший контакт із збудником вірусу, що стався порівняно пізно в житті, є спусковим механізмом для захворювання.[10] Інші хвороби, які можуть бути пов'язані з МС, включають кір, свинку і краснуху.[10]
Фактори способу життя та супутні захворювання
Паління було показане як незалежний чинник ризику виникнення МС.[31] Стрес може бути фактором ризику, хоча докази на підтримку цього є слабкими.[28] Вивчався зв'язок із професійними ризиками та токсинами — в основному розчинниками — але жодних чітких висновків не було досягнуто.[28] Вакцинація вивчалась як можливий причинний фактор, однак більшість досліджень не вказують на зв'язок із захворюваннями,[28] і деякі інші можливі фактори ризику, такі як дієта і вживання гормонів також вивчалися, проте дані про їхній зв'язок із захворюванням є «недостатніми і непереконливими»[31]. Подагра трапляється рідше, ніж можна було б очікувати, і нижчі рівні сечової кислоти були виявлені у людей з МС. Це призвело до теорії, що сечова кислота виконує захисну функцію, хоча її точне значення залишається невідомим.[40]
Патофізіологія
Трьома основними характеристиками МС є виникнення у центральній нервовій системі так званих кортикальних вогнищ (які іноді також називаються «бляшками»), запалення і руйнування мієлінової оболонки та втрата нейронів. Ці особливості взаємодіють складним і ще не повністю вивченим чином, щоб приводить до пробою нервової тканини і, у свою чергу, викликає ознаки і симптоми захворювання.[10] Як вже вказувалося вище, розсіяний склероз вважається іммуноопосредкованним розладом, яке запускається внаслідок взаємодії генетичних факторів і поки що не встановлених екологічних причин[11]
Ураження

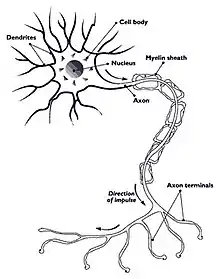
Назва «множинний склероз» нагадує про шрами (склери — більш відомі як бляшки або ушкодження), які утворюються в нервовій системі. Ці ушкодження найчастіше впливають на білу речовину в зоровому нерві, стовбур мозку, базальні ганглії та спинний мозок, або на проходження білої речовини поряд із бічними шлуночками.[10] Функція лейкоцитів полягає в проведенні сигналів між областями сірої речовини, де проходить оброблення, та іншими частинами тіла. Периферична нервова система рідко задіяна.[11]
Зокрема, МС включає в себе втрату олигодендроцитів, клітин, відповідальних за створення і збереження жирового шару, відомого як мієлінова оболонка, що дозволяє нейронам нести електричні сигнали (потенціали дії).[10] Це призводить до зменшення шару або повної втрати мієліну, і, по мірі прогресування хвороби, дисфункції аксонів нейронів. Коли мієлін втрачено, нейрон не може більше ефективно проводити електричні сигнали.[11] Процес відновлення, званий ремієлінізація, відбувається на ранніх стадіях захворювання, але олигодендроцитм не можуть повністю відновити мієлінову оболонку клітини.[41] Повторні напади призводять до все менш ефективної ремієлінізації, аж доки не виникне схожа на шрам бляшка навколо пошкоджених аксонів.[41] Ці шрами викликають симптоми і під час нападу магнітно-резонансна томографія (МРТ) часто показує більше десяти нових бляшок.[10] Це може означати, що існує певна кількість ушкоджень, нижче від якої мозок здатний відновлюватися сам, без помітних наслідків.[10] Інший процес, пов'язаний зі створенням ушкоджень, є аномальне збільшення кількості астроцитів у зв'язку з руйнуванням прилеглих нейронів.[10] Було описано низку моделей ушкодження.[42]
Запалення
Крім демієлінізації, іншою ознакою захворювання є запалення. Відповідно до імунологічного пояснення, запальний процес викликаний Т-клітинами, певним видом лімфоцитів, які відіграють важливу роль у захисті організму.[11] T-клітини отримують доступ до мозку через збої в гематоенцефалічному бар'єрі. Т-клітини сприймають мієлін як стороннє тіло і нападають на нього, через що ці клітини також називають «аутореактівними лімфоцитами».[10]
Атака мієліну починає запальні процеси, який запускає інші імунні клітини і вивільняє розчинні фактори, такі як цитокіни та антитіла. Подальше ушкодження гематоенцефалічного бар'єру, в свою чергу, викликає ряд інших шкідливих ефектів, таких як набряки, активація макрофагів і більшу активацію цитокінів та інших руйнівних білки[11] Запалення може потенційно знизити передачу інформації між нейронами, принаймні трьома способами.[10] Випущені розчинні фактори можуть зупинити нейротрансмісію недоторканими нейронами. Ці фактори можуть призвести до збільшення або втрати мієліну, або ж вони можуть заподіяти повний розклад аксона.[10]
Гематоенцефалічний бар'єр є частиною капілярної системи, яка запобігає проникненню Т-клітин в центральну нервову систему. Вона може стати проникною для цих типів клітин після інфікування вірусами або бактеріями. Після того, як вона само відновиться, як правило, як тільки раз інфекцію виведено, Т-клітини можуть залишатися в пастці всередині мозку[11]
Діагностика

Множинний склероз зазвичай діагностується на основі картини ознак і симптомів, в поєднанні з додатковою медичною візуалізацією та лабораторними аналізами.[24] Діагноз може бути важко підтвердити, особливо на ранніх стадіях, оскільки ознаки і симптоми може бути схожі на інші захворювання.[10][43]Критерії МакДональда, які зосереджені на клінічних, лабораторних та радіологічних доказах ураження в різний час і в різних областях, є найбільш часто використовуваним методом діагностики,[17] тоді як критерії Шумахера і критерії Познера мають в основному історичне значення.[44] В той час, як вищевказані критерії дозволяють проведення неінвазивної діагностики, деякі стверджують, що тільки остаточним доказом може бути лише розтин або біопсія зразка, у якому будуть виявлені ураження, типові для МС.[10][45][46]
Самі по собі клінічні дані можуть бути достатніми для діагностики множинного склерозу, лише якщо в пацієнта були окремі епізоди, неврологічні симптоми, характерні для цієї хвороби.[45] У тих, хто звернувся за медичною допомогою після всього лише одного нападу потрібно провести інші аналізи для встановлення діагнозу. Найбільш часто використовуваними діагностичними засобами є нейровізуалізація, аналіз спинномозкової рідини і викликаних потенціалів. Магнітно-резонансна томографія головного мозку і хребта може показати області демієлінізації (ушкодження або бляшки). Гадоліній можна вводити внутрішньовенно, як і контрастну речовину, щоб виділити активні бляшки і, шляхом ліквідації, показати існування ушкоджень в минулому, не пов'язаних із симптомами на момент оцінки.[45][47] Аналіз спинномозкової рідини, отриманої з люмбальної пункції, може свідчити про хронічне запалення в центральній нервовій системі. Спинномозкова рідина перевіряється на олігоклональні групи імуноглобуліну класу G на електрофорезі, які є маркерами запалення, що виявляються у 75-85 % людей з МС.[45][48] Нервова система при МС може реагувати менш активно на стимуляцію зорового нерву і сенсорних нервів через демієлінізацію таких шляхів. Ці реакції мозку можуть бути вивчені за допомогою візуальної та сенсорної оцінки викликаних потенціалів.[49]
Форми клінічного перебігу
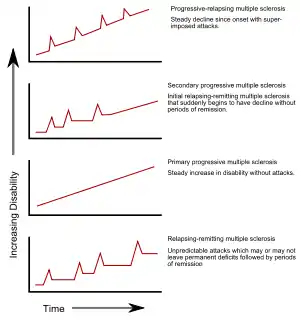
Виділяють декілька основних підтипів серед форм перебігу множинного склерозу. Інформація про перебіг захворювання в минулому використовується для того, щоб передбачити його перебіг в майбутньому. Знання про форму перебігу хвороби важливе не тільки для надання прогнозу, але й для прийняття рішень щодо лікування. У 1996 році Національне товариство з вивчення множинного склерозу в США описало чотири форми перебігу МС:[13]
- рецидивно-ремітуючий;
- вторинно-прогресуючий;
- первинно-прогресуючий
- прогресуючий із загостреннями.
Рецидивно-ремітуючий підтип характеризується непередбачуваними рецидивами, за якими йдуть періоди відносно спокійної (ремісії) без будь-яких нових ознак активності захворювання. Неврологічні порушення, що з'являються під час загострень, можуть зникати або залишати наслідки, які з'являються приблизно у 40 % загострень і стають тим вірогідніше, чим довше людина страждає на МС.[10][24] Таким є початковий перебіг МС у 80 % хворих.[10] Якщо порушення завжди зникають в періоди між загостреннями, хвороба іноді зветься доброякісним МС,[50] хоча хворі все рівно набувають певного ступеня інвалідності в довгостроковій перспективі.[10] З іншого боку термін злоякісний множинний склероз використовується для опису людей, хворих на МС, які досягають значного рівня інвалідності протягом короткого періоду.[51] Рецидивно-ремітуючий перебіг МС звичайно починається з клінічно ізольованого синдрому (КІС). У випадку КІС напад хвороби має ознаки демієлінізації, але не відповідає критеріям множинного склерозу.[10][52] Множинний склероз розвивається пізніше у 30-70 % людей з проявами КІС.[52]
Вторинно-прогресуючий підтип МС виявляється у близько 65 % людей з початковим рецидивно-ремітуючим МС, в яких згодом розвивається прогресуюча нейродегенерація між гострими нападами хвороби без чітких періодів ремісії.[10][13] Іноді можуть з'являтися рецидиви і незначні ремісії.[13] Найбільш типовим проміжком часу між початком захворювання і його перетворенням з рецидивно-ремітуючого на вторинно-прогресуючий МС є період в 19 років.[53]
Первинно-прогресуючий розсіяний склероз діагностується приблизно у 15 % усіх пацієнтів із РС і відзначається відсутністю чітких загострень та ремісій після появи перших симптомів.[54][24] Він характеризується прогресуючою інвалідністю з самого початку захворювання і відсутністю або рідкістю та незначною вираженістю ремісій та періодів поліпшення стану хворого.[13] Типовим віком початку первинно-прогресуючого підтипу МС є пізніший вік порівняно з рецидивно-ремітуючим підтипом перебігу МС. Він є близьким до віку початку вторинно-прогресуючого МС після рецидивно-ремітуючого початку, тобто у віці близько 40 років.[10]
Прогресуючий тип МС з загостреннями спостерігається в тих осіб, в яких невпинна нейродегенерація має місце від самого початку хвороби, але на її тлі розвиваються подальші додаткові загострення. Цей підтип є найменш поширеним серед інших.[13]
Також було описано незвичайні типи МС. До них відносять хворобу Девіка, концентричний склероз Бало, дифузний склероз Шильдера та хворобу Марбурга. Йде дискусія стосовно того, чи є вони варіантами МС або окремими захворюваннями.[55] Множинний склероз має інший перебіг у дітей та займає більше часу до досягнення прогресуючої стадії.[10] Тим не менш, діти все рівно досягають її у більш ранньому середньому віці, ніж дорослі хворі.[10]
Лікування
Необхідною передумовою для відновлення від хвороби і припинення її рецидивів є регенерація інтактних мієлінових оболонок. Регенерація мієліну можлива, але при розсіяному склерозі вона не забезпечується достатньою мірою. Крім того з віком організм людини втрачає здатність відновлювати мієлін. Однією з причин недостатньої компенсації мієліну є також хронічне запалення, що виникає при таких неврологічних ураженнях.
Наразі ліки, котрі могли б відмінювати згубний вплив множинного склерозу на неровову систему, невідомі. Втім, розроблено досить напрямків терапії, які допомагають поліпшити стан хворого, зменшити частоту рецидивів, уповільнити прогресування захворювання тощо. Основними цілями лікування є відновлення функції, порушеної під час загострення, запобігання новим нападам, а також запобігання інвалідності. Як і будь-які лікарські засоби, препарати, що використовуються у лікуванні МС, мають свої побічні ефекти. Деякі хворі використовують засоби нетрадиційної медицини незважаючи на недостатність доказів її ефективності.
Періоди загострень
Під час загострення симптомів захворювання звичайним методом лікування є внутрішньовенне введення кортикостероїдів, таких як метилпреднізолон[10], в той час як пероральний прийом кортикостероїдів може мати аналогічну ефективність та показники безпечності.[56] Хоча кортикостероїди в цілому ефективні для зняття симптомів в короткостроковій перспективі, це лікування вбачається як таке, що не має значного впливу на довгострокове одужання.[57] Наслідки тяжких загострень, що не піддаються лікуванню кортикостероїдами, можуть бути подолані в результаті використання плазмаферезу.[10]
Рецидивно-ремітуючий множинний склероз
Вісім препаратів, що змінюють перебіг захворювання, було схвалено свого часу регулюючими органами для лікування рецидивно-ремітуючого множинного склерозу (РРМС): інтерферон бета-1a, інтерферон бета-1b[18], глатирамеру ацетат, мітоксантрон, наталізумаб, фінголімод,[58] теріфлюномід[59] та диметилфумарат.[60] До 2012 року ефективність витрат на ці препарати не вивчались[61]. Проте, уже 2020 році появились перші нукові обґрунтовання як ефективнсоті так і економічної оцінки[18]. У випадку рецидивно-ремітуючого МС вони проявляють помірну ефективність у відношенні зниження частоти загострень.[58] Інтерферони та глатирамера ацетат є засобами першої лінії[24] і є відносними еквівалентами один одного. Вони знижують частоту загострень приблизно на 30 %.[62] Ранній початок довгострокової терапії є безпечним методом лікування і поліпшує його результати.[63][64] Наталізумаб знижує частоту рецидивів сильніше, ніж препарати першої лінії, проте вважається препаратом другої лінії через наявність побічних ефектів та призначається у тих випадках, коли хвороба не відповідає на лікування іншими препаратами[24] або має тяжку форму.[62] Мітоксантрон має тяжкі побічні ефекти і належить до засобів третьої лінії для хворих, лікування яких іншими засобами не дало результатів.[24] Лікування клінічно ізольованого синдрому (КІС) інтерферонами знижує ризик розвитку захворювання до стадії клінічного МС.[10][65] Ефективність інтерферонів та глатирамеру ацетату у дітей приблизно відповідає ефективності у дорослих.[66] Дію деяких нових агентів, таких як фінголімод, терифлуномід та диметилфумарат, ще не було з'ясовано остаточно (станом на 2011 рік).[67]
У 2017 році в США було схвалено для застосування при рецидивуючому та первинно-прогресуючому РС моноклонального антитіла, препарату окрелізумаб, який належить до препаратів хворобо-модифікуючої терапії, тобто тих засобів, що змінюють перебіг захворювання та покращують якість життя пацієнтів із РС. Ефективність та належна безпека застосування окрелізумабу були підтверджені відповідними дослідженнями[68]. Того ж року препарат окрелізумабу був зареєстрований в Україні з такими ж показаннями з торговою маркою «Окревус».
Прогресуючий множинний склероз
Жоден з лікарських засобів не проявив себе як такий, що може змінити перебіг первинно-прогресуючого МС,[24] і лише мітоксантрон було схвалено для лікування вторинно-прогресуючого МС (станом на 2011 рік).[69] В цій групі хворих попередні дані підтверджують, що мітоксантрон помірно уповільнює прогресування захворювання і зменшує частоту рецидивів протягом двох років.[70][71]
Побічні ефекти
Засоби, що змінюють перебіг захворювання, мають декілька побічних ефектів. Одним із найпоширеніших є подразнення в місці ін'єкції глатирамера ацетата та інтерферонів (до 90 % у випадку підшкірної ін'єкції і 33 % у випадку внутрішньом'язової ін'єкції).[72] З часом в місці ін'єкції може з'явитися видима западина через локальне руйнування жирової тканини, відоме як ліпоатрофія.[72] Інтерферони можуть провокувати грипоподібні симптоми;[73] деякі хворі, що приймають глатирамер, після ін'єкції відчувають припливи, здавленість у грудях, прискорене серцебиття, задишку та відчуття тривоги, які зазвичай минають не пізніше ніж через 30 хвилин.[74] Більш небезпечними, але й більш рідкими, побічними ефектами є ушкодження печінки від інтерферонів,[75] систолічна дисфункція (12 %), безпліддя та гострий мієлоїдний лейкоз (0,8 %) від мітоксантрону,[70][76] а також прогресуюча мультифокальна лейкоенцефалопатія, що є побічним ефектом наталізумаба (в 1 з 600 пацієнтів, що приймали препарат).[24][77]
Фінголімод може стати причиною гіпертонії та брадикардії, макулярного набряку, підвищення рівню ферментів печінки або зниження рівню лімфоцитів.[78] Попередні дані підтверджують безпечність теріфлюноміда у короткостроковій перспективі із загальними побічними ефектами, що включають головні болі, втому, нудота, випадіння волосся та болі в кінцівках.[58] Крім того були зареєстровані повідомлення про печінкову недостатність та ПМЛ, пов'язані з прийняттям цього препарату, який також є небезпечним для розвитку плоду.[78] Найбільш поширеними побічними ефектами диметилфумарата є припливи та проблеми шлунково-кишкового тракту.[60][78] Хоча диметилфумарат може стати причиною зниження кількості лейкоцитів, випадків опортуністичних інфекцій під час випробувань ліків зареєстровано не було.[79][80]
Другорядні симптоми
Було доведено, що ліки та нейрореабілітація допомагають покращити деякі симптоми, проте не змінюють хід захворювання.[81] Деякі симптоми добре реагують на ліки, наприклад, нестабільність сечового міхура та м'язова спастичність, тоді як інші майже не змінюються.[10] У разі неврологічних проблем дуже важливий багатоплановий підхід для покращення життя; проте дуже важко визначити «основну групу», оскільки в різні моменти часу потрібні різні медичні послуги.[10] Програми багатопланової реабілітації підвищують активність та покращують участь людей із МС, проте не мають впливу на рівень ускладнення.[82] Існує обмежена кількість доказів загальної ефективності індивідуальних програм лікування,[83][83][84] проте існують докази, що деякі підходи, такі як фізичні вправи[85][86] та психотерапія, в тому числі когнітивно-поведінкові підходи, є ефективними.[87]
Альтернативне лікування
Понад 50 % людей з МС можуть застосовувати комплементарну та альтернативну медицину, проте їх відсоток залежить від визначення альтернативної медицини.[88] Докази ефективності такого лікування у більшості випадків дуже слабкі або відсутні.[88][89] Хоча досліди довели, що вітамін D може бути корисним, їхньої кількості для остаточного висновку недостатньо.[90] До терапії з недоведеною ефективністю серед людей з МС відносяться дієта та дотримання режиму,[88][91][92] техніка релаксації, наприклад, йога,[88] препарати рослинного походження (в тому числі медична марихуана),[88][93] гіпербарична оксигенація,[94] самолікування анкілостомами, рефлексотерапія та акупунктура.[88][95] Щодо характеристик користувачів таких методів, це здебільшого жінки, які страждають від МС протягом тривалого часу, можуть бути більш недієздатними та незадоволені рівнем звичайного медичного обслуговування.[88]
Прогноз
no data
<13
13–16
16–19
19–22
22–25
25–28
|
28–31
31–34
34–37
37–40
40–43
>43
|
Очікуваний майбутній хід захворювання залежить від підтипу захворювання, статі, віку та початкових симптомів особи, а також ступеню інвалідності, який має особа.[16] Захворювання легше протікає у жінок (зворотно-ремітуючий підтип), при невриті зорового нерва або симптомах порушення чутливості на початку захворювання, при малій кількості нападів у перші роки, особливо у ранньому віці.[16][96]
Середній очікуваний строк життя становить 30 років з початку захворювання, на 5-10 років менше, ніж у неуражених людей.[10] Майже 40 % людей з МС доживають до сьомого десятку.[96] Проте дві третини випадків смерті мають безпосередній зв'язок з хворобою.[10] Дуже поширене самогубство, тоді як інфекції та інші ускладнення особливо небезпечні для інвалідів.[10] І хоча більшість людей втрачає здатність ходити перед смертю, 90 % осіб з цим захворюванням можуть ходити самостійно через 10 років з початку, а 75 % — через 15 років.[96][97]
Епідеміологія
Кількість людей з МС станом на 2010 рік становила 2-2,5 мільйони (приблизно 30 випадків на 100 000 осіб) у світі, і динаміка була дуже різною у різних регіонах.[17][19] За оцінками це захворювання призвело до 18 000 смертей того року.[98] В Африці рівень становив менше 0,5 випадку на 100 000 осіб, тоді як у Південно-Східній Африці він становив 2,8 випадки на 100 000 осіб, 8,3 випадків на 100 000 осіб в Америці та 80 випадків на 100 000 осіб в Європі.[17] Рівні перевищили 200 випадків на 100 000 осіб у деяких регіонах у Північній Європі.[19] Кількість нових випадків, що розвинулися за рік, становить приблизно 2,5 випадку на 100 000 осіб.[17]
Рівень МС зростає, проте це можна пояснити покращеною діагностикою.[19] Дослідження популяційних та географічних моделей були схожими[38] та призвели до низки теорій щодо причини захворювання.[15][28][31]
МС зазвичай з'являється у людей, яким майже або дещо за тридцять років, проте він рідко може з'являтися в дитинстві та після 50 років.[17][19] Первинний прогресуючий підтип дуже поширений серед людей віком приблизно п'ятдесят років.[54] Подібно до багатьох автоімунних розладів, це захворювання більш поширене серед жінок, і кількість випадків зростає.[10][29] Станом на 2008 р. кількість захворювань у світі була удвічі більша серед жінок, ніж серед чоловіків.[17] У дітей воно також більш поширене серед дівчат, ніж через хлопчиків,[10] тоді як серед людей, яким за п'ятдесят, воно однаково вражає і чоловіків, і жінок.[54]
Історія
Медичне діагностування
Французький невропатолог Жан-Мартен Шарко (1825—1893 рр.) першим у 1868 році визнав множинний склероз як окрему хворобу.[99] Узагальнивши попередні звіти та додавши власні клінічні та патологічні спостереження, Шарко назвав цю хворобу «sclerose en plaques». Три ознаки множинного склерозу, відомі як тріада Шарко 1, — це ністагм, інтенційний тремор та телеграфна мова (скандована мова), хоча це не єдині ознаки МС. Шарко також спостерігав зміни у сприйнятті, описуючи, що його пацієнти мали «визначене послаблення пам'яті» та «повільно формулювали свої думки».[20]
До Шарко Роберт Карсвел (1793—1857 рр.), британський професор патології, та Жан Крювел'є (1791—1873 рр.), французький професор патологічної анатомії, описали та продемонстрували багато клінічних даних захворювання, але не визначили його як окреме захворювання.[99] Зокрема, Карсвел описав пошкодження, які він визначив як «значні пошкодження спинного мозку, що супроводжувалися атрофією».[10] У 1863 р. швейцарський патологоанатом Джордж Едвард Ріндфляйш (1836—1908 рр.) помітив під мікроскопом, що ураження, пов'язані з запаленням, розповсюджувалися навколо кров'яних судин.[100][101] Протягом 20-го сторіччя було створено теорії щодо причини та патогенезу, а у 1990-х рр. почали з'являтися ефективні засоби лікування захворювання.[10]
Історичні випадки
.jpg.webp)
Існує декілька історичних свідоцтв про людей, які мешкали до або незадовго після того, як хворобу було описано Шарко, та які, можливо, мали МС: Молода жінка на ім'я Халдора, що мешкала в Ісландії приблизно у 1200 р., раптово втратила зір та здатність рухатися, проте після своїх молитов до святих їй полегшало через сім днів. Свята Лідвіна зі Східама (1380—1433 рр.), черниця з Голландії, можливо, була однією з перших людей з ідентифікованим МС. З 16 років до самої смерті у 53 роки вона мала періодичні болі, слабкість у ногах та втрату зору — симптоми, характерні для МС.[102] Обидва випадки відносили до гіпотези «генів вікінгів», що поширювали хворобу.[103]
Август Фредерік д'Есте (1794—1848 рр.), син принца Августа Фредеріка, герцога Суссекського та леді Августи Мюррей та онук короля Великої Британії Георга III, майже напевно мав МС. Д'Есте залишив детальний щоденник, у якому він описав 22 роки життя з хворобою. Його щоденник починався у 1822 р. та закінчувався у 1846 р., проте він залишався невідомим до 1948 р. Його симптоми почалися у віці 28 років та перейшли до раптової тимчасової втрати зору (скороминуча сліпота) після похорону друга. Під час хвороби у нього з'явилась слабкість в ногах, незграбність в руках, оніміння, запаморочення, порушення роботи сечового міхура та порушення ерекції. У 1844 р. він пересів на інвалідне крісло. Незважаючи на хворобу він не припинив оптимістично ставитися до життя.[104][105] Ще раніше МС було відмічено британцем В.Н.П. Барбеліоном, літературний псевдонім Брюса Фредеріка Камінгса (1889—1919 рр.), що вів детальний журнал свого діагнозу та боротьби з хворобою.[105] Його щоденник було опубліковано у 1919 р. під назвою «Журнал розчарованої людини».[106]
Дослідження
Препарати
Тривають дослідження з пошуку ефективніших, зручніших та краще переносимих препаратів для лікування зворотно-ремітуючого МС; створення терапії для прогресивних підтипів; стратегій нейропротекції та ефективного симптоматичного лікування.[107]
У 2000-х та 2010-х рр. було зареєстровано деякі пероральні препарати, зріст попиту та вживання яких очікується.[108] Інші пероральні препарати знаходяться на стадії дослідження; один з таких препаратів, лакінімод, було заявлено у серпні 2012 р.; він знаходиться на стадії III клінічних випробувань після отримання сукупних результатів на попередніх стадіях.[109] Так само тривають дослідження, спрямовані на покращення ефективності та легкості застосування вже існуючих засобів. До них належить застосування нових препаратів, таких як ПЕГільований варіант інтерферона-β-1a, який має бути таким же ефективним при меншому дозуванні.[110][111] Заявка на реєстрацію «пегінтерферона бета-1a» очікується у 2013 р.[111]
Моноклональні антитіла привернули до себе значну увагу. Алемтузумаб, даклізумаб та моноклональні антитіла CD20, такі як рітуксімаб, окрелізумаб та офатумубаб, всі показали певні переваги та зараз вивчаються як потенційні засоби лікування.[80] Станом на 2017 рік для лікування двох форм РС, первинно-прогресуючої та рецидивуючої, було схвалено одне таке моноклональне антитіло, препарату окрелізумаб. Ефективність та належна безпека застосування окрелізумабу були підтверджені відповідними дослідженнями. Окрелізумаб зареєстрований у США, Канаді, ЄС та Україні з торговою маркою «Окревус».
Інша стратегія дослідження спрямована на оцінку комплексної ефективності двох або більше препаратів.[112] Головне пояснення застосування певних препаратів для лікування МС– задіяні терапії спрямовані на різні механізми, і тому їх застосування не є обов'язково виключним.[112] Синергія, під час якої один препарат покращує ефект іншого, також можлива, проте можуть проявитися такі недоліки, як блокування дії інших препаратів або ускладнення з побічними ефектами.[112] Було декілька досліджень комплексної терапії, проте вони досі не дали достатньо позитивних результатів, які можна розглядати як ефективне лікування МС.[112]
Дослідження нейропротекції та регенеративної терапії, такої як терапія стовбурових клітин, дуже важливі, проте вони досі знаходяться на ранній стадії.[113] Так само не існує жодних ефективних засобів лікування прогресуючих видів захворювання. Багато з новітніх препаратів, а також досліджуваних препаратів, можливо, будуть оцінюватися як терапії ППМС або ВПМС.[108]
Біомаркери захворювання
Хоча критерії діагностики навряд чи зміняться у найближчому майбутньому, триває робота над розробкою біомаркерів, що допоможуть діагностувати та попередити прогресування захворювання.[108] Серед нових досліджуваних методів діагностики — робота з антимієліновими антитілами та дослідження з сироваткою та спинномозковою рідиною, проте жодне з них не дало надійних позитивних результатів.[115]
На сьогодні немає лабораторних досліджень, що можуть допомогти з прогнозом. Було запропоновано деякі перспективні підходи, в тому числі: інтерлейкін-6, оксид азоту та синтаза оксиду азоту, остеопонтін та фетуїн-A.[115] Оскільки хвороба прогресує внаслідок дегенерації нейронів, ведеться дослідження ролі білків, що показують втрату нервової тканини, таких як нейрофіламенти, тау та N-ацетіласпартат.[115] До інших цілей відносять пошук біомаркерів, що відрізняють людей, які дадуть відповідь на ліки, від людей, які не дадуть такої відповіді.[115]
Удосконалення таких способів нейровізуалізації, як позитрон-емісійна томографія (ПЕТ) або магнітно-резонансна томографія (МРТ), обіцяють покращити діагностику та можливості прогнозування, проте результат таких удосконалень у щоденній медичній практиці може проявитися через десятиріччя.[108] Що стосується МРТ, то існує декілька технологій, які вже виявилися корисними у дослідженнях та які можна додати до клінічної практики, наприклад, імпульсна послідовність із застосуванням подвійної інверсії, перенос намагніченості, дифузійний тензор та функціональна магнітно-резонансна томографія.[116] Ці технології є більш специфічними для захворювання, ніж існуючі, проте бракує стандартизації у протоколах зйомки та створенні нормативних значень.[116] Розробляють також інші технології, до яких відносяться контрастні речовини, що можуть виміряти рівні периферійних макрофагів, запалення або порушення функції нейронів,[116] та технології, що виміряють відкладення заліза та можуть встановити роль цього параметру у МС або роль перфузії головного мозку.[116] Так само нові радіоактивні індикатори ПЕТ можуть виконувати функцію маркерів змінених процесів, таких як запалення мозку, патологія кори, апоптоз або ремілієнація.[117]
Хронічна спинномозкова венозна недостатність
У 2008 р. судинний хірург Паоло Замбоні припустив, що МС пов'язаний зі звуженням вен, що ведуть до мозку, яке він назвав хронічною спинномозковою венозною недостатністю (ХСМВН). Він діагностував ХСМВН в усіх пацієнтів у своєму дослідженні, провів хірургічну процедуру виправлення цього стану, яку пізніше у пресі називали «процедурою визволення», і заявив про покращення у 73 % учасників.[118] Ця теорія привернула значну увагу у пресі та серед хворих на МС, особливо в Канаді.[119] Із дослідженням Замбоні виникали проблеми, оскільки воно не було ані сліпим, ані контрольованим, а його припущення про первопричину хвороби не підтверджувалися відомими даними.[120] Крім того, подальші дослідження також не виявили аналогічного зв'язку та тим більше не довели наявність будь-якого значного зв'язку,[121] після чого виникли серйозні заперечення цієї гіпотези.[122] «Процедуру визволення» з сумнівними перевагами критикували через серйозні ускладнення та випадки смерті при недостатній ефективності.[120] Тому з 2013 року вона не рекомендована як засіб лікування МС.[123] Наразі тривають додаткові дослідження з вивчення гіпотези ХСМВН.[124]
Література
- Dunkley B. T. Cross-network coupling of neural oscillations in the dynamic pain connectome reflects chronic neuropathic pain in multiple sclerosis // NeuroImage: Clinical — Elsevier BV, 2020. — Vol. 26. — P. 102230. — ISSN 2213-1582 — doi:10.1016/J.NICL.2020.102230
- NDF-RT
- Drug Indications Extracted from FAERS — doi:10.5281/ZENODO.1435999
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Compston A, Coles A (October 2008). Multiple sclerosis. Lancet 372 (9648): 1502–17. PMID 18970977. doi:10.1016/S0140-6736(08)61620-7.
- Compston A, Coles A (April 2002). Multiple sclerosis. Lancet 359 (9313): 1221–31. PMID 11955556. doi:10.1016/S0140-6736(02)08220-X.
- Murray ED, Buttner EA, Price BH (2012). Depression and Psychosis in Neurological Practice. У Daroff R, Fenichel G, Jankovic J, Mazziotta J. Bradley's neurology in clinical practice. (вид. 6th ed.). Philadelphia, PA: Elsevier/Saunders. ISBN 1-4377-0434-4.
- Lublin FD, Reingold SC; National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis (April 1996). Defining the clinical course of multiple sclerosis: results of an international survey. Neurology 46 (4): 907–11. PMID 8780061. doi:10.1212/WNL.46.4.907.
- Nakahara, J; Maeda, M; Aiso, S; Suzuki, N (2012 Feb). Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy.. Clinical reviews in allergy & immunology 42 (1): 26–34. PMID 22189514.
- Ascherio A, Munger KL (April 2007). Environmental risk factors for multiple sclerosis. Part I: the role of infection. Ann. Neurol. 61 (4): 288–99. PMID 17444504. doi:10.1002/ana.21117.
- Weinshenker BG (1994). Natural history of multiple sclerosis. Ann. Neurol. 36 (Suppl): S6–11. PMID 8017890. doi:10.1002/ana.410360704.
- World Health Organization (2008). Atlas: Multiple Sclerosis Resources in the World 2008. Geneva: World Health Organization. с. 15–16. ISBN 92-4-156375-3.
- Сучасні інфузійні препарати для лікування розсіяного склерозу в Україні: клінічна ефективність, безпека та економічні аспекти застосування. А.І. Бойко 2020
- Milo R, Kahana E (March 2010). Multiple sclerosis: geoepidemiology, genetics and the environment. Autoimmun Rev 9 (5): A387–94. PMID 19932200. doi:10.1016/j.autrev.2009.11.010.
- Clanet M (June 2008). Jean-Martin Charcot. 1825 to 1893 (PDF). Int MS J 15 (2): 59–61. PMID 18782501.
* Charcot, J. (1868). Histologie de la sclerose en plaques. Gazette des hopitaux, Paris 41: 554–5. - Kurtzke JF (1983). Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 33 (11): 1444–52. PMID 6685237. doi:10.1212/WNL.33.11.1444.
- Amato MP, Ponziani G (August 1999). Quantification of impairment in MS: discussion of the scales in use. Mult. Scler. 5 (4): 216–9. PMID 10467378.
- Rudick RA, Cutter G, Reingold S (October 2002). The multiple sclerosis functional composite: a new clinical outcome measure for multiple sclerosis trials. Mult. Scler. 8 (5): 359–65. PMID 12356200.
- Tsang, BK; Macdonell, R (2011 Dec). Multiple sclerosis- diagnosis, management and prognosis.. Australian family physician 40 (12): 948–55. PMID 22146321.
- Tataru N, Vidal C, Decavel P, Berger E, Rumbach L (2006). Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis. Neuroepidemiology 27 (1): 28–32. PMID 16804331. doi:10.1159/000094233.
- Heesen C, Mohr DC, Huitinga I,et al. (March 2007). Stress regulation in multiple sclerosis: current issues and concepts. Mult. Scler. 13 (2): 143–8. PMID 17439878. doi:10.1177/1352458506070772.
- Martinelli V (2000). Trauma, stress and multiple sclerosis. Neurol. Sci. 21 (4 Suppl 2): S849–52. PMID 11205361. doi:10.1007/s100720070024.[недоступне посилання з квітня 2019]
- Marrie RA (December 2004). Environmental risk factors in multiple sclerosis aetiology. Lancet Neurol 3 (12): 709–18. PMID 15556803. doi:10.1016/S1474-4422(04)00933-0.
- Alonso A, Hernán MA (July 2008). Temporal trends in the incidence of multiple sclerosis: a systematic review. Neurology 71 (2): 129–35. PMID 18606967. doi:10.1212/01.wnl.0000316802.35974.34.
- Pugliatti M, Sotgiu S, Rosati G (July 2002). The worldwide prevalence of multiple sclerosis. Clin Neurol Neurosurg 104 (3): 182–91. PMID 12127652.
- Ascherio A, Munger KL (June 2007). Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors. Ann. Neurol. 61 (6): 504–13. PMID 17492755. doi:10.1002/ana.21141.
- Ascherio A, Munger KL, Simon KC (June 2010). Vitamin D and multiple sclerosis. Lancet Neurol 9 (6): 599–612. PMID 20494325. doi:10.1016/S1474-4422(10)70086-7.
- Kulie T, Groff A, Redmer J, Hounshell J, Schrager S (2009). Vitamin D: an evidence-based review. J Am Board Fam Med 22 (6): 698–706. PMID 19897699. doi:10.3122/jabfm.2009.06.090037.
- Dyment DA, Ebers GC, Sadovnick AD (February 2004). Genetics of multiple sclerosis. Lancet Neurol 3 (92): 104–10. PMID 14747002. doi:10.1016/S1474-4422(03)00663-X.
- Hassan-Smith, G; Douglas, MR (2011 Oct). Epidemiology and diagnosis of multiple sclerosis.. British journal of hospital medicine (London, England : 2005) 72 (10): M146–51. PMID 22041658.
- Rosati G (April 2001). The prevalence of multiple sclerosis in the world: an update. Neurol. Sci. 22 (2): 117–39. PMID 11603614. doi:10.1007/s100720170011.
- Baranzini SE (June 2011). Revealing the genetic basis of multiple sclerosis: are we there yet?. Curr. Opin. Genet. Dev. 21 (3): 317–24. PMC 3105160. PMID 21247752. doi:10.1016/j.gde.2010.12.006.
- Kurtzke JF (October 1993). Epidemiologic evidence for multiple sclerosis as an infection. Clin. Microbiol. Rev. 6 (4): 382–427. PMC 358295. PMID 8269393. doi:10.1128/CMR.6.4.382.
- Gilden DH (March 2005). Infectious causes of multiple sclerosis. The Lancet Neurology 4 (3): 195–202. PMID 15721830. doi:10.1016/S1474-4422(05)01017-3.
- Spitsin S, Koprowski H (2008). Role of uric acid in multiple sclerosis. Curr. Top. Microbiol. Immunol. 318: 325–42. PMID 18219824.
- Chari DM (2007). Remyelination in multiple sclerosis. Int. Rev. Neurobiol. 79: 589–620. PMID 17531860. doi:10.1016/S0074-7742(07)79026-8.
- Pittock SJ, Lucchinetti CF (March 2007). The pathology of MS: new insights and potential clinical applications. Neurologist 13 (2): 45–56. PMID 17351524. doi:10.1097/01.nrl.0000253065.31662.37.
- Trojano M, Paolicelli D (November 2001). The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes. Neurol. Sci. 22 (Suppl 2): S98–102. PMID 11794488. doi:10.1007/s100720100044.[недоступне посилання з квітня 2019]
- Poser CM, Brinar VV (June 2004). Diagnostic criteria for multiple sclerosis: an historical review. Clin Neurol Neurosurg 106 (3): 147–58. PMID 15177763. doi:10.1016/j.clineuro.2004.02.004.
- McDonald WI, Compston A, Edan G, et al. (July 2001). Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann. Neurol. 50 (1): 121–7. PMID 11456302. doi:10.1002/ana.1032.
- Polman CH, Reingold SC, Edan G, et al. (December 2005). Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria". Ann. Neurol. 58 (6): 840–6. PMID 16283615. doi:10.1002/ana.20703.
- Rashid W, Miller DH (February 2008). Recent advances in neuroimaging of multiple sclerosis. Semin Neurol 28 (1): 46–55. PMID 18256986. doi:10.1055/s-2007-1019127.
- Link H, Huang YM (November 2006). Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness. J. Neuroimmunol. 180 (1–2): 17–28. PMID 16945427. doi:10.1016/j.jneuroim.2006.07.006.
- Gronseth GS, Ashman EJ (May 2000). Practice parameter: the usefulness of evoked potentials in identifying clinically silent lesions in patients with suspected multiple sclerosis (an evidence-based review): Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 54 (9): 1720–5. PMID 10802774. doi:10.1212/WNL.54.9.1720.
- Pittock SJ, Rodriguez M (2008). Benign multiple sclerosis: a distinct clinical entity with therapeutic implications. Curr. Top. Microbiol. Immunol. 318: 1–17. PMID 18219812. doi:10.1007/978-3-540-73677-6_1.
- Feinstein, A (2007). The clinical neuropsychiatry of multiple sclerosis (вид. 2nd ed.). Cambridge: Cambridge University Press. с. 20. ISBN 052185234X.
- Miller D, Barkhof F, Montalban X, Thompson A, Filippi M (May 2005). Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis. Lancet Neurol 4 (5): 281–8. PMID 15847841. doi:10.1016/S1474-4422(05)70071-5.
- Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M (April 2006). Secondary progressive multiple sclerosis: current knowledge and future challenges. Lancet Neurol 5 (4): 343–54. PMID 16545751. doi:10.1016/S1474-4422(06)70410-0.
- Miller DH, Leary SM (October 2007). Primary-progressive multiple sclerosis. Lancet Neurol 6 (10): 903–12. PMID 17884680. doi:10.1016/S1474-4422(07)70243-0.
- Stadelmann C, Brück W (November 2004). Lessons from the neuropathology of atypical forms of multiple sclerosis. Neurol. Sci. 25 (Suppl 4): S319–22. PMID 15727225. doi:10.1007/s10072-004-0333-1.
- Шаблон:Cite cochrane
- Multiple sclerosis : national clinical guideline for diagnosis and management in primary and secondary care (pdf). London: Royal College of Physicians. 2004. с. 54–57. ISBN 1-86016-182-0. PMID 21290636. Процитовано 6 лютого 2013.
- He, D; Xu, Z; Dong, S; Zhang, H; Zhou, H; Wang, L; Zhang, S (2012 Dec 12). Teriflunomide for multiple sclerosis. У Zhou, Hongyu. Cochrane database of systematic reviews (Online) 12: CD009882. PMID 23235682. doi:10.1002/14651858.CD009882.pub2.
- FDA approves new multiple sclerosis treatment Aubagio (прес-реліз). US FDA. 12 вересня 2012. Процитовано 21 січня 2013.
- Biogen Idec’s TECFIDERA™ (Dimethyl Fumarate) Approved in US as a First-Line Oral Treatment for Multiple Sclerosis (прес-реліз). Biogen Idec. 27 березня 2013. Процитовано 4 червня 2013.
- Manouchehrinia, A; Constantinescu, CS (2012 Oct). Cost-effectiveness of disease-modifying therapies in multiple sclerosis.. Current neurology and neuroscience reports 12 (5): 592–600. PMID 22782520.
- Hassan-Smith, G; Douglas, MR (2011 Nov). Management and prognosis of multiple sclerosis.. British journal of hospital medicine (London, England : 2005) 72 (11): M174–6. PMID 22082979.
- Freedman MS (January 2011). Long-term follow-up of clinical trials of multiple sclerosis therapies. Neurology 76 (1 Suppl 1): S26–34. PMID 21205679. doi:10.1212/WNL.0b013e318205051d.
- Qizilbash N, Mendez I, Sanchez-de la Rosa R (January 2012). Benefit-risk analysis of glatiramer acetate for relapsing-remitting and clinically isolated syndrome multiple sclerosis. Clin Ther 34 (1): 159–176.e5. PMID 22284996. doi:10.1016/j.clinthera.2011.12.006.
- Bates D (January 2011). Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials. Neurology 76 (1 Suppl 1): S14–25. PMID 21205678. doi:10.1212/WNL.0b013e3182050388.
- Johnston J, So TY (June 2012). First-line disease-modifying therapies in paediatric multiple sclerosis: a comprehensive overview. Drugs 72 (9): 1195–211. PMID 22642799. doi:10.2165/11634010-000000000-00000.
- Killestein J, Rudick RA, Polman CH (November 2011). Oral treatment for multiple sclerosis. Lancet Neurol 10 (11): 1026–34. PMID 22014437. doi:10.1016/S1474-4422(11)70228-9.
- A Study to Evaluate the Effects of Ocrelizumab on Immune Responses In Participants With Relapsing Forms of Multiple Sclerosis
- Kellerman, Rick D.; Edward N. Hanley Jr MD (2011). Conn's Current Therapy 2012: Expert Consult - Online and Print. Philadelphia: Saunders. с. 627. ISBN 1-4557-0738-4.
- Martinelli Boneschi, F; Vacchi, L; Rovaris, M; Capra, R; Comi, G (2013 May 31). Mitoxantrone for multiple sclerosis.. Cochrane database of systematic reviews (Online) 5: CD002127. PMID 23728638.
- Marriott, JJ; Miyasaki, JM; Gronseth, G; O'Connor, PW; Therapeutics and Technology Assessment Subcommittee of the American Academy of, Neurology (2010 May 4). Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology.. Neurology 74 (18): 1463–70. PMID 20439849.
- Balak, DM; Hengstman, GJ; Çakmak, A; Thio, HB (2012 Dec). Cutaneous adverse events associated with disease-modifying treatment in multiple sclerosis: a systematic review.. Multiple sclerosis (Houndmills, Basingstoke, England) 18 (12): 1705–17. PMID 22371220.
- Sládková T, Kostolanský F (2006). The role of cytokines in the immune response to influenza A virus infection. Acta Virol. 50 (3): 151–62. PMID 17131933.
- Munari L, Lovati R, Boiko A (2004). Therapy with glatiramer acetate for multiple sclerosis. У Munari, Luca M. Cochrane database of systematic reviews (Online) (1): CD004678. PMID 14974077. doi:10.1002/14651858.CD004678.
- Tremlett H, Oger J (November 2004). Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis. J. Neurol. 251 (11): 1297–303. PMID 15592724. doi:10.1007/s00415-004-0619-5.
- Comi G (October 2009). Treatment of multiple sclerosis: role of natalizumab. Neurol. Sci. 30. Suppl 2 (S2): S155–8. PMID 19882365. doi:10.1007/s10072-009-0147-2.
- Hunt, D; Giovannoni, G (2012 Feb). Natalizumab-associated progressive multifocal leucoencephalopathy: a practical approach to risk profiling and monitoring.. Practical neurology 12 (1): 25–35. PMID 22258169.
- Killestein J, Rudick RA, Polman CH (November 2011). Oral treatment for multiple sclerosis. Lancet Neurol 10 (11): 1026–34. PMID 22014437. doi:10.1016/S1474-4422(11)70228-9.
- NDA 204063 - FDA Approved Labeling Text. US Food and Drug Agency. 27 березня 2013. Процитовано 5 квітня 2013.
NDA Approval. US Food and Drug Agency. 27 березня 2013. Процитовано 5 квітня 2013. - Saidha S, Eckstein C, Calabresi PA (January 2012). New and emerging disease modifying therapies for multiple sclerosis. Ann. N. Y. Acad. Sci. 1247: 117–37. PMID 22224673. doi:10.1111/j.1749-6632.2011.06272.x.
- Kesselring J, Beer S (October 2005). Symptomatic therapy and neurorehabilitation in multiple sclerosis. Lancet Neurol 4 (10): 643–52. PMID 16168933. doi:10.1016/S1474-4422(05)70193-9.
- Khan F, Turner-Stokes L, Ng L, Kilpatrick T (2007). Multidisciplinary rehabilitation for adults with multiple sclerosis. У Khan, Fary. Cochrane Database Syst Rev (2): CD006036. PMID 17443610. doi:10.1002/14651858.CD006036.pub2.
- Steultjens EM, Dekker J, Bouter LM, Leemrijse CJ, van den Ende CH (2005). Evidence of the efficacy of occupational therapy in different conditions: an overview of systematic reviews. Clinical rehabilitation 19 (3): 247–54. PMID 15859525. doi:10.1191/0269215505cr870oa.
- Steultjens EM, Dekker J, Bouter LM, Cardol M, Van de Nes JC, Van den Ende CH (2003). Occupational therapy for multiple sclerosis. У Steultjens, Esther EMJ. Cochrane database of systematic reviews (Online) (3): CD003608. PMID 12917976. doi:10.1002/14651858.CD003608.
- Gallien P, Nicolas B, Robineau S, Pétrilli S, Houedakor J, Durufle A (2007). Physical training and multiple sclerosis. Ann Readapt Med Phys 50 (6): 373–6, 369–72. PMID 17482708. doi:10.1016/j.annrmp.2007.04.004.
- Rietberg MB, Brooks D, Uitdehaag BMJ, Kwakkel G (2005). Exercise therapy for multiple sclerosis. У Kwakkel, Gert. Cochrane Database of Systematic Reviews (1): CD003980. PMID 15674920. doi:10.1002/14651858.CD003980.pub2.
- Thomas PW, Thomas S, Hillier C, Galvin K, Baker R (2006). Psychological interventions for multiple sclerosis. У Thomas, Peter W. Cochrane Database of Systematic Reviews (1): CD004431. PMID 16437487. doi:10.1002/14651858.CD004431.pub2.
- Huntley A (January 2006). A review of the evidence for efficacy of complementary and alternative medicines in MS. Int MS J 13 (1): 5–12, 4. PMID 16420779.
- Olsen SA (2009). A review of complementary and alternative medicine (CAM) by people with multiple sclerosis. Occup Ther Int 16 (1): 57–70. PMID 19222053. doi:10.1002/oti.266.
- Jagannath, VA; Fedorowicz, Z; Asokan, GV; Robak, EW; Whamond, L (2010 Dec 8). Vitamin D for the management of multiple sclerosis.. Cochrane database of systematic reviews (Online) (12): CD008422. PMID 21154396.
- Farinotti M, Simi S, Di Pietrantonj C, et al. (2007). Dietary interventions for multiple sclerosis. У Farinotti, Mariangela. Cochrane database of systematic reviews (Online) (1): CD004192. PMID 17253500. doi:10.1002/14651858.CD004192.pub2.
- Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M. (September 2011). N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis.. J Biol Chem. PMID 21965673. doi:10.1074/jbc.M111.277814. Epub 2011 Sep 29.
- Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E (2006). Cannabis use in patients with multiple sclerosis. Mult. Scler. 12 (5): 646–51. PMID 17086912. doi:10.1177/1352458506070947.
- Bennett M, Heard R (2004). Hyperbaric oxygen therapy for multiple sclerosis. У Bennett, Michael H. Cochrane database of systematic reviews (Online) (1): CD003057. PMID 14974004. doi:10.1002/14651858.CD003057.pub2.
- Adams, Tim (23 травня 2010). Gut instinct: the miracle of the parasitic hookworm. The Observer.
- Phadke JG (May 1987). Survival pattern and cause of death in patients with multiple sclerosis: results from an epidemiological survey in north east Scotland. J. Neurol. Neurosurg. Psychiatr. 50 (5): 523–31. PMC 1031962. PMID 3495637. doi:10.1136/jnnp.50.5.523.
- Myhr KM, Riise T, Vedeler C, et al (February 2001). Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension. Mult. Scler. 7 (1): 59–65. PMID 11321195.
- Lozano, R (2012 Dec 15). Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010.. Lancet 380 (9859): 2095–128. PMID 23245604.
- Compston A (October 1988). The 150th anniversary of the first depiction of the lesions of multiple sclerosis. J. Neurol. Neurosurg. Psychiatr. 51 (10): 1249–52. PMC 1032909. PMID 3066846. doi:10.1136/jnnp.51.10.1249.
- Lassmann H (October 1999). The pathology of multiple sclerosis and its evolution. Philos. Trans. R. Soc. Lond., B, Biol. Sci. 354 (1390): 1635–40. PMC 1692680. PMID 10603616. doi:10.1098/rstb.1999.0508.
- Lassmann H (July 2005). Multiple sclerosis pathology: evolution of pathogenetic concepts. Brain Pathology 15 (3): 217–22. PMID 16196388. doi:10.1111/j.1750-3639.2005.tb00523.x.
- Medaer R (September 1979). Does the history of multiple sclerosis go back as far as the 14th century?. Acta Neurol. Scand. 60 (3): 189–92. PMID 390966. doi:10.1111/j.1600-0447.1979.tb08970.x.
- Holmøy T (2006). A Norse contribution to the history of neurological diseases. Eur. Neurol. 55 (1): 57–8. PMID 16479124. doi:10.1159/000091431.
- Firth, D (1948). The Case of August D`Esté. Cambridge: Cambridge University Press.
- Pearce JM (2005). Historical descriptions of multiple sclerosis. Eur. Neurol. 54 (1): 49–53. PMID 16103678. doi:10.1159/000087387.
- Barbellion, Wilhelm Nero Pilate (1919). The Journal of a Disappointed Man. New York: George H. Doran. ISBN 0-7012-1906-8.
- Cohen JA (July 2009). Emerging therapies for relapsing multiple sclerosis. Arch. Neurol. 66 (7): 821–8. PMID 19597083. doi:10.1001/archneurol.2009.104.
- Miller AE (2011). Multiple sclerosis: where will we be in 2020?. Mt. Sinai J. Med. 78 (2): 268–79. PMID 21425270. doi:10.1002/msj.20242.
- Jeffrey, susan (09 серпня 2012). CONCERTO: A Third Phase 3 Trial for Laquinimod in MS. Medscape Medical News. Процитовано 21 травня 2013.
- Kieseier BC, Calabresi PA (March 2012). PEGylation of interferon-β-1a: a promising strategy in multiple sclerosis. CNS Drugs 26 (3): 205–14. PMID 22201341. doi:10.2165/11596970-000000000-00000.
- Biogen Idec Announces Positive Top-Line Results from Phase 3 Study of Peginterferon Beta-1a in Multiple Sclerosis (прес-реліз). Biogen Idec. 24 січня 2013. Процитовано 21 травня 2013. Архівовано 2013-10-04 у Wayback Machine.
- Milo R, Panitch H (February 2011). Combination therapy in multiple sclerosis. J. Neuroimmunol. 231 (1-2): 23–31. PMID 21111490. doi:10.1016/j.jneuroim.2010.10.021.
- Luessi F, Siffrin V, Zipp F (September 2012). Neurodegeneration in multiple sclerosis: novel treatment strategies. Expert Rev Neurother 12 (9): 1061–76; quiz 1077. PMID 23039386. doi:10.1586/ern.12.59.
- Mehta V, Pei W, Yang G, et al. (2013). Iron is a sensitive biomarker for inflammation in multiple sclerosis lesions. PLoS ONE 8 (3): e57573. PMC 3597727. PMID 23516409. doi:10.1371/journal.pone.0057573.
- Harris VK, Sadiq SA (2009). Disease biomarkers in multiple sclerosis: potential for use in therapeutic decision making. Mol Diagn Ther 13 (4): 225–44. PMID 19712003. doi:10.2165/11313470-000000000-00000.
- Filippi M, Rocca MA, De Stefano N, et al. (December 2011). Magnetic resonance techniques in multiple sclerosis: the present and the future. Arch. Neurol. 68 (12): 1514–20. PMID 22159052. doi:10.1001/archneurol.2011.914.
- Kiferle L, Politis M, Muraro PA, Piccini P (February 2011). Positron emission tomography imaging in multiple sclerosis-current status and future applications. Eur. J. Neurol. 18 (2): 226–31. PMID 20636368. doi:10.1111/j.1468-1331.2010.03154.x.
- Zamboni P, Galeotti R, Menegatti E, et al. (April 2009). Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis. J. Neurol. Neurosurg. Psychiatr. 80 (4): 392–9. PMC 2647682. PMID 19060024. doi:10.1136/jnnp.2008.157164.
- Pullman D, Zarzeczny A, Picard A (2013). Media, politics and science policy: MS and evidence from the CCSVI Trenches. BMC Med Ethics 14: 6. PMC 3575396. PMID 23402260. doi:10.1186/1472-6939-14-6.
- Qiu J (May 2010). Venous abnormalities and multiple sclerosis: another breakthrough claim?. Lancet Neurol 9 (5): 464–5. PMID 20398855. doi:10.1016/S1474-4422(10)70098-3.
- Ghezzi A, Comi G, Federico A (February 2011). Chronic cerebro-spinal venous insufficiency (CCSVI) and multiple sclerosis. Neurol. Sci. 32 (1): 17–21. PMID 21161309. doi:10.1007/s10072-010-0458-3.
- Dorne H, Zaidat OO, Fiorella D, Hirsch J, Prestigiacomo C, Albuquerque F, Tarr RW. (October 2010). Chronic cerebrospinal venous insufficiency and the doubtful promise of an endovascular treatment for multiple sclerosis. J NeuroIntervent Surg 2 (4): 309–311. PMID 21990639. doi:10.1136/jnis.2010.003947.
- Baracchini C, Atzori M, Gallo P (March 2013). CCSVI and MS: no meaning, no fact. Neurol. Sci. 34 (3): 269–79. PMID 22569567. doi:10.1007/s10072-012-1101-2.
- van Zuuren, EJ; Fedorowicz, Z; Pucci, E; Jagannath, VA; Robak, EW (2012 Dec 12). Percutaneous transluminal angioplasty for treatment of chronic cerebrospinal venous insufficiency (CCSVI) in multiple sclerosis patients.. Cochrane database of systematic reviews (Online) 12: CD009903. PMID 23235683.
Інші джерела
- Langgartner M, Langgartner I, Drlicek M (April 2005). The patient's journey: multiple sclerosis. BMJ 330 (7496): 885–8. PMC 556161. PMID 15831874. doi:10.1136/bmj.330.7496.885.
- A Study to Evaluate the Effects of Ocrelizumab on Immune Responses In Participants With Relapsing Forms of Multiple Sclerosis
Див. також
Посилання
- Склероз розсіяний // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
- Database for analysis and comparison of global data on the epidemiology of MS
- «Окревус» на сайті Європейського медичного агентства (European Medicines Agency)
- Розсіяний склероз, каталог посилань Open Directory Project[недоступне посилання]