Вірус імунодефіциту котів
Вірус імунодефіциту котів або ВІК (англ. Feline immunodeficiency virus, FIV) — це лентивірус, що вражає котів у всьому світі (загалом від 2,5 % до 4,4 %[1][2] котів є інфікованими). ВІК таксономічно відрізняється від двох інших котячих ретровірусів, вірусу лейкозу котячих (FeLV) та Feline foamy virus (FFV), та є ближчим до вірусу імунодефіциту людини (ВІЛ). Розрізняють п'ять підвидів ВІК на основі кодування нуклеотидних послідовностей для вірусної оболонки (env) або полімерази (pol). ВІК є єдиним лентивірусом, що не стосується приматів, але призводить до синдрому, схожого на СНІД (FAIDS[de]). Проте ВІК не є типово летальним для котів, оскільки вони можуть жити відносно здоровим життям, переносячи хворобу протягом багатьох років. Існує вакцина, хоча її ефективність лишається неточною. Після вакцинації тести котів показують позитивний результат на антитіла ВІК.[3]

ВІК вперше виділив у 1986 року Нільс Педерсен з UC Davis School of Veterinary Medicine в колонії котів, що мали високу поширеність опортуністичних інфекцій та дегенеративних хвороб. Його назвали Feline T-lymphotropic virus.[4] Згодом вірус було ідентифіковано в домашніх котів.[5]
Загальні відомості
ВІК і ВІЛ обидва є лентивірусами. Як і ВІЛ-1, ВІК в основному інфікує CD4-позитивні[en] Т-лімфоцити. Однак ВІК має дещо ширший діапазон клітин, які він може інфікувати. На додаток до CD4-позитивних Т-клітин, моноцитів, макрофагів і гліальних клітин, ВІК також інфікує CD8-позитивні Т- і В-клітини. Основним рецептором зовнішнього глікопротеїну (gp95) ВІК є не CD4, як у випадку з ВІЛ-1, а CD134.[6][7]
ВІК порушує імунну систему котів, інфікуючи багато типів клітин, включаючи CD4+ і CD8+, Т-лімфоцити, В-лімфоцити та макрофаги. ВІК може добре переноситися котами, але в кінцевому підсумку може призвести до ослаблення Їх імунної системи через інфекцію та виснаження Т-хелперних (CD4+) клітин.
Однак, люди не можуть бути інфіковані ВІК, так само як і коти не можуть бути інфіковані ВІЛ.
Після первинного зараження кіт негайно виробляє специфічні до вірусу антитіла і цитотоксичні Т-клітини, але не може повністю подолати інфекцію, всупереч бурхливій імунній реакції.
ВІК передається переважно через глибокі рани від укусів, де вірус, присутній у слині інфікованої кішки проникає в тканини тіла іншої кішки. Коти ВІК+ можуть ділитися мисками з водою, їжею (вологим або сухим кормом) та використовувати один лоток з низьким ризиком передачі хвороби.
Якщо слідкувати за вторинними інфекціями та вчасно лікувати їх, може дозволити інфікованому коту прожити досить довге життя. Імовірність того, що ВІК-позитивний кіт передасть вірус іншим котам у побуті - низька, за винятком випадків, коли між кішками відбувається бійка або є наявні рани, які можуть дозволити проникненню вірусу від інфікованої кішки до неінфікованої.
У новонароджених кошенят може бути позитивний результат до шести місяців, а потім у більшості з них буде поступово показувати негативний результат. Вважається, що це відбувається через антитіла, які передаються кошенятам через молоко матері. Однак ці антитіла є тимчасовими, тому подальший тест буде негативним.
Історія
Перші штами вірусу ВІК були виділені у домашніх котів у 1986 році з мононуклеарних клітин периферичної крові (PBMCs[en]) цих тварин. Спалах імунодефіциту стався в домогосподарстві в Петалумі, Каліфорнія, де проживала велика кількість котів. Ці тварини були перевірені на вірус котячої лейкемії[en] (FeLV), але всі вони були негативними. У них брали зразки крові та вводили двом здоровим тваринам, у яких через 4-6 тижнів підіймалася температура, зменшувалась кількість лейкоцитів та набухали лімфатичні вузли.
Після першого опису з Північної Америки, ВІК також поступово виявляли у домашніх котів з усього світу. Світова поширеність домашніх котів, інфікованих ВІК, у регіонах і країнах становить 2-30%. Оскільки домашня кішка була поширена з Європи за допомогою торговців і дослідників по всьому світу сотні років тому, можна припустити, що домашні кішки також були ВІК інфіковані протягом тривалого часу. Заморожені котячі сироватки - найстаріші сироватки, які досліджувалися у Японії та США з 1968 року - також дали позитивні серотести. Числа розподілу коливаються залежно від попереднього відбору матеріалу вибірки та щільності населення.[8] [9] [10]
Серологічні тести такого роду (наприклад, за допомогою ІФА) все ще залишаються найважливішим методом виявлення інфекції ВІК. Спочатку антигени домашніх котів також використовували для тестування сироваток диких видів котів. З підвищенням характеристики видоспецифічних штамів ВІК використовували їх антигени, що значно підвищило чутливість тестів. У той же час було визнано, що віруси ВІК є великою та еволюційно старою групою ретровірусів.
Незабаром після цього було виявлено, що зразки сироватки диких кішок, таких як африканські леви та гепарди, азіатські леви та тигри, південноамериканські ягуари та північноамериканські пуми, також перехресно реагували з антигенами ВІК та EIAV[de], лентивірусом коней. Ці реакції вказували на інфікування ВІК.
Відомі штами ВІК утворюють власний кластер всередині лентивірусів і можуть бути приблизно розділені на види старого і нового світу. Найтісніше споріднення існує з лентивірусами великої рогатої худоби і коней.
Станом на 2006 рік визнані три основні клади ВІК: ВІК-Ple (лев), ВІК-Fca (домашня кішка) і ВІК-Pco (пума).[11]
Походження та поширення
Точне походження та поява ВІК у котячих невідомі, однак дослідження філогенетики вірусу, видоутворення котячих та поширення ВІК натякають на походження з Африки.
Аналіз вірусної філогенетики показує філогенетичні дерева з філогенетичним малюнком зірок, який зазвичай демонструється вірусами, які з'явилися нещодавно з швидкою еволюцією.[12] Однак відмінності в топології, довжині гілок, висока генетична дивергенція свідчать про більш давнє походження видів котячих. Записи скам’янілостей вказують на те, що сучасні котячі виникли від спільного предка в Азії приблизно 10,8 мільйонів років тому, і з тих пір тридцять вісім видів з восьми різних еволюційних ліній поширилися та успішно заселили всі континенти, крім Антарктиди.[13] Незважаючи на походження котячих в Азії, ВІК відсутній у ціх видів, за винятком Монгольського Манула. Однак ВІК є дуже ендемічним в Африці, і чотири з п'яти котячих мають серопозитивні результати ПЛР.[14] Через широке поширення та міжвидову дивергенцію штамів ВІК в Африці, є припущення, що ВІК виник в Африці до поширення в усьому світі. Висока генетична різноманітність і розбіжність між штамами ВІК у видів африканських котячих і присутність ВІК-Ccr у гієн, узгоджуються з тривалим часом перебування, що створює додаткові можливості для міжвидової передачі. Крім того, лентивіруси також є дуже ендемічними в Африці, заражаючи не тільки котячих, а й приматів і копитних. Це свідчить про походження всіх лентивірусів і підтверджує походження ВІК з Африки, однак необхідні подальші дослідження.[15] [16]
Філогенія
Відомі досі штами ВІК дуже дивергентні, але монофілетичні, тобто вони походять від однієї батьківської форми. Підтипи можуть бути визначені для трьох штамів ВІК від різних видів тварин. ВІК домашнього кота був найкраще дослідженим на сьогоднішній день і має п’ять підтипів, які зустрічаються з різними частотами в усьому світі і позначені від A до E.[17][18] Поділ на п’ять підгруп здійснювали після порівняння послідовності ДНК гена env, що кодує білки оболонки. Підгрупи від A до C поширені по всьому світу, D зустрічається переважно у Східній Азії, а E лише в Південній Америці.
ВІК-Ple також визначив три підгрупи, позначені від A до C. Цей підрозділ було зроблено на основі відмінностей послідовності в гені pol, який кодує вірусні ферменти (протеазу, інтегразу та зворотну транскриптазу). У випадку ВІК-Pco було визначено дві підгрупи на основі відмінностей в pol та позначених А і В. Відмінності в послідовності ДНК між окремими штамами ВІК іноді бувають значними і становлять, наприклад, 30% для гена pol з ВІК-Ple, ВІК-Fca і ВІК-Pco.
Еволюція
Дикі котячі
Порівняння підтипів ВІК ілюструють швидку еволюцію та підкреслюють розбіжність у його штамах. ВІК-Pco, специфічний для американських пум, має два дуже розбіжних підтипи.[19] Кілька досліджень продемонстрували, що підтипи A і B мають велику довжину гілок і низьку географічну схожість, що вказує на можливість двох окремих інтродукцій ВІК в популяції разом із тривалим часом перебування.[19] У пізньому плейстоцені пуми стали жертвами льодовикового періоду, вони вимерли в Північній Америці, за винятком невеликої інбридної популяції у Флориді, і не з'являлися знову до 10-12 000 років тому.[20] [21]
Філогенетичний аналіз штамів ВІК-Pco у Центральній, Південній та Північній Америці показує, що штами Центральної та Південної Америки більш тісно пов'язані з північноамериканськими штамами, ніж один з одним.[19] [22] Це говорить про те, що ВІК-Pco вже був присутній у південноамериканських пумах, які знову заселили Північну Америку.[22] У африканських левів ВІК-Ple розділився на шість підтипів A-F, які певною мірою демонструють чітку географічну ендемічність.[23] Приблизно 2 мільйони років тому африканські леви виникли і розповсюдилися по Африці, Азії, Північній, Центральній і Південній Америці. Сучасні леви в даний час живуть лише на африканському континенті, за винятком невеликої популяції в Індії.[20] Немає документально підтвердженої асоціаціями захворювання з ВІК, але серопоширеність у популяціях левів на вільних підрахунках становить приблизно 90%.[24] Філогенетичний аналіз підтипів A, B і C ВІК-Ple показує високу внутрішньо- та міжіндивідуальну генетичну різноманітність і розбіжність послідовностей, порівнянну з генетичними відмінностями від штамів інших видів котячих.[25] Ці висновки вказують на те, що ці штами еволюціонували в географічно віддалених популяціях левів, однак недавня поява цих штамів у популяціях Національного парку Серенгеті свідчить про недавнє зближення в одній популяції.
Великі коливання також відбуваються в різних географічних регіонах. Леви в Серенгеті практично на 100% серопозитивні, тоді як леви в Намібії та дикі азіатські леви постійно серонегативні. Пуми Вайомінгу майже на 100% позитивні, тоді як пуми Монтани лише на 20% позитивні. Оскільки еволюційний розвиток лентивірусів відбувається у котів швидко, розподіл і подібність штамів ВІК дозволяють зробити висновки про поширення, території, міграційну поведінку та динаміку популяції різних видів котів.[26] Однак збір і аналіз цих даних все ще знаходиться на початковому етапі.
Домашні котячі
У домашніх котів ВІК-Fca є патогенним і може призвести до симптомів СНІДу та подальшої смерті. Філогенетичний аналіз показує, що ВІК є монофілетичною гілкою, яка розходиться на п'ять підтипів A, B, C, D та E.[17] [18] Домашні коти виникли нещодавно, ніж інші види котячих, приблизно 10 000 років тому від підвиду дикої кішки Felis silvestris, яка населяла Східну Азію. Генетичний аналіз вказує на нижчу генетичну різноманітність ВІК у домашніх котів порівняно з дикими видами котячих, вищі показники еволюції та вищі показники смертності порівняно з ВІК-Ple та ВІК-Pco.[27] Це свідчить про те, що ВІК у домашніх котів з’явився нещодавно, оскільки нові віруси, як правило, мають більш високі темпи еволюції з незначною або повною відсутністю коадаптації між вірусом і новими видами-хазяїнами.[28] Крім того, дослідження серорозповсюдження показують, що ВІК у котів-компаньйонів зустрічається у 4–12%, тоді як у диких котів – 8–19%, що набагато нижче порівняно з дикими видами котячих, що підтверджує гіпотезу про недавню появу вірусу у цього виду.[29] [30]
Патогенність і специфічність
Патогенність штамів ВІК важко визначити для котів у дикій природі. Епідеміологічні дослідження, в яких показники виживання порівнювалися з показниками зараження та відтворення, не змогли виявити статистично значущих недоліків для інфікованих тварин. Тому багато штамів, які виникають, можна вважати непатогенними. Натомість у неволі, коли середня тривалість життя тварин значно збільшується, симптоми захворювання розвиваються. Низька патогенність штамів ВІК у диких кішок свідчить про тривалу взаємодію патоген-хазяїн, яка, як і Вірус імунодефіциту мавп, існує, ймовірно, приблизно від одного до двох мільйонів років.[31]
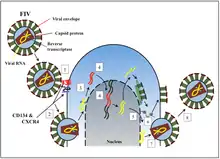
Вірус проникає в клітини-хазяїни завдяки взаємодії власних глікопротеїнів оболонки з поверхневими рецепторами клітин-мішеней. По-перше, глікопротеїн SU зв’язується з CD134, рецептором на клітині-хазяїні. Це початкове зв’язування змінює форму білка SU на таку, яка полегшує взаємодію між SU та рецептором хемокінів CXCR4.[32] Ця взаємодія викликає злиття вірусної та клітинної мембран, що дозволяє переносити вірусну РНК в цитоплазму, де вона зворотно транскрибується та інтегрується в клітинний геном шляхом негомологічної рекомбінації[en]. Після інтеграції в геном клітини-хазяїна, вірус може тривалий час перебувати у сплячці в безсимптомному стані, не виявляючись імунною системою, або може викликати лізис клітини.[33] [34]
CD134 переважно виявляється на активованих Т-клітинах і зв’язується з лігандом OX40, викликаючи стимуляцію, проліферацію, активацію та апоптоз Т-клітин. Це призводить до значного зниження кількості клітин, які відіграють важливу роль в імунній системі. Низький рівень CD4+ та інших уражених клітин імунної системи призводить до того, що кішка стає вразливою до опортуністичних захворювань, коли хвороба прогресує до синдрому набутого імунного дефіциту котів (FAIDS).
Структура вірусу

ВІК має структуру, подібну до лентивірусів приматів і копитних. Віріон має діаметр від 80 до 100 нанометрів і є плеоморфним. Вірусна оболонка також має невеликі виступи на поверхні, 8 нм, і рівномірно покриває її.[33]
Геном вірусу ВІК диплоїдний. Він складається з двох ідентичних одноланцюгів РНК, у кожному з них близько 9400 нуклеотидів, що існують в орієнтації плюс-ланцюга ((+) РНК). Він має типову геномну структуру ретровірусів і включає гени LTR, vif, pol, gag, orfA, env, та rev.[35] [36] [37] Поліпротеїн gag розщеплюється на матричні (MA), капсидні (CA) і нуклеокапсидні (NC) білки. Розщеплення між CA і NC вивільняє пептид з дев’ятьма амінокислотами, тоді як розщеплення на C-кінці NC вивільняє фрагмент 2 кДа (p2). Поліпротеїн pol транслюється за допомогою рибосомного зсуву рамки, характерної для ВІЛ. Розщеплення pol вірусною протеазою вивільняє саму протеазу (PR), зворотну транскриптазу (RT), дезоксиуридинтрифосфатазу (dUTPase або DU) та інтегразу (IN). Поліпротеїн env складається з лідерного пептиду (L), поверхневого (SU) і трансмембранного (TM) глікопротеїнів. Як і інші лентивіруси, геном ВІК кодує додаткові короткі відкриті рамки зчитування (ORFs), що кодують білки vif і rev. Додатковий короткий ORF під назвою orfA (також відомий як orf2) переважає ген env. Функція orfA у реплікації вірусу неясна, однак продукт, закодований orfA, може мати багато властивостей додаткових генних продуктів ВІЛ-1, таких як Vpr, Vpu або Nef.
Серед цих підтипів генетичні послідовності переважно зберігаються, проте між видовими підтипами ВІК існують широкі генетичні відмінності. З геному ВІК, pol є найбільш консервативним серед штамів разом із gag. Та env, vif, orfA і rev, навпаки, є найменш консервативними і демонструють найбільше генетичне різноманіття серед штамів ВІК.[38]
Капсидний білок, отриманий з поліпротеїну gag, збирається у вірусне ядро (білкова оболонка вірусу), а матриксний білок[en], також отриманий з gag, утворює оболонку безпосередньо всередині ліпідного бішару. Поліпротеїн env кодує поверхневий глікопротеїн (SU) та трансмембранний глікопротеїн (TM). І SU, і TM глікопротеїни сильно глікозильовані, що, на думку вчених, може маскувати В-клітинні епітопи глікопротеїну env, надаючи вірусу стійкість до антитіл, що нейтралізують вірус.[33]
Лентивірусний вектор
Як і ВІЛ-1, ВІК був створений як вірусний вектор для генної терапії.[39] Як і інші лентивірусні вектори, вектори ВІК інтегруються в хромосому клітини-хазяїна, де вони можуть генерувати довготривалу стабільну експресію трансгену. Крім того, вектори можна використовувати на клітинах, що діляться та не діляться.[39][40] Вектори ВІК потенційно можуть використовуватися для лікування неврологічних розладів, таких як хвороба Паркінсона, і вже використовувалися для передачі РНК-і, які можуть знайти застосування в якості генної терапії раку.[41]
Передача
Основний шлях передачі – через глибокі рани від укусів, при яких слина інфікованого кота потрапляє в тканини іншого кота. ВІК також може передаватися від вагітних самок їх нащадкам внутрішньоутробно, однак ця вертикальна передача вважається відносно рідкісною, виходячи з невеликої кількості ВІК-інфікованих кошенят і підлітків.[3] [42] Це відрізняється від FeLV, який може поширюватися через більш випадковий, неагресивний контакт, наприклад, взаємний догляд і спільне використання мисок з їжею.
Експериментально ВІК також може передаватися парентерально, тобто внутрішньовенно, внутрішньоочеревинно або підшкірно.[43] Передача через слизові оболонки (ніс, рот, піхва, пряма кишка) настільки ж можлива експериментально, але набагато менш ефективна, ніж при ВІЛ людини.[44]
Деякі дослідження розглядали вертикальну передачу вірусу після експериментальних або природних інфекцій.[45] [46] [47]
У дослідженні [48] не спостерігалося вертикальної або горизонтальної передачі вірусу серед 25 котів (шість ВІК +, 19 ВІК-) і 48 кошенят (30 народжених ВІК + кішок) (закрита колонія, спостереження протягом 9 місяців). Одне дослідження показало передачу дитині від природно-інфікованої матері. Також на хронічно експериментально заражених матках можна було б показати, що близько половини дітей також були ВІК+.[49]
У дослідженні з натурально інфікованими ВІК+ кішками не було виявлено передачі від п'яти ВІК+ кішок їхнім 19 кошенятам. Аналогічно, не можна було визначити передачу ВІК кішкам після природного впливу ВІК+ кішок протягом 38 місяців. Тому автори вважають малоймовірним, що заражені в природи коти можуть передавати вірус вертикально або горизонтально (за винятком ран від укусів). Тому під час інтеграції нових котів слід подбати про те, щоб вони не виявляли жодної агресії.[50]
ВІК та людина
Люди не можуть бути інфіковані ВІК, так само як і коти не можуть бути інфіковані ВІЛ.
Ні в одному випадку не вдалося спонукати ВІК до розмноження в клітинах або клітинних лініях людини. Бар’єр, який перешкоджає вірусу пройти через повний цикл реплікації, не лежить ні при попаданні клітини в клітину, ні при її перетині через ядерну мембрану та не проходить крізь неї. В результаті після інфікування клітини не можуть утворювати подальші вірусні частинки.[51]
Перебіг захворювання
ВІК прогресує через стадії, подібні до ВІЛ у людей. Початкова стадія, або гостра фаза, супроводжується легкими симптомами, такими як млявість, анорексія, лихоманка та лімфаденопатія.[42] Ця початкова стадія досить коротка, за нею переходить безсимптомна стадія. Тут кіт не демонструє помітних симптомів протягом різного часу. Деякі коти залишаються в цій латентній стадії лише кілька місяців, але для деяких - це може тривати роками. Фактори, що впливають на тривалість безсимптомної стадії, включають патогенність заражаючого вірусу та підтипу ВІК (A–E), вік кота та вплив інших патогенів. Нарешті, ВІК переходить у кінцеву стадію (відому як стадія синдрому набутого імунодефіциту у котів (FAIDS)), на якій кіт надзвичайно сприйнятлив до вторинних захворювань, які неминуче є причиною смерті.[34]
Прогноз сильно залежить від віку кота на момент зараження. У новонароджених котів розвивається атрофія тимуса, втрата тканин тимуса, що призводить до важкого імунодефіциту і передчасної смерті. У старших котів часто спостерігаються регрес інфекції або його м’які форми. Підтип ВІК та вплив інших патогенів також мають важливе значення для тривалості безсимптомної фази.[52] [53]
Підсумовуючи, більшість котів, інфікованих ВІК від природи, не мають серйозних клінічних симптомів і можуть жити без проблем зі здоров’ям роками після зараження.[53]
Тестування
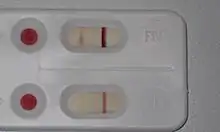
Ветеринари перевіряють історію кота, оглядають на клінічні ознаки та роблять аналіз крові на антитіла до ВІК. Наразі в Україні це тестування легкодоступне. Воно ідентифікує тих котів, які несуть антитіла до ВІК, але не виявляють справжній вірус.
Хибно-позитивний результат виникає, коли кіт несе антитіла (які нешкідливі), але не переносить вірус. Найчастіше це трапляється, коли кошенят перевіряють після прийому антитіл з материнського молока (пасивний імунітет), а також при тестуванні котів, які були раніше вакциновані від ВІК (активний імунітет). З цієї причини не тестуються ні кошенята до восьми тижнів, ні коти, які були раніше вакциновані. Кошенята та молоді коти, які виявили позитивний результат на антитіла до ВІК через пасивний імунітет, пізніше в житті стає негативним через сероконверсію, за умови, що вони ніколи не були заражені ВІК і ніколи не були імунізовані вакциною від ВІК.
Коти, які були вакциновані, будуть позитивні на антитіла до ВІК до кінця свого життя через сероконверсію, навіть якщо вони не інфіковані. Таким чином, тестування бродячих котів або котів, яких прихистили, не є остаточним, оскільки неможливо дізнатися, чи були вони вакциновані в минулому. З цих причин сам по собі позитивний тест на антитіла до ВІК ніколи не слід використовувати як критерій евтаназії.[54]
Тести можна проводити в кабінеті ветеринара та за лічені хвилини получити результат, що дозволяє швидко отримати консультацію. Раннє виявлення допомагає підтримувати здоров’я кота і запобігає поширенню інфекції на інших котів. При належному догляді інфіковані коти можуть жити довгим і здоровим життям.
Можливості лікування
Наразі, в Україні не проводять лікування ВІК або профілактику за допомогою вакцини від ВІК.
Але, в деякіх країнах існує лікуання Т-клітинним імуномодулятором лімфоцитів.[55] Його використовують як допоміжний засіб при лікуванні котів, інфікованих вірусом лейкемії котів (FeLV) та/або вірусом імунодефіциту котів (ВІК), а також супутніми симптомами лімфоцитопенії, опортуністичної інфекції, анемії, гранулоцитопенії або тромбоцитопенії. Відсутність будь-яких побічних ефектів у кількох видів тварин свідчить про те, що продукт має дуже низький профіль токсичності.
Т-клітинний імуномодулятор лімфоцитів є потужним регулятором виробництва і функції лімфоцитів CD-4.[56] Було показано, що він збільшує кількість лімфоцитів і вироблення інтерлейкіну-2 у тварин.[57] Це одноланцюговий поліпептид і сильно катіонний глікопротеїн, очищений за допомогою катіонообмінної смоли. Очищення білка з супернатантів стромальних клітин великої рогатої худоби дає істотно однорідний фактор, вільний від сторонніх матеріалів. Білок великої рогатої худоби гомологічний з іншими видами ссавців і являє собою гомогенний глікопротеїн 50 кДа з ізоелектричною точкою 6,5. Білок готують у ліофілізованій дозі 1 мкг. При розведенні в стерильному розчиннику утворюється розчин для підшкірної ін’єкції.
Існують деякі противірусні препарати, які запобігають розмноженню ВІК. Активний інгредієнт AMD3100[en] добре переносився кішками і був здатний зменшити реплікацію ВІК. Компоненти зидовудин, ставудин, PMEA[en], дидеоксицитидин, фозивудин[de], WHI-07, стампідин[en] та ламівудин запобігали реплікації вірусу in vivo та vitro, та знижували титр вірусу у хронічно інфікованих котів. Атазанавір, типранавір, лопінавір і TL-3 також були здатні пригнічувати реплікацію вірусу, зменшувати нейродегенеративні ефекти і переносилися кішками.[58]
Вакцинація
Як і у випадку з ВІЛ, розробка ефективної вакцини проти ВІК є важкою через велику кількість варіацій штамів вірусу та відмінності між ними. «Одноштамові» вакцини, тобто вакцини, які захищають лише від одного варіанту вірусу, вже продемонстрували хорошу ефективність проти гомологічних штамів ВІК. Вакцина подвійного підтипу проти ВІК, випущена в 2002 році під назвою Fel-O-Vax, дозволила імунізувати котів проти більшої кількості штамів ВІК. Вона була розроблена з використанням інактивованих ізолятів двох із п’яти підтипів ВІК: A Petaluma та D Shizuoka.[59] Було показано, що вакцина має помірний захист (82% кішок були захищені) проти підтипу A ВІК,[60] але пізніше дослідження показало, що вона не забезпечує захисту від цього ж підтипу.[61] Вакцина показала 100% ефективність проти двох різних штамів ВІК підтипу B.[62] [63] Вакцинація проти цього вірусу призведе до позитивних результатів тестів на ВІК у котів, що лише ускладнить діагностику. З цих причин вакцина вважається «неосновною», і рішення про вакцинацію має бути прийняте тільки після обговорення з ветеринаром на врахування ризиків та ефективності.[64]
Порівняння з вірусом лейкемії котів (FeLV)
ВІК та вірус лейкемії котів (FeLV) іноді помилково приймають один за одного. Хоча обидва вони належать до однієї ретровірусної підродини (orthoretrovirinae), їх класифікують у різні роди (FeLV — це гамма-ретровірус, а ВІК — це лентивірус, як ВІЛ-1). Їх форми досить різні: FeLV більш круглий, а ВІК витягнутий. Ці два віруси також генетично досить різні, а їх білкова оболонка відрізняється за розміром і складом. Хоча багато захворювань, спричинених FeLV та ВІК, подібні, конкретні способи їх виникнення насправді відрізняються. Крім того, хоча вірус лейкемії котів може викликати симптоматичне захворювання у інфікованої кішки, інфікована ВІК кішка може залишатися повністю безсимптомною протягом усього життя.
Примітки
- Lara, Valéria Maria; Taniwaki, Sueli Akemi; Araújo Júnior, João Pessoa (2008-11). Occurrence of feline immunodeficiency virus infection in cats. Ciência Rural (англ.) 38. с. 2245–2249. ISSN 0103-8478. doi:10.1590/S0103-84782008000800024. Процитовано 3 грудня 2021.
- Richards, J (2005). Feline immunodeficiency virus vaccine: Implications for diagnostic testing and disease management. Biologicals 33 (4): 215–7. PMID 16257536. doi:10.1016/j.biologicals.2005.08.004.
- American Association of Feline Practitioners (2002). Feline Immunodeficiency Virus. Cornell Feline Health Center (Cornell University, College of Veterinary Medicine). Процитовано 12 листопада 2008.
- Pedersen NC; Ho EW; Brown ML та ін. (1987). Isolation of a T-lymphotropic virus from domestic cats with an immunodeficiency-like syndrome. Science 235 (4790): 790–793. Bibcode:1987Sci...235..790P. PMID 3643650. doi:10.1126/science.3643650.
- Zislin, A (2005). Feline immunodeficiency virus vaccine: A rational paradigm for clinical decision-making. Biologicals 33 (4): 219–20. PMID 16257537. doi:10.1016/j.biologicals.2005.08.012.
- Parseval, Aymeric de; Chatterji, Udayan; Sun, Peiqing; Elder, John H. (31 серпня 2004). Feline immunodeficiency virus targets activated CD4+ T cells by using CD134 as a binding receptor. Proceedings of the National Academy of Sciences (англ.) 101 (35). с. 13044–13049. ISSN 0027-8424. PMID 15326292. doi:10.1073/pnas.0404006101. Процитовано 3 грудня 2021.
- Shimojima, Masayuki; Miyazawa, Takayuki; Ikeda, Yasuhiro; McMonagle, Elizabeth L.; Haining, Hayley; Akashi, Hiroomi; Takeuchi, Yasuhiro; Hosie, Margaret J. та ін. (20 лютого 2004). Use of CD134 as a primary receptor by the feline immunodeficiency virus. Science (New York, N.Y.) 303 (5661). с. 1192–1195. ISSN 1095-9203. PMID 14976315. doi:10.1126/science.1092124. Процитовано 3 грудня 2021.
- Hosie, M. J.; Robertson, C.; Jarrett, O. (9 вересня 1989). Prevalence of feline leukaemia virus and antibodies to feline immunodeficiency virus in cats in the United Kingdom. The Veterinary Record 125 (11). с. 293–297. ISSN 0042-4900. PMID 2554556. doi:10.1136/vr.125.11.293. Процитовано 3 грудня 2021.
- Yamamoto, J. K.; Hansen, H.; Ho, E. W.; Morishita, T. Y.; Okuda, T.; Sawa, T. R.; Nakamura, R. M.; Pedersen, N. C. (15 січня 1989). Epidemiologic and clinical aspects of feline immunodeficiency virus infection in cats from the continental United States and Canada and possible mode of transmission. Journal of the American Veterinary Medical Association 194 (2). с. 213–220. ISSN 0003-1488. PMID 2537269. Процитовано 3 грудня 2021.
- Yilmaz, H.; Ilgaz, A.; Harbour, D. A. (2000-03). Prevalence of FIV and FeLV infections in cats in Istanbul. Journal of Feline Medicine and Surgery 2 (1). с. 69–70. ISSN 1098-612X. PMID 11716594. doi:10.1053/jfms.2000.0066. Процитовано 3 грудня 2021.
- Troyer, Jennifer L.; Roelke, Melody E.; Jespersen, Jillian M.; Baggett, Natalie; Buckley-Beason, Valerie; MacNulty, Dan; Craft, Meggan; Packer, Craig та ін. (15 жовтня 2011). FIV diversity: FIV Ple subtype composition may influence disease outcome in African lions. Veterinary Immunology and Immunopathology 143 (3-4). с. 338–346. ISSN 1873-2534. PMC 3168974. PMID 21723622. doi:10.1016/j.vetimm.2011.06.013. Процитовано 3 грудня 2021.
- Carpenter, M. A.; Brown, E. W.; Culver, M.; Johnson, W. E.; Pecon-Slattery, J.; Brousset, D.; O'Brien, S. J. (1996-10). Genetic and phylogenetic divergence of feline immunodeficiency virus in the puma (Puma concolor). Journal of Virology 70 (10). с. 6682–6693. ISSN 0022-538X. PMID 8794304. doi:10.1128/JVI.70.10.6682-6693.1996. Процитовано 3 грудня 2021.
- Pecon Slattery, J.; O'Brien, S. J. (1998-03). Patterns of Y and X chromosome DNA sequence divergence during the Felidae radiation. Genetics 148 (3). с. 1245–1255. ISSN 0016-6731. PMC 1460026. PMID 9539439. doi:10.1093/genetics/148.3.1245. Процитовано 3 грудня 2021.
- Hofmann-Lehmann, R.; Fehr, D.; Grob, M.; Elgizoli, M.; Packer, C.; Martenson, J. S.; O'Brien, S. J.; Lutz, H. (1996-09). Prevalence of antibodies to feline parvovirus, calicivirus, herpesvirus, coronavirus, and immunodeficiency virus and of feline leukemia virus antigen and the interrelationship of these viral infections in free-ranging lions in east Africa. Clinical and Diagnostic Laboratory Immunology 3 (5). с. 554–562. ISSN 1071-412X. PMID 8877134. doi:10.1128/cdli.3.5.554-562.1996. Процитовано 3 грудня 2021.
- Quérat, G.; Barban, V.; Sauze, N.; Vigne, R.; Payne, A.; York, D.; De Villiers, E. M.; Verwoerd, D. W. (1987-05). Characteristics of a novel lentivirus derived from South African sheep with pulmonary adenocarcinoma (jaagsiekte). Virology 158 (1). с. 158–167. ISSN 0042-6822. PMID 2437695. doi:10.1016/0042-6822(87)90249-2. Процитовано 3 грудня 2021.
- Hirsch, V. M.; Dapolito, G.; Goeken, R.; Campbell, B. J. (1995-12). Phylogeny and natural history of the primate lentiviruses, SIV and HIV. Current Opinion in Genetics & Development 5 (6). с. 798–806. ISSN 0959-437X. PMID 8745080. doi:10.1016/0959-437x(95)80014-v. Процитовано 3 грудня 2021.
- Kakinuma, S.; Motokawa, K.; Hohdatsu, T.; Yamamoto, J. K.; Koyama, H.; Hashimoto, H. (1995-06). Nucleotide sequence of feline immunodeficiency virus: classification of Japanese isolates into two subtypes which are distinct from non-Japanese subtypes. Journal of Virology 69 (6). с. 3639–3646. ISSN 0022-538X. PMID 7745712. doi:10.1128/JVI.69.6.3639-3646.1995. Процитовано 3 грудня 2021.
- Sodora, D. L.; Shpaer, E. G.; Kitchell, B. E.; Dow, S. W.; Hoover, E. A.; Mullins, J. I. (1994-04). Identification of three feline immunodeficiency virus (FIV) env gene subtypes and comparison of the FIV and human immunodeficiency virus type 1 evolutionary patterns. Journal of Virology 68 (4). с. 2230–2238. ISSN 0022-538X. PMID 8139008. doi:10.1128/JVI.68.4.2230-2238.1994. Процитовано 3 грудня 2021.
- Carpenter, M. A.; Brown, E. W.; Culver, M.; Johnson, W. E.; Pecon-Slattery, J.; Brousset, D.; O'Brien, S. J. (1996-10). Genetic and phylogenetic divergence of feline immunodeficiency virus in the puma (Puma concolor). Journal of Virology 70 (10). с. 6682–6693. ISSN 0022-538X. PMID 8794304. doi:10.1128/JVI.70.10.6682-6693.1996. Процитовано 3 грудня 2021.
- Quérat, G.; Barban, V.; Sauze, N.; Vigne, R.; Payne, A.; York, D.; De Villiers, E. M.; Verwoerd, D. W. (1987-05). Characteristics of a novel lentivirus derived from South African sheep with pulmonary adenocarcinoma (jaagsiekte). Virology 158 (1). с. 158–167. ISSN 0042-6822. PMID 2437695. doi:10.1016/0042-6822(87)90249-2. Процитовано 3 грудня 2021.
- Hirsch, V. M.; Dapolito, G.; Goeken, R.; Campbell, B. J. (1995-12). Phylogeny and natural history of the primate lentiviruses, SIV and HIV. Current Opinion in Genetics & Development 5 (6). с. 798–806. ISSN 0959-437X. PMID 8745080. doi:10.1016/0959-437x(95)80014-v. Процитовано 3 грудня 2021.
- Barr, M. C.; Zou, L.; Long, F.; Hoose, W. A.; Avery, R. J. (3 лютого 1997). Proviral organization and sequence analysis of feline immunodeficiency virus isolated from a Pallas' cat. Virology 228 (1). с. 84–91. ISSN 0042-6822. PMID 9024812. doi:10.1006/viro.1996.8358. Процитовано 3 грудня 2021.
- Brown, E. W.; Yuhki, N.; Packer, C.; O'Brien, S. J. (1994-09). A lion lentivirus related to feline immunodeficiency virus: epidemiologic and phylogenetic aspects. Journal of Virology 68 (9). с. 5953–5968. ISSN 0022-538X. PMID 8057472. doi:10.1128/JVI.68.9.5953-5968.1994. Процитовано 3 грудня 2021.
- Lutz, H.; Isenbügel, E.; Lehmann, R.; Sabapara, R. H.; Wolfensberger, C. (1992-12). Retrovirus infections in non-domestic felids: serological studies and attempts to isolate a lentivirus. Veterinary Immunology and Immunopathology 35 (1-2). с. 215–224. ISSN 0165-2427. PMID 1337398. doi:10.1016/0165-2427(92)90133-b. Процитовано 3 грудня 2021.
- Pecon-Slattery, Jill; McCracken, Carrie L.; Troyer, Jennifer L.; VandeWoude, Sue; Roelke, Melody; Sondgeroth, Kerry; Winterbach, Christiaan; Winterbach, Hanlie та ін. (5 лютого 2008). Genomic organization, sequence divergence, and recombination of feline immunodeficiency virus from lions in the wild. BMC genomics 9. с. 66. ISSN 1471-2164. PMC 2270836. PMID 18251995. doi:10.1186/1471-2164-9-66. Процитовано 3 грудня 2021.
- Biek, Roman; Drummond, Alexei J.; Poss, Mary (27 січня 2006). A virus reveals population structure and recent demographic history of its carnivore host. Science (New York, N.Y.) 311 (5760). с. 538–541. ISSN 1095-9203. PMID 16439664. doi:10.1126/science.1121360. Процитовано 3 грудня 2021.
- Olmsted, R. A.; Hirsch, V. M.; Purcell, R. H.; Johnson, P. R. (1989-10). Nucleotide sequence analysis of feline immunodeficiency virus: genome organization and relationship to other lentiviruses. Proceedings of the National Academy of Sciences of the United States of America 86 (20). с. 8088–8092. ISSN 0027-8424. PMID 2813380. doi:10.1073/pnas.86.20.8088. Процитовано 3 грудня 2021.
- Carpenter, M. A.; Brown, E. W.; MacDonald, D. W.; O'brien, S. J. (25 листопада 1998). Phylogeographic patterns of feline immunodeficiency virus genetic diversity in the domestic cat. Virology 251 (2). с. 234–243. ISSN 0042-6822. PMID 9837787. doi:10.1006/viro.1998.9402. Процитовано 3 грудня 2021.
- Fromont, E.; Sager, A.; Léger, F.; Bourguemestre, F.; Jouquelet, E.; Stahl, P.; Pontier, D.; Artois, M. (11 березня 2000). Prevalence and pathogenicity of retroviruses in wildcats in France. The Veterinary Record 146 (11). с. 317–319. ISSN 0042-4900. PMID 10766116. doi:10.1136/vr.146.11.317. Процитовано 3 грудня 2021.
- Troyer, Jennifer L.; Pecon-Slattery, Jill; Roelke, Melody E.; Johnson, Warren; VandeWoude, Sue; Vazquez-Salat, Nuria; Brown, Meredith; Frank, Laurence та ін. (2005-07). Seroprevalence and genomic divergence of circulating strains of feline immunodeficiency virus among Felidae and Hyaenidae species. Journal of Virology 79 (13). с. 8282–8294. ISSN 0022-538X. PMC 1143723. PMID 15956574. doi:10.1128/JVI.79.13.8282-8294.2005. Процитовано 3 грудня 2021.
- Katzourakis, Aris; Tristem, Michael; Pybus, Oliver G.; Gifford, Robert J. (10 квітня 2007). Discovery and analysis of the first endogenous lentivirus. Proceedings of the National Academy of Sciences of the United States of America 104 (15). с. 6261–6265. ISSN 0027-8424. PMC 1851024. PMID 17384150. doi:10.1073/pnas.0700471104. Процитовано 4 грудня 2021.
- Hu, Qiong-Ying; Fink, Elizabeth; Elder, John H. (11 липня 2012). Mapping of Receptor Binding Interactions with the FIV surface Glycoprotein (SU); Implications Regarding Immune surveillance and cellular Targets of Infection. Retrovirology: Research and Treatment 2012 (4). с. 1–11. ISSN 1178-1238. PMC 3523734. PMID 23255871. doi:10.4137/RRT.S9429. Процитовано 4 грудня 2021.
- Lecollinet, Sylvie; Richardson, Jennifer (2008-03). Vaccination against the feline immunodeficiency virus: the road not taken. Comparative Immunology, Microbiology and Infectious Diseases 31 (2-3). с. 167–190. ISSN 0147-9571. PMID 17706778. doi:10.1016/j.cimid.2007.07.007. Процитовано 4 грудня 2021.
- Hartmann, Katrin (15 жовтня 2011). Clinical aspects of feline immunodeficiency and feline leukemia virus infection. Veterinary Immunology and Immunopathology 143 (3-4). с. 190–201. ISSN 1873-2534. PMC 7132395. PMID 21807418. doi:10.1016/j.vetimm.2011.06.003. Процитовано 4 грудня 2021.
- Pecon Slattery, J.; O'Brien, S. J. (1998-03). Patterns of Y and X chromosome DNA sequence divergence during the Felidae radiation. Genetics 148 (3). с. 1245–1255. ISSN 0016-6731. PMC 1460026. PMID 9539439. doi:10.1093/genetics/148.3.1245. Процитовано 4 грудня 2021.
- Pecon-Slattery, Jill; McCracken, Carrie L.; Troyer, Jennifer L.; VandeWoude, Sue; Roelke, Melody; Sondgeroth, Kerry; Winterbach, Christiaan; Winterbach, Hanlie та ін. (5 лютого 2008). Genomic organization, sequence divergence, and recombination of feline immunodeficiency virus from lions in the wild. BMC genomics 9. с. 66. ISSN 1471-2164. PMC 2270836. PMID 18251995. doi:10.1186/1471-2164-9-66. Процитовано 4 грудня 2021.
- Talbott, R. L.; Sparger, E. E.; Lovelace, K. M.; Fitch, W. M.; Pedersen, N. C.; Luciw, P. A.; Elder, J. H. (1989-08). Nucleotide sequence and genomic organization of feline immunodeficiency virus. Proceedings of the National Academy of Sciences of the United States of America 86 (15). с. 5743–5747. ISSN 0027-8424. PMID 2762293. doi:10.1073/pnas.86.15.5743. Процитовано 4 грудня 2021.
- Carpenter, M. A.; Brown, E. W.; MacDonald, D. W.; O'brien, S. J. (25 листопада 1998). Phylogeographic patterns of feline immunodeficiency virus genetic diversity in the domestic cat. Virology 251 (2). с. 234–243. ISSN 0042-6822. PMID 9837787. doi:10.1006/viro.1998.9402. Процитовано 4 грудня 2021.
- Poeschla, E. M.; Wong-Staal, F.; Looney, D. J. (1998-03). Efficient transduction of nondividing human cells by feline immunodeficiency virus lentiviral vectors. Nature Medicine 4 (3). с. 354–357. ISSN 1078-8956. PMID 9500613. doi:10.1038/nm0398-354. Процитовано 4 грудня 2021.
- Harper, Scott Q.; Staber, Patrick D.; Beck, Christine R.; Fineberg, Sarah K.; Stein, Colleen; Ochoa, Dalyz; Davidson, Beverly L. (2006-10). Optimization of feline immunodeficiency virus vectors for RNA interference. Journal of Virology 80 (19). с. 9371–9380. ISSN 0022-538X. PMC 1617215. PMID 16973543. doi:10.1128/JVI.00958-06. Процитовано 4 грудня 2021.
- Valori, Chiara F.; Ning, Ke; Wyles, Matthew; Azzouz, Mimoun (2008-12). Development and applications of non-HIV-based lentiviral vectors in neurological disorders. Current Gene Therapy 8 (6). с. 406–418. ISSN 1566-5232. PMID 19075624. doi:10.2174/156652308786848030. Процитовано 4 грудня 2021.
- Yamamoto, Janet K.; Sanou, Missa P.; Abbott, Jeffrey R.; Coleman, James K. (2010-01). Feline immunodeficiency virus model for designing HIV/AIDS vaccines. Current HIV research 8 (1). с. 14–25. ISSN 1873-4251. PMC 3721975. PMID 20210778. doi:10.2174/157016210790416361. Процитовано 4 грудня 2021.
- Burkhard, Mary Jo; Dean, Gregg A. (2003-01). Transmission and immunopathogenesis of FIV in cats as a model for HIV. Current HIV research 1 (1). с. 15–29. ISSN 1570-162X. PMID 15043209. doi:10.2174/1570162033352101. Процитовано 4 грудня 2021.
- Bishop, Sarah A.; Stokes, Christopher R.; Gruffydd-Jones, Timothy J.; Whiting, Christine V.; Harbour, David A. (1996-08). Vaginal and rectal infection of cats with feline immunodeficiency virus. Veterinary Microbiology 51 (3-4). с. 217–227. ISSN 0378-1135. doi:10.1016/0378-1135(96)00038-7. Процитовано 4 грудня 2021.
- Yamamoto, J. K.; Sparger, E.; Ho, E. W.; Andersen, P. R.; O'Connor, T. P.; Mandell, C. P.; Lowenstine, L.; Munn, R. та ін. (1988-08). Pathogenesis of experimentally induced feline immunodeficiency virus infection in cats. American Journal of Veterinary Research 49 (8). с. 1246–1258. ISSN 0002-9645. PMID 2459996. Процитовано 4 грудня 2021.
- Medeiros, Sheila de Oliveira; Martins, Angelica Nascimento; Dias, Carlos Gabriel Almeida; Tanuri, Amilcar; Brindeiro, Rodrigo de Moraes (25 травня 2012). Natural transmission of feline immunodeficiency virus from infected queen to kitten. Virology Journal 9. с. 99. ISSN 1743-422X. PMC 3439265. PMID 22632459. doi:10.1186/1743-422X-9-99. Процитовано 4 грудня 2021.
- Sellon, R K; Jordan, H L; Kennedy-Stoskopf, S; Tompkins, M B; Tompkins, W A (1994-05). Feline immunodeficiency virus can be experimentally transmitted via milk during acute maternal infection.. Journal of Virology 68 (5). с. 3380–3385. ISSN 0022-538X. PMID 8151797. Процитовано 4 грудня 2021.
- Ueland, K.; Nesse, L. L. (1992-09). No evidence of vertical transmission of naturally acquired feline immunodeficiency virus infection. Veterinary Immunology and Immunopathology 33 (4). с. 301–308. ISSN 0165-2427. PMID 1332250. doi:10.1016/0165-2427(92)90002-8. Процитовано 4 грудня 2021.
- O'Neil, L. L.; Burkhard, M. J.; Hoover, E. A. (1996-05). Frequent perinatal transmission of feline immunodeficiency virus by chronically infected cats. Journal of Virology 70 (5). с. 2894–2901. ISSN 0022-538X. PMID 8627764. doi:10.1128/JVI.70.5.2894-2901.1996. Процитовано 4 грудня 2021.
- Litster, Annette L. (2014-08). Transmission of feline immunodeficiency virus (FIV) among cohabiting cats in two cat rescue shelters. Veterinary Journal (London, England: 1997) 201 (2). с. 184–188. ISSN 1532-2971. PMID 24698667. doi:10.1016/j.tvjl.2014.02.030. Процитовано 4 грудня 2021.
- Troyer, Jennifer L.; VandeWoude, Sue; Pecon-Slattery, Jill; McIntosh, Carl; Franklin, Sam; Antunes, Agostinho; Johnson, Warren; O’Brien, Stephen J. (15 травня 2008). FIV cross-species transmission: An evolutionary prospective. Veterinary Immunology and Immunopathology 123 (1). с. 159–166. ISSN 0165-2427. PMC 2442884. PMID 18299153. doi:10.1016/j.vetimm.2008.01.023. Процитовано 4 грудня 2021.
- Yamamoto, J. K.; Sparger, E.; Ho, E. W.; Andersen, P. R.; O'Connor, T. P.; Mandell, C. P.; Lowenstine, L.; Munn, R. та ін. (1988-08). Pathogenesis of experimentally induced feline immunodeficiency virus infection in cats. American Journal of Veterinary Research 49 (8). с. 1246–1258. ISSN 0002-9645. PMID 2459996. Процитовано 4 грудня 2021.
- Hartmann, Katrin (2012-11). Clinical Aspects of Feline Retroviruses: A Review. Viruses (англ.) 4 (11). с. 2684–2710. doi:10.3390/v4112684. Процитовано 4 грудня 2021.
- Hosie, Margaret J.; Addie, Diane; Belák, Sándor; Boucraut-Baralon, Corine; Egberink, Herman; Frymus, Tadeusz; Gruffydd-Jones, Tim; Hartmann, Katrin та ін. (2009-07). Feline immunodeficiency. ABCD guidelines on prevention and management. Journal of Feline Medicine and Surgery 11 (7). с. 575–584. ISSN 1098-612X. PMC 7129779. PMID 19481037. doi:10.1016/j.jfms.2009.05.006. Процитовано 4 грудня 2021.
- LTCI | Feline Leukemia FeLV and Feline Immunodeficiency Virus and Canine Osteoarthritis | USDA Approved. T-cyte. Процитовано 4 грудня 2021.
- Beardsley, et al. "Induction of T-Cell Maturation by a Cloned Line of Thymic Epithelium (TEPI) Immunology 80: pp. 6005-6009, (Oct. 1983). - Пошук Google. www.google.com. Процитовано 4 грудня 2021.
- , Beardsley, Terry R., "Immune-enhancing agent for therapeutic use in immunocompromised hosts"
- Mohammadi, Hakimeh; Bienzle, Dorothee (2012-05). Pharmacological Inhibition of Feline Immunodeficiency Virus (FIV). Viruses (англ.) 4 (5). с. 708–724. doi:10.3390/v4050708. Процитовано 4 грудня 2021.
- Levy, Julie; Crawford, Cynda; Hartmann, Katrin; Hofmann-Lehmann, Regina; Little, Susan; Sundahl, Eliza; Thayer, Vicki (2008-07). 2008 American Association of Feline Practitioners' feline retrovirus management guidelines. Journal of Feline Medicine and Surgery 10 (3). с. 300–316. ISSN 1098-612X. PMID 18455463. doi:10.1016/j.jfms.2008.03.002. Процитовано 4 грудня 2021.
- Huang, Chengjin; Conlee, Douglas; Loop, Jennifer; Champ, Deborah; Gill, Mike; Chu, Hsien-Jue Steve (2004-12). Efficacy and safety of a feline immunodeficiency virus vaccine. Animal Health Research Reviews 5 (2). с. 295–300. ISSN 1466-2523. PMID 15984343. doi:10.1079/ahr200487. Процитовано 4 грудня 2021.
- Dunham, S. P.; Bruce, J.; MacKay, S.; Golder, M.; Jarrett, O.; Neil, J. C. (22 квітня 2006). Limited efficacy of an inactivated feline immunodeficiency virus vaccine. The Veterinary Record 158 (16). с. 561–562. ISSN 0042-4900. PMID 16632531. doi:10.1136/vr.158.16.561. Процитовано 4 грудня 2021.
- Kusuhara, Hajime; Hohdatsu, Tsutomu; Okumura, Mayuko; Sato, Kayoko; Suzuki, Yumi; Motokawa, Kenji; Gemma, Tsuyoshi; Watanabe, Rie та ін. (1 липня 2005). Dual-subtype vaccine (Fel-O-Vax FIV) protects cats against contact challenge with heterologous subtype B FIV infected cats. Veterinary Microbiology 108 (3-4). с. 155–165. ISSN 0378-1135. PMID 15899558. doi:10.1016/j.vetmic.2005.02.014. Процитовано 4 грудня 2021.
- Pu, Ruiyu; Coleman, James; Coisman, James; Sato, Eiji; Tanabe, Taishi; Arai, Maki; Yamamoto, Janet K. (2005-02). Dual-subtype FIV vaccine (Fel-O-Vax FIV) protection against a heterologous subtype B FIV isolate. Journal of Feline Medicine and Surgery 7 (1). с. 65–70. ISSN 1098-612X. PMID 15686976. doi:10.1016/j.jfms.2004.08.005. Процитовано 4 грудня 2021.
- Levy, Julie; Crawford, Cynda; Hartmann, Katrin; Hofmann-Lehmann, Regina; Little, Susan; Sundahl, Eliza; Thayer, Vicki (2008-07). 2008 American Association of Feline Practitioners' feline retrovirus management guidelines. Journal of Feline Medicine and Surgery 10 (3). с. 300–316. ISSN 1098-612X. PMID 18455463. doi:10.1016/j.jfms.2008.03.002. Процитовано 4 грудня 2021.