Протеїн-тирозин-фосфатаза нерецепторного типу 1
Протеїн-тирозин-фосфатаза нерецепторного типу 1 (англ. Protein tyrosine phosphatase, non-receptor type 1) також відома як протеїн-тирозин-фосфатаза 1B (PTP1B) – білок, який кодується геном PTPN1, розташованим у людей на довгому плечі 20-ї хромосоми.[3][4] Довжина поліпептидного ланцюга білка становить 435 амінокислот, а молекулярна маса — 49 967[5]. Фермент, який є першим відкритим членом родини протеїн-тирозин-фосфатаз (PTP). PTP1B є негативним регулятором сигнального шляху інсуліну і вважається перспективною потенційною терапевтичною мішеню, зокрема, для лікування цукрового діабету 2 типу[6]. Вона також бере участь у розвитку раку молочної залози і досліджувалася як потенційна терапевтична мішень в цьому виді раку[7][8][9].
Цей білок за функціями належить до протеїнфосфатаз, фосфопротеїнів. Задіяний у такому біологічному процесі, як ацетилювання. Локалізований у мембрані, ендоплазматичному ретикулумі.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MEMEKEFEQI | DKSGSWAAIY | QDIRHEASDF | PCRVAKLPKN | KNRNRYRDVS | ||||
| PFDHSRIKLH | QEDNDYINAS | LIKMEEAQRS | YILTQGPLPN | TCGHFWEMVW | ||||
| EQKSRGVVML | NRVMEKGSLK | CAQYWPQKEE | KEMIFEDTNL | KLTLISEDIK | ||||
| SYYTVRQLEL | ENLTTQETRE | ILHFHYTTWP | DFGVPESPAS | FLNFLFKVRE | ||||
| SGSLSPEHGP | VVVHCSAGIG | RSGTFCLADT | CLLLMDKRKD | PSSVDIKKVL | ||||
| LEMRKFRMGL | IQTADQLRFS | YLAVIEGAKF | IMGDSSVQDQ | WKELSHEDLE | ||||
| PPPEHIPPPP | RPPKRILEPH | NGKCREFFPN | HQWVKEETQE | DKDCPIKEEK | ||||
| GSPLNAAPYG | IESMSQDTEV | RSRVVGGSLR | GAQAASPAKG | EPSLPEKDED | ||||
| HALSYWKPFL | VNMCVATVLT | AGAYLCYRFL | FNSNT |
Структура і функції
PTP1B була вперше виділена з плацентарного екстракту білка організму людини[10][11], але він експресується в багатьох тканинах[12]. PTP1B локалізована на цитоплазматичній поверхні ЕПР[13]. PTP1B може дефосфорилювати фосфотирозинові залишки активованої кінази рецептора інсуліну[11][14][15]. У мишей, генетичне усунення PTPN1 проявляється в підвищеній чутливості до інсуліну[16][17]. Кілька інших тирозинкіназ, включаючи рецептор епідермального фактора росту[18], рецептор інсуліноподібного фактору росту 1 типу[19], рецептор колонієстимулюючого фактору 1 типу[20], C-Src[21], JAK2[22], TYK2[22], і кіназа фокальної адгезії[23], а також інші тирозин-фосфорилюючі білки, в тому числі BCAR1[24], DOK1[25], β-катенін[26] та кортактин[27] також були описані як субстрати PTP1B.
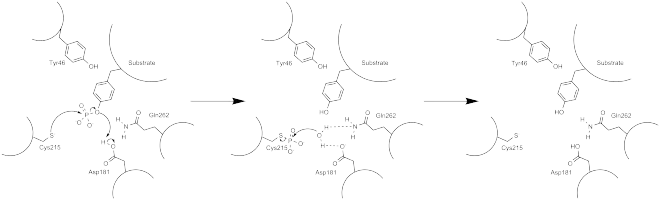
Перша кристалічна структура каталітичного домену PTP1B показала, що каталітичний сайт розташований в глибокій ущелині білка, утворену трьома петлями, включаючи петлю WPD із залишком Asp181, петлю pTyr із залишком Tyr46 і петлею Q із залишком Gln262[28][29]. Петля pTyr і залишок Tyr46 розташовані на поверхні білка і, таким чином, допомагають детерміновати глибину субстрату, яку можна розмістити в щілині. Це механізм керування селективністю, субстрати, що містять більш дрібні фосфозалишки не можуть досягти ділянки каталітичної активності біля основи ущелини[28]. Після зв'язування субстрату, PTP1B зазнає структурних змін, при яких петля WPD закривається навколо субстрату, введення стабілізуючої pi стекінг-взаємодії між ароматичними кільцями залишку фосфотирозину (pTyr) субстрату і залишку Phe182 на петлі WPD[29].
Механізм
Фосфатазна активність PTP1B відбувається за двоступеневим механізмом[28]. Дефосфорилювання субстрату pTyr відбувається на першій стадії, в той час як проміжні продукти ферменту розщеплюються на другій стадії. На першому етапі, здійснюється нуклеофільна атака на фосфоцентр відновленого Cys215 залишку, з подальшим подальшим протонуванням по Asp181 з отриманням нейтрального тирозинового фенолу. Активний фермент відновлюється після гідролізу тіофосфатного проміжного продукту, який полегшується за допомогою водневих зв'язків Gln262 і Asp181, які допомагають позиціонувати в молекулі води потрібний сайт нуклеофільної атаки.
Регулювання
Залишок Cys215 має важливе значення для ферментативної активності PTP1B і аналогічні залишки цистеїну, необхідні для діяльності інших членів класу I PTP родини[30]. Тіолат-аніонна форма необхідна для нуклеофільної активності, але вона сприйнятлива до окиснення активних форм кисню (ROS) в клітині, що може зробити фермент нефункціональним. Цей залишок цистеїну, як було показано, окислюється при підвищеній клітинній концентрації перекису водню (H2O2), що продукується у відповідь на стимулювання епідермальним фактором росту та інсуліном[31][32][33]. Тіолат окислюється до сульфенової кислоти, яка перетворюється в сульфаніламід після реакції з сусіднім залишком Ser216[34]. Ця модифікація залишку Cys215 запобігає його подальшому окисленню, що буде незворотним, а також індукує структурні зміни в щілині активної ділянки таким чином, що субстрати не зможуть зв'язуватися[34][35]. Це окислення може бути скасовано шляхом відновлення глутатіоном і є одним із способів регулювання активності PTP1B[35]. Фосфорилювання залишку Ser50 також є способом алостеричного регулювання PTP1B, а саме фосфорильований стан ферменту є неактивним[36].
Взаємодії
Для PTPN1 було показано взаємодію з BCAR1[24], рецептора епідермального фактора росту[37][38], Grb2[24][39] і IRS1[36][39].
Клінічне значення
PTP1B має клінічне значення в лікуванні цукрового діабету 2 типу, а також раку. Дослідження проведені на мишачих моделях з нокаутом гена виявили докази важливої ролі PTP1B в регуляції передачі сигналів інсуліну і розвитку ожиріння[16][17]. Миші, нокаутні за геном PTPN1, яких тримали на дієти з високим вмістом жирів показували стійкість до ожиріння і підвищений рівень чутливості до інсуліну в порівнянні з мишами дикого типу[16][17]. Таким чином, конструювання і розробка інгібіторів PTP1B є галуззю досліджень для лікування цукрового діабету 2 типу та ожиріння, що стрімко розвивається[40].
Хоча PTP1B, як правило, вивчається як регулятор обміну речовин, деякі дослідження припускають, що вона може грати певну роль в розвитку пухлини, хоча чи є вона онкогенною або онкосупресорною невідомо, оскільки є дані на підтримку обох версій. Високі концентрації АФК всередині ракових клітин, забезпечують умови для потенційної конститутивної інактивації PTP1B і це було показано на двох лініях ракових клітин людини HepG2 і А431, що до залишків Cys215 в PTP1B, то вони можуть селективно необоротно окислюватися в цих клітинних умовах, наслідком чого є втрата функціональності PTP1B[41]. Крім того, генетична абляція PTPN1 в р53 дефіцитних мишей призвела до збільшення числа випадків лімфом і зниженням загального виживання[42]. На противагу цьому було показано, що ген PTPN1 надлишково експресується в поєднанні з HER2 у випадках раку молочної залози[8]. В мишачих модельних об'єктах з надекспресією HER2 в поєднанні з нокаутом PTPN1 було виявлено затримку росту пухлини і меншу кількість спостережуваних метастазів в легені припускаючи, що PTPN1 може мати онкогенну роль при раку молочної залози[8][9].
Див. також
Примітки
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:9642 (англ.). Процитовано 12 лютого 2018.
- Brown-Shimer S, Johnson KA, Lawrence JB, Johnson C, Bruskin A, Green NR, Hill DE (Aug 1990). Molecular cloning and chromosome mapping of the human gene encoding protein phosphotyrosyl phosphatase 1B. Proc Natl Acad Sci USA 87 (13): 5148–52. Bibcode:1990PNAS...87.5148B. PMC 54279. PMID 2164224. doi:10.1073/pnas.87.13.5148.
- UniProt, P18031 (англ.). Процитовано 12 лютого 2018.
- Combs AP (March 2010). Recent advances in the discovery of competitive protein tyrosine phosphatase 1B inhibitors for the treatment of diabetes, obesity, and cancer. J. Med. Chem. 53 (6): 2333–44. PMID 20000419. doi:10.1021/jm901090b.
- Lessard L, Stuible M, Tremblay ML (2010). The two faces of PTP1B in cancer. Biochim. Biophys. Acta 1804 (3): 613–9. PMID 19782770. doi:10.1016/j.bbapap.2009.09.018.
- Bentires-Alj M, Neel BG (2007). Protein-tyrosine phosphatase 1B is required for HER2/Neu-induced breast cancer. Cancer Res. 67 (6): 2420–4. PMID 17347513. doi:10.1158/0008-5472.CAN-06-4610.
- Julien SG, Dubé N, Read M, Penney J, Paquet M, Han Y, Kennedy BP, Muller WJ, Tremblay ML (2007). Protein tyrosine phosphatase 1B deficiency or inhibition delays ErbB2-induced mammary tumorigenesis and protects from lung metastasis. Nat. Genet. 39 (3): 338–46. PMID 17259984. doi:10.1038/ng1963.
- Tonks NK, Diltz CD, Fischer EH (May 1988). Purification of the major protein-tyrosine-phosphatases of human placenta. J. Biol. Chem. 263 (14): 6722–30. PMID 2834386.
- Tonks NK, Diltz CD, Fischer EH (May 1988). Characterization of the major protein-tyrosine-phosphatases of human placenta. J. Biol. Chem. 263 (14): 6731–7. PMID 2834387.
- Chernoff J, Schievella AR, Jost CA, Erikson RL, Neel BG (April 1990). Cloning of a cDNA for a major human protein-tyrosine-phosphatase. Proc. Natl. Acad. Sci. U.S.A. 87 (7): 2735–9. Bibcode:1990PNAS...87.2735C. PMC 53765. PMID 2157211. doi:10.1073/pnas.87.7.2735.
- Frangioni JV, Beahm PH, Shifrin V, Jost CA, Neel BG (February 1992). The nontransmembrane tyrosine phosphatase PTP-1B localizes to the endoplasmic reticulum via its 35 amino acid C-terminal sequence. Cell 68 (3): 545–60. PMID 1739967. doi:10.1016/0092-8674(92)90190-N.
- Cicirelli MF, Tonks NK, Diltz CD, Weiel JE, Fischer EH, Krebs EG (July 1990). Microinjection of a protein-tyrosine-phosphatase inhibits insulin action in Xenopus oocytes. Proc. Natl. Acad. Sci. U.S.A. 87 (14): 5514–8. Bibcode:1990PNAS...87.5514C. PMC 54355. PMID 2164686. doi:10.1073/pnas.87.14.5514.
- Seely BL, Staubs PA, Reichart DR, Berhanu P, Milarski KL, Saltiel AR, Kusari J, Olefsky JM (October 1996). Protein tyrosine phosphatase 1B interacts with the activated insulin receptor. Diabetes 45 (10): 1379–85. PMID 8826975. doi:10.2337/diabetes.45.10.1379.
- Elchebly M, Payette P, Michaliszyn E, Cromlish W, Collins S, Loy AL, Normandin D, Cheng A, Himms-Hagen J, Chan CC, Ramachandran C, Gresser MJ, Tremblay ML, Kennedy BP (March 1999). Increased insulin sensitivity and obesity resistance in mice lacking the protein tyrosine phosphatase-1B gene. Science 283 (5407): 1544–8. Bibcode:1999Sci...283.1544E. PMID 10066179. doi:10.1126/science.283.5407.1544.
- Klaman LD, Boss O, Peroni OD, Kim JK, Martino JL, Zabolotny JM, Moghal N, Lubkin M, Kim YB, Sharpe AH, Stricker-Krongrad A, Shulman GI, Neel BG, Kahn BB (August 2000). Increased Energy Expenditure, Decreased Adiposity, and Tissue-Specific Insulin Sensitivity in Protein-Tyrosine Phosphatase 1B-Deficient Mice. Mol. Cell. Biol. 20 (15): 5479–89. PMC 85999. PMID 10891488. doi:10.1128/MCB.20.15.5479-5489.2000.
- Flint AJ, Tiganis T, Barford D, Tonks NK (March 1997). Development of "substrate-trapping" mutants to identify physiological substrates of protein tyrosine phosphatases. Proc. Natl. Acad. Sci. U.S.A. 94 (5): 1680–5. Bibcode:1997PNAS...94.1680F. PMC 19976. PMID 9050838. doi:10.1073/pnas.94.5.1680.
- Buckley DA, Cheng A, Kiely PA, Tremblay ML, O'Connor R (April 2002). Regulation of Insulin-Like Growth Factor Type I (IGF-I) Receptor Kinase Activity by Protein Tyrosine Phosphatase 1B (PTP-1B) and Enhanced IGF-I-Mediated Suppression of Apoptosis and Motility in PTP-1B-Deficient Fibroblasts. Mol. Cell. Biol. 22 (7): 1998–2010. PMC 133665. PMID 11884589. doi:10.1128/MCB.22.7.1998-2010.2002.
- Heinonen KM, Dubé N, Bourdeau A, Lapp WS, Tremblay ML (February 2006). Protein tyrosine phosphatase 1B negatively regulates macrophage development through CSF-1 signaling. Proc. Natl. Acad. Sci. U.S.A. 103 (8): 2776–81. Bibcode:2006PNAS..103.2776H. PMC 1413784. PMID 16477024. doi:10.1073/pnas.0508563103.
- Zhu S, Bjorge JD, Fujita DJ (November 2007). PTP1B contributes to the oncogenic properties of colon cancer cells through Src activation. Cancer Res. 67 (21): 10129–37. PMID 17974954. doi:10.1158/0008-5472.CAN-06-4338.
- Myers MP, Andersen JN, Cheng A, Tremblay ML, Horvath CM, Parisien JP, Salmeen A, Barford D, Tonks NK (December 2001). TYK2 and JAK2 are substrates of protein-tyrosine phosphatase 1B. J. Biol. Chem. 276 (51): 47771–4. PMID 11694501. doi:10.1074/jbc.C100583200. Проігноровано невідомий параметр
|doi-broken-date=(довідка) - Zhang Z, Lin SY, Neel BG, Haimovich B (January 2006). Phosphorylated alpha-actinin and protein-tyrosine phosphatase 1B coregulate the disassembly of the focal adhesion kinase x Src complex and promote cell migration. J. Biol. Chem. 281 (3): 1746–54. PMID 16291744. doi:10.1074/jbc.M509590200.
- Liu F, Hill DE, Chernoff J (December 1996). Direct binding of the proline-rich region of protein tyrosine phosphatase 1B to the Src homology 3 domain of p130(Cas). J. Biol. Chem. 271 (49): 31290–5. PMID 8940134. doi:10.1074/jbc.271.49.31290.
- Dubé N, Cheng A, Tremblay ML (February 2004). The role of protein tyrosine phosphatase 1B in Ras signaling. Proc. Natl. Acad. Sci. U.S.A. 101 (7): 1834–9. Bibcode:2004PNAS..101.1834D. PMC 357013. PMID 14766979. doi:10.1073/pnas.0304242101.
- Balsamo J, Arregui C, Leung T, Lilien J (October 1998). The Nonreceptor Protein Tyrosine Phosphatase PTP1B Binds to the Cytoplasmic Domain of N-Cadherin and Regulates the Cadherin–Actin Linkage. J. Cell Biol. 143 (2): 523–32. PMC 2132848. PMID 9786960. doi:10.1083/jcb.143.2.523.
- Stuible M, Dubé N, Tremblay ML (June 2008). PTP1B regulates cortactin tyrosine phosphorylation by targeting Tyr446. J. Biol. Chem. 283 (23): 15740–6. PMC 3259645. PMID 18387954. doi:10.1074/jbc.M710534200.
- Tonks NK (Jul 3, 2003). PTP1B: from the sidelines to the front lines!. FEBS Letters 546 (1): 140–8. PMID 12829250. doi:10.1016/s0014-5793(03)00603-3.
- Barford D, Flint AJ, Tonks NK (March 1994). Crystal structure of human protein tyrosine phosphatase 1B. Science 263 (5152): 1397–404. Bibcode:1994Sci...263.1397B. PMID 8128219. doi:10.1126/science.8128219.
- Alonso A, Sasin J, Bottini N, Friedberg I, Friedberg I, Osterman A, Godzik A, Hunter T, Dixon J, Mustelin T (2004). Protein tyrosine phosphatases in the human genome.. Cell 117 (6): 699–711. PMID 15186772. doi:10.1016/j.cell.2004.05.018.
- Mahadev K, Zilbering A, Zhu L, Goldstein BJ (2001). Insulin-stimulated hydrogen peroxide reversibly inhibits protein-tyrosine phosphatase 1b in vivo and enhances the early insulin action cascade. J. Biol. Chem. 276 (24): 21938–42. PMID 11297536. doi:10.1074/jbc.C100109200.
- Lee SR, Kwon KS, Kim SR, Rhee SG (June 1998). Reversible inactivation of protein-tyrosine phosphatase 1B in A431 cells stimulated with epidermal growth factor. J. Biol. Chem. 273 (25): 15366–72. PMID 9624118. doi:10.1074/jbc.273.25.15366.
- Sundaresan M, Yu ZX, Ferrans VJ, Irani K, Finkel T (October 1995). Requirement for generation of H2O2 for platelet-derived growth factor signal transduction. Science 270 (5234): 296–9. Bibcode:1995Sci...270..296S. PMID 7569979. doi:10.1126/science.270.5234.296.
- Salmeen A, Andersen JN, Myers MP, Meng TC, Hinks JA, Tonks NK, Barford D (2003). Redox regulation of protein tyrosine phosphatase 1B involves a sulphenyl-amide intermediate. Nature 423 (6941): 769–73. Bibcode:2003Natur.423..769S. PMID 12802338. doi:10.1038/nature01680.
- van Montfort RL, Congreve M, Tisi D, Carr R, Jhoti H (2003). Oxidation state of the active-site cysteine in protein tyrosine phosphatase 1B. Nature 423 (6941): 773–7. Bibcode:2003Natur.423..773V. PMID 12802339. doi:10.1038/nature01681.
- Ravichandran LV, Chen H, Li Y, Quon MJ (October 2001). Phosphorylation of PTP1B at Ser(50) by Akt impairs its ability to dephosphorylate the insulin receptor. Mol. Endocrinol. 15 (10): 1768–80. PMID 11579209. doi:10.1210/mend.15.10.0711.
- Sarmiento M, Puius YA, Vetter SW, Keng YF, Wu L, Zhao Y, Lawrence DS, Almo SC, Zhang ZY (July 2000). Structural basis of plasticity in protein tyrosine phosphatase 1B substrate recognition. Biochemistry 39 (28): 8171–9. PMID 10889023. doi:10.1021/bi000319w.
- Zhang ZY, Walsh AB, Wu L, McNamara DJ, Dobrusin EM, Miller WT (March 1996). Determinants of substrate recognition in the protein-tyrosine phosphatase, PTP1. J. Biol. Chem. 271 (10): 5386–92. PMID 8621392. doi:10.1074/jbc.271.10.5386.
- Goldstein BJ, Bittner-Kowalczyk A, White MF, Harbeck M (February 2000). Tyrosine dephosphorylation and deactivation of insulin receptor substrate-1 by protein-tyrosine phosphatase 1B. Possible facilitation by the formation of a ternary complex with the Grb2 adaptor protein. J. Biol. Chem. 275 (6): 4283–9. PMID 10660596. doi:10.1074/jbc.275.6.4283.
- Thareja S, Aggarwal S, Bhardwaj TR, Kumar M (2012). Protein tyrosine phosphatase 1B inhibitors: a molecular level legitimate approach for the management of diabetes mellitus. Med Res Rev 32 (3): 459–517. PMID 20814956. doi:10.1002/med.20219.
- Tonks NK (2013). Protein tyrosine pho sphatases — from housekeeping enzymes to master regulators of signal transduction. FEBS J. 280 (2): 346–78. PMC 3662559. PMID 23176256. doi:10.1111/febs.12077.
- Dubé N, Bourdeau A, Heinonen KM, Cheng A, Loy AL, Tremblay ML (2005). Genetic ablation of protein tyrosine phosphatase 1B accelerates lymphomagenesis of p53-null mice through the regulation of B-cell development. Cancer Res. 65 (21): 10088–95. PMID 16267035. doi:10.1158/0008-5472.CAN-05-1353.
Література
- Chernoff J., Schievella A.R., Jost C.A., Erikson R.L., Neel B.G. (1990). Cloning of a cDNA for a major human protein-tyrosine-phosphatase.. Proc. Natl. Acad. Sci. U.S.A. 87: 2735 — 2739. PubMed DOI:10.1073/pnas.87.7.2735
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Frangioni J.V., Beahm P.H., Shifrin V., Jost C.A., Neel B.G. (1992). The nontransmembrane tyrosine phosphatase PTP-1B localizes to the endoplasmic reticulum via its 35 amino acid C-terminal sequence.. Cell 68: 545 — 560. PubMed DOI:10.1016/0092-8674(92)90190-N
- Liu F., Chernoff J. (1997). Protein tyrosine phosphatase 1B interacts with and is tyrosine phosphorylated by the epidermal growth factor receptor.. Biochem. J. 327: 139 — 145. PubMed DOI:10.1042/bj3270139
- Moeslein F.M., Myers M.P., Landreth G.E. (1999). The CLK family kinases, CLK1 and CLK2, phosphorylate and activate the tyrosine phosphatase, PTP-1B.. J. Biol. Chem. 274: 26697 — 26704. PubMed DOI:10.1074/jbc.274.38.26697
- Ravichandran L.V., Chen H., Li Y., Quon M.J. (2001). Phosphorylation of PTP1B at Ser(50) by Akt impairs its ability to dephosphorylate the insulin receptor.. Mol. Endocrinol. 15: 1768 — 1780. PubMed DOI:10.1210/mend.15.10.0711