Цитидиндезамінази
Цитидиндезамінази, APOBEC — родина консервативних білків ферментів, які відщеплюють аміногрупу від азотистої основи цитозину, яка включена до полінуклеотидного ланцюга нуклеїнових кислот. Належать до надродини цинк-залежних дезаміназ. Цитидин-дезамінази беруть участь у процесах редагування РНК, супермутагенезу в лімфоцитах, противірусного імунітету. Гени APOBEC наявні у хребетних тварин.
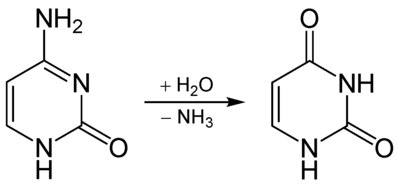
Історія відкриття
Назва APOBEC походить від англ. apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like, оскільки білок було вперше описано 1987 року як фермент, який змінює мРНК аполіпопротеїну B.[1] Аполіпопротеїн B існує у двох формах: ApoB-100 й ApoB-48. Більша ізоформа ApoB-100 синтезується в печінці й відповідає за обмін ліпідів та повністю збігається з передбаченою послідовністю амінокислот з мРНК. Менша форма ApoB-48 у ентероцитах кодувалася такою ж довгою мРНК, але зі стоп-кодоном у 6457-му положенні замість глутаміну. Така зміна була викликана заміною триплету ЦАА на триплет УАА, що призводило до припинення трансляції білку.
Різноманіття і походження
Білки родини цитозин-дезаміназ у людини кодуються 11 генами: AID, APOBEC1, APOBEC2, APOBEC4 і кластером з 7 генів APOBEC3 (від APOBEC3A до APOBECН, один з генів кодує 2 білки D і E). Гени складаються з 5-8 екзонів, окрім гену APOBEC4, який має лише 2 екзони.
| Ген | Хромосомна локалізація у людини | Кількість екзонів | Тканина | Клітинна локалізація | Функція, мішень |
|---|---|---|---|---|---|
| AID | 12p13 | 5 | B-лімфоцити, сім'яники | Цитоплазматичний білок, працює у ядрі | Дезамінування ДНК, гени імуноглобулінів |
| APOBEC1 | 12p13.1 | 5 | Тонкий кишечник (у інших ссавців — кишечник) | Цитоплазматичний білок, працює у ядрі | Дезамінування мРНК аполіпопротеїну B, дезамінування ДНК |
| APOBEC2 | 6p21 | 3 | Скелетні м'язи, серце | Цитоплазматичний і ядерний білок | Бере участь в ембріогенезі м'язів, мішені невідомі |
| APOBEC3A | 22q13.1 | 5 | Кератиноцити, клітини крові | Цитоплазматичний і ядерний білок | Дезамінування ДНК аденоасоційованих вірусів, ретротранспозонів. |
| APOBEC3B | 22q13.1 | 8 | Кишечник, матка, молочна залоза, кератиноцити та інші | Переважно ядерний білок | Дезамінування ДНК ретровірусів, вірусу гепатиту B |
| APOBEC3C | 22q13.1 | 4 | У багатьох тканинах | Цитоплазматичний і ядерний білок | Дезамінування ДНК ретровірусів, вірусу гепатиту B, ретротранспозонів |
| APOBEC3DE | 22q13.1 | 7 | Щитоподібна залоза, селезінка, лейкоцити | Невідомо | Дезамінування ДНК ретровірусів |
| APOBEC3F | 22q13.1 | 8 | У багатьох тканинах | Цитоплазматичний білок | Дезамінування ДНК ретровірусів, вірусу гепатиту B, ретротранспозонів |
| APOBEC3G | 22q13.1 | 8 | У багатьох тканинах, Т-лімфоцитах | Цитоплазматичний білок | Дезамінування ДНК ретровірусів, вірусу гепатиту B, ретротранспозонів |
| APOBEC3H | 22q13.1 | 5 | Лейкоцити, тимус, щитоподібна залоза, плацента | Невідомо | Дезамінування ДНК ретровірусів |
| APOBEC4 | 1q25.3 | 2 | Сім'яники | Невідомо | Невідомі |
Більшість генів цитозин-дезаміназ походять від гену AID. Його гомологи наявні у всіх хребетних включно з рибами, а також у безщелепних, що є показовим, оскільки імунна система безщелепних побудована незвичним способом: вона не має імуноглобулінів.
Ген APOBEC1 утворився завдяки дуплікації гену AID і наявний у всіх ссавців включно із сумчастими. Локус APOBEC3 з'явився після розділення ліній плацентарних і сумчастих ссавців, і наявний лише у плацентарних. Він бере свій початок з двох копій, які у одних ссавців (у гризунів і парнокопитних утворили один ген, а у інших (як то в непарнокопитних, хижих, кажанів і приматів) були багатократно дупліковані.
APOBEC4, ймовірно, має незалежне від AID походження, оскільки в його складі багато негомологічних амінокислотних залишків.[2]
AID має гомологію з ферментом метаболізму нуклеотидів CDA
Функції
Редагування РНК
Головним ферментом, який бере участь у редагуванні РНК шляхом дезамінування цитидину, в хребетних тварин є APOBEC1. Він редагує вже зрілі мРНК в ядрі. Для редагування необхідний білковий комплекс, до якого окрім APOBEC1 входить білок ACF (apobec-1 complementation factor), допоміжний фактор APOBEC1 і ще деякі білки. Цей комплекс розпізнає ділянку РНК у 30-40 нуклеотидів, яка утворює шпильку, причому цільовий цитозин міститься в «голівці» (неспареній ділянці) цієї шпильки. Білок ACF виконує адапторну функцію, забезпечуючи контакт дезамінази з РНК. Комплекс розпізнає послідовність UUUN(A/U)U, яка має міститися далі за сайтом редагування та перетинається з якірною послідовністю, до якої приєднується молекула ACF. Від ступеня збігу цієї ділянки різних РНК з послідовністю мРНК ApoB залежить ефективність редагування конкретного цитидину.
Основною мішенню редагування РНК є аполіпопротеїн B, білок ліпідного обміну, а APOBEC1 експресується переважно у кишечнику людини та додатково у печінці інших видів ссавців. Проте надалі науковці описали ще декілька сайтів редагування, переважно у 3'-нетрансльованих ділянках мРНК. У ссавців станом на 2013 рік було відомо лише чотири сайти редагування. Окрім транскрипту ApoB, редагується мРНК B-субодиниці сукцинатдегідрогенази мітохондрій у моноцитах людини, причому редагування активізується при гіпоксії[3], транскрипт гену фактору нейрофіброматозу NF-1,[4] і мРНК репресору трансляції NAT-1[5]. У всіх цих випадках редагування зі звичайного кодону, який відповідає амінокислоті, утворюються стоп-кодони, що призводить до синтезу вкороченої форми білка, яка може бути функціональною (як у ApoB) чи нефункціональною (при редагуванні NAT-1). Проте дослідження 2014 року виявило ще більше 50 подібних сайтів у кишечнику і печінці мишей.[6]
Імунітет
Цитидиндезамінази завдяки своїй здатності вносити зміни у послідовність ДНК і РНК беруть участь у низці імунних процесів, зокрема блокаді реплікації вірусів, презентації антигенів, дозріванні клітинних рецепторів тощо.[7]
AID необхідний для антигензалежної кінцевої диференціації B-лімфоцитів та для дозрівання й урізноманітнення антитіл. APOBEC1, окрім звичної регуляції ліпідного обміну також має антивірусні властивості, завдяки можливості редагувати не тільки РНК, але й ДНК. Цитидин-дезамінази APOBEC3 обмежують вірусну інфекцію і реплікацію таких вірусів як ВІЛ, віруси гепатиту С і гепатиту B. Зокрема APOBEC3G вперше було відкрито завдяки його взаємодії із білком Vif вірусу імунодефіциту людини.[7]
Патології
Примітки
- Chen, SH and Habib, G and Yang, CY and Gu, ZW and Lee, BR and Weng, SA and Silberman and Cai, SJ and Deslypere, JP and Rosseneu, M and et, al. (1987). Apolipoprotein B-48 is the product of a messenger RNA with an organ-specific in-frame stop codon. Science 238 (4825): 363–366. doi:10.1126/science.3659919.
- Silvestro G. Conticello (2008). The AID/APOBEC family of nucleic acid mutators. Genome Biology 9 (6): 229. PMID 18598372. doi:10.1186/gb-2008-9-6-229.
- Baysal, Bora E. and De Jong, Kitty and Liu, Biao and Wang, Jianmin and Patnaik, Santosh K. and Wallace, Paul K. and Taggart, Robert T. (9 2013). Hypoxia-inducible C-to-U coding RNA editing downregulates SDHB in monocytes,. doi:10.7717/peerj.152.
- Gary R. Skuse,; Amedeo J. Cappione, Mark Sowden, Linda J. Metheny, and Harold C. Smith (1996). The Neurofibromatosis Type I Messenger RNA Undergoes Base-Modification RNA Editing. Nucl. Acids Res. 24 (3): 478–486. doi:10.1093/nar/24.3.478.
- S Yamanaka; K S Poksay, K S Arnold, and T L Innerarity (February 1, 1997). A novel translational repressor mRNA is edited extensively in livers containing tumors caused by the transgene expression of the apoB mRNA-editing enzyme. Genes Dev. 11: 321–333. doi:10.1101/gad.11.3.321.
- Valerie Blanc, Eddie Park, Sabine Schaefer, Melanie Miller, Yiing Lin, Susan Kennedy, Anja M. Billing, Hisham Ben Hamidane, Johannes Graumann, Ali Mortazavi, Joseph H. Nadeau & Nicholas O. Davidson (2014). Genome-wide identification and functional analysis of Apobec-1-mediated C-to-U RNA editing in mouse small intestine and liver. Genome Biology 15 (6): R79. PMID 24946870. doi:10.1186/gb-2014-15-6-r79.
- Arnaud Moris, Shannon Murray & Sylvain Cardinaud (2014). AID and APOBECs span the gap between innate and adaptive immunity. Frontiers in microbiology 5: 534. PMID 25352838. doi:10.3389/fmicb.2014.00534.