АТФ-залежні калієві канали
АТФ-залежні калієві канали (англ. ATP-sensitive potassium channels або KATP channel) — група білків з класу іонних каналів, що вибірково пропускають калій та активність яких регулюється внутрішньоклітинними нуклеотидами, зокрема АТФ та АДФ. АТФ-залежні калієві канали належать до групи калієвих каналів вхідного випрямлення (Kir-канали) та об'єднані в родину Kir6. Функціональний АТФ-залежний калієвий канал утворений чотирма основними (Kir6.X) та чотирма допоміжними (SUR) білковими субодиницями. Високі концентрації АТФ у цитоплазмі клітини зачиняють ворота каналу, а зниження кількості АТФ призводить до відчинення каналу та пропускання ним калієвого струму. При високих позитивних значеннях мембранного потенціалу струм через канали падає за рахунок їх блокування внутрішньоклітинними поліамінами, зокрема сперміном.
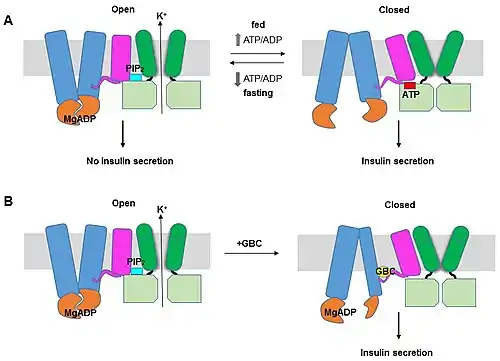
АТФ-залежні калієві канали наявні у всіх наземних хребетних, а також у кісткових та хрящових риб. Ці канали розташовані на зовнішній мембрані клітини, хоча також є в мембрані мітохондрій та ядра. Білковий склад мітохондріальних та ядерних каналів невідомий.[2]
Вперше були відкриті у клітинах серця[3]. Вони працюють здебільшого у м'язах і нейронах, де за умов нестачі енергії у вигляді АТФ переводять клітини у режим спокою, знижуючи їхні збудливість і скоротливість. Також KATP-канали задіяні у регуляції виділення інсуліну в бета-клітинах острівців підшлункової залози. АТФ-залежні калієві канали є мішенями дії лікарських засобів, які захищають серце і судини під час перенавантаження.
Молекулярна структура
Функціональні KATP-канали — це октамери, які складаються з чотирьох Kir6.х субодиниць, що формують пору каналу, та чотирьох додаткових білків — рецепторів до сульфонілсечовини SURx (англ. Sulphonylurea receprors). Назва цих білків зумовлена тим, що при блокуванні каналу сульфонілсечовиною, вона зв'язується саме із SUR-субодиницею.
Kir6.x містить дві трансмембранні ділянки та одну, що занурена в мембрану й формує внутрішню поверхню пори каналу із селективним фільтром (P-домен або P-петля). Субодиниця Kir відповідає за підтримання каналу в закритому стані за допомогою АТФ (за виключенням таких каналів у гладеньких м'язах).[4]
Субодиниця SUR складається з трьох трансмембранних доменів (TMD0, TMD1, TMD2), перший з яких містить в собі п'ять, а інші два — шість трансмембранних сегментів. Також між TMD1 і TMD2 та після TMD2 на цитоплазматичному боці мембрани знаходяться нуклеодитзв'язувальні домени (NBD1, NBD2). Саме субодиниці SUR відповідають за активацію каналу. Вони належать до класу ABC-транспортерів (англ. ATP-binding cassette transporters), основна функція яких — використовувати енергію АТФ на потреби клітини, такі як перенесення різноманітних речовин через мембрану[5][6].
Ці іонні канали мають високу селективність відносно іонів калію. Селективний фільтр, що визначає, який катіон (наприклад, Na+ чи K+) може пройти крізь канал, розташований у найвужчій його частині. Дослідження показали, що сегмент H5 необхідний для селективності до К+. H5 має в собі консенсусну послідовність (Thr-Val-Gly-Tyr-Gly), яка була знайдена в усіх калієвих каналах з мінімальними змінами протягом еволюції. Атоми оксигену створюють «негативний» заряд в області фільтру, який імітує водне середовище, в якому знаходиться калій в розчині. Вважається, що селективність саме до іонів калію забезпечується жорстко закріпленим розміром пори. Тобто, інші іони такі, як, наприклад, літій не можуть пройти (проходять із меншою імовірністю) тому, що оксиген знаходиться від них надто далеко, набагато далі, аніж диполі води, які оточують іон в розчині, тобто для літію така «імітація» некоректна.[7]
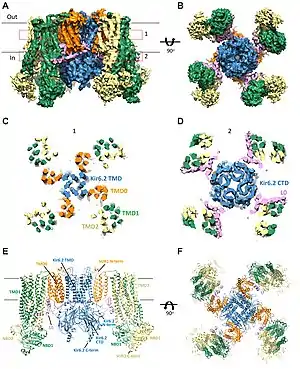
У 2017 році було опубліковано дослідження структури комплексу АТФ-залежного калієвого каналу щура за допомогою кріоелектронної мікроскопії. Робочий канал являє собою октамер, в центрі якого знаходиться тетрамер з субодиниць Kir6, кожна з яких на периферії поєднана з білком SUR. Ширина комплексу Kir6.2-SUR1 складає близько 200 ангстрем, а висота — близько 125 ангстрем. За формою канал нагадує пропелер, у якому пора Kir6.2 і TMD0 допоміжної субодиниці утворюють щільний центр, а інші частини SUR1 — лопаті пропелера. Ключовим місцем контакту між Kir6 та SUR у комплексі є домени TMD0 та L0 (прилегла до TMD0 цитоплазматична петля).[1]
Електричні властивості KATP-каналів
Для KATP-каналів в різних тканинах характерні різні рівні провідності. Так, наприклад, для м'язових клітин сечового міхура це 11-12 pS (pS — пікосіменс), 15-50 pS — для гладенької мускулатури ворітної вени, культури клітин коронарної артерії, 55-75 pS — для скелетних м'язів, 50-90 pS — β-клітин острівців Лангерганса підшлункової залози, 70-90 pS — для серця та найвища провідність (130 pS) характерна для гладенької мускулатури мезентеральних артерій, хвостової артерії щура та аорти собаки.
KATP-канали є родиною з класу Kir, тобто їм властиве вхідне випрямлення. Випрямленням струму в електрофізіології називають явище, коли за умов однакової концентрації іону зсередини та ззовні потік іону не врівноважений. Випрямлення буває вихідним та вхідним. У нашому випадку це вхідне випрямлення, тобто калій простіше входить у клітину через ці канали. Також випрямлення буває слабким та сильним. Для KATP-каналів характерне «слабке» випрямлення[8]. Також за зміни pH змінюється і сила випрямлення: за нейтрального значення pH цим каналам властиве «слабке» випрямлення, яке, власне, є фізіологічним, при залуженні середовища випрямлення стає більш «сильним». Наразі ще не до кінця з'ясовані деталі, проте загальний механізм випрямлення зрозумілий. Воно відбувається за посередництвом аліфатичного поліаміну сперміну. Він позитивно заряджений та має валентність ~5. Коли калій починає виходити із клітини він потоком «затягує» спермін у пору. Остання блокується та більше не пропускає іони калію назовні, проте іони, що надходять всередину, можуть «витиснути» спермін та далі заходити без перешкод.[9]
Для відкриття KATP-каналів потрібна наявність молекул фосфатидилінозитол-4,5-біс-фосфату у клітинній мембрані поблизу каналу[10].
Тканиноспецифічність та гени, що кодують KATP
Усі варіації АТФ-залежних калієвих каналів клітинної мембрани кодуються чотирма генами: KCNJ8, KCNJ11, ABCC8, ABCC9. Вони відповідають за синтез білкових субодиниць Kir6.1, Kir6.2, SUR1 та SUR2 відповідно. Матрична РНК, що синтезується на останньому гені, підлягає альтернативному сплайсингу, що призводить до появи двох варіантів білків: субодиниць SUR2A та SUR2B. У щура ці гени розташовані в наступному порядку: в першій хромосомі ABCC8 — 39 екзонів та KCNJ11 — 2 екзони, в четвертій хромосомі ABCC9 — 40 екзони та KCNJ8 — 3 екзони.[11]
У різних тканинах наявні різні комбінації субодиниць. Відтак для гладенької мускулатури судин характерний набір Kir6.1-SUR2B і вони утворюють підтип «KATP-KNDP», який названий так, аби підкреслити важливість активації за допомогою нуклеозиддифосфатів (НДФ) і те, що лише сама молекула АТФ не може їх зачинити[12]. У той же час відомо про те, що існують інші комбінації субодиниць у м'язах судин, наприклад Kir6.2-SUR2B. Є відомості про те, що гладенькі м'язи детрузора містять Kir6.2-SUR2A(B)[13]. Для серця характерна комбінація Kir6.2-SUR2A. Але якщо із пороутворювальною одиницею все чітко та зрозуміло, то з регуляторною ситуація не така ясна. Було показано, що у мишей SUR1 експресується в передсерді, у той час як SUR2A — у шлуночку[14]. Глюкозочутливі нейрони мозку містять комплекс субодиниць Kir6.2-SUR1[15][10]. Проте також є наукові праці, які показують, що глюкозочутливі нейрони у вентромедіальному ядрі гіпоталамусу та такі ж холінергічні у смугастому тілі мозку містять у собі комбінацію з субодиниць Kir6.1-SUR1. В підшлунковій залозі β-клітини містять KATP-канали складу Kir6.2-SUR1[16].
Мітохондріальні канали
У 1991 році було показано наявність АТФ-залежних калієвих каналів у внутрішній мембрані мітохондрій. Були виділені дві білкові субодиниці, що за розмірами нагадували Kir6 та SUR, та зібрано з них функціональний канал у штучній мембрані. Втім, імунологічний аналіз не зміг підтвердити наявність стандартних білкових субодиниць у мітохондріях.[17] Припускається, що пороутворюючою субодиницею може бути білок KCNJ1, а допоміжною — одна з ізоформ, що експресується з гену SUR2. Втім, навіть здатність цих двох білків утворювати функціональний калієвий канал не була доведена.[2]
Функції в організмі
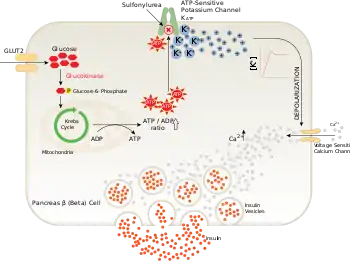
Підшлункова залоза
Головна функція KATP-каналів в ендокринній частині підшлункової залози — це секреція інсуліну. Інсулінова секреція активується високим рівнем глюкози в крові. Під час допорогового рівня глюкози KATP-канали відкриті та підтримують негативний електрохімічний потенціал. У момент, коли рівень глюкози у крові зростає, глюкоза входить до клітини через глюкозний транспортер GLUT2 і запускається її метаболізм у β-клітинах острівців Лангерганса. Як наслідок у клітині зростає рівень АТФ, а рівень АДФ падає. Слідом за цим KATP-канали закриваються, клітини деполяризуються та відбувається активація потенціалзалежних кальцієвих каналів (ПЗКК). Приток кальцію веде до того, що пухирці, які містять інсулін, зливаються з мембраною та гормон таким чином вивільняється назовні.[18]
Серце
У серці KATP-канали відіграють роль кардіопротекторів за умов ішемії[19]. За рахунок того, що вони гіперполяризують мембрану, зменшується потенціал дії кардіоміоцитів та обмежується приток кальцію через ПЗКК, відповідно, зменшується час неефективного скорочення серця. На відміну від KATP-каналів у підшлунковій залозі, у серці вони перебувають у постійно закритому стані за фізіологічних умов по причині того, що в цій тканині постійно підтримується висока концентрація АТФ. Канали відкриваються за таких умов як перевантаження серця, гіпоксія чи ішемія. Навіть короткі епізоди ішемії спричинюють подальший захист міокарду проти наступних інфарктів. Такий феномен називають «ішемічне прекондиціювання»[20].
Мозок
Основна ділянка мозку, де АТФ-залежні калієві канали відіграють важливу роль, — це гіпоталамус. У гіпоталамусі дуже багато «глюкозочутливих» нейронів[21][22]. Так, наприклад, орексинові нейрони у мишачому латеральному гіпоталамусі регулюють безсоння, локомоторну активність та апетит і вони гальмуються високим рівнем глюкози. А MCH-нейрони, які регулюють поведінку з пошуку їжі, настрій та енергетичний баланс, активуються підвищеним рівнем глюкози.
Більшість нейронів, які активуються підвищеним рівнем глюкози, працюють за наступним механізмом: потрапляє глюкоза — підвищується рівень АТФ — закриваються KATP-канали — відбувається деполяризація клітини — підвищення рівня провідності. Механізм інгібування за допомогою рівня глюкози менш зрозумілий на даний момент, проте є припущення, що у цьому бере участь Na+-K+-АТФаза та активація гіперполяризаційного хлорного струму, який, можливо, активує хлорні канали (англ. CFTR-like Cl- channels). Окрім цієї функції, KATP-канали грають захисну роль за патологічних умов[23]. У більшості ссавці за таких умов нейрони деполяризуються та помирають. Відтак, наприклад, у чорній субстанції KATP-канали пригнічують нейронну активність (гіперполяризують клітину) під час гіпоксії за рахунок їх відкриття на постсинаптичних мембранах.
Гладенька мускулатура
У непосмугованих м'язах KATP-канали найбільш розповсюджені у стінках судин та поширені в них по всьому тілу. Відкриття цих каналів спричинює гіперполяризацію мембрани і як наслідок — закриття ПЗКК та розслаблення м'язових волокон судин, особливо вен — тобто, функцію вазоділатації.
Окрім звичайної регуляції тут ще має місце регуляція відкриття-закриття за допомогою фосфорилювання. Так на активність KATP-каналів можуть впливати такі вазоділататори як простагландин, CGRP (англ. Calcitonin Gene Related Peptide), аденозин та вазоконстриктори, наприклад, ендотелін, вазопресин, гістамін. Можливо, вони впливають хоча б на сам процес фосфорилювання за допомогою протеїнкінази А. Але цей процес ще не вивчений на достатньому рівні.[24]
Також KATP-канали присутні в м'язах детрузора. Поки що не зрозуміла їхня функція в цьому органі. Було показано, що інгібітор глібенкламід не впливає на збудливість чи скоротливість детрузора за відсутності стимуляції цього каналу, тим не менш KATP -канали сприяють утворенню та підтриманню мембранного потенціалу спокою детрузора[25][26]. При цьому за фармакологічної активації KATP-каналів відбувається гіперполяризація мембрани, як наслідок — закриття потенціал-залежних кальцієвих каналів та зниження напруження[27].
Фармакологічні властивості KATP-каналів
АТФ є головним регулятором активності каналу і може виконувати дві різні функції: 1) закривати канал, та 2) підтримувати канал в активному стані за присутності іонів магнію. Сайт для зв'язування АТФ з метою інгібувати активність каналу знаходиться на субодиниці Kir6.2[4], це такі залишки амінокислот як аргінін у 50-ому положенні на N-кінці та 182-й ізолейцин, 185-й лізин, 201-й аргінін, 334-й гліцин на C-кінці[10]. Вважається, що ці залишки формують так звану АТФ-зв'язуювальну кишеню[10]. Тобто, із одним KATP-каналом може зв'язатися чотири молекули АТФ.
Також АТФ може й активувати KATP-канал, якщо зв'язується із SUR[4], але зазвичай за активацію відповідає НДФ. Сайт зв'язування знаходиться на субодиниці SUR. Останній містить два NBD (англ. Nucleotide Binding Domain) із такими консенсусними мотивами як «Walker-A» та «Walker-B» (Gly-X-X-X-X-Gly-Lys-Thr/Ser)[28]. Мутації в «Walker-A» мотиві на NBD1 запобігають зв'язуванню нуклеотидів з обома NBD[29].
Такий механізм активації та інгібування діє за фізіологічних умов, проте фармацевтичні засоби можуть як активувати, так й інгібувати KATP-канали, зв'язуючись із SUR. Інгібіторами можуть бути такі похідні сульфонілсечовини як хлорпропамід, толбутамід та глібенкламід[30][31][32]. Вони використовуються в лікуванні цукрового діабету другого типу. Активаційні агенти, які також відомі як KCOs (англ. K+ channel openers) представлені такими речовинами як пінациділ, нікорандил та діазоксид[33][34].
Показано[35], що фармацевтичні речовини KCO (наприклад, аналог пінациділу [3H]P1075) можуть зв'язуватися із SUR за відсутності Kir-субодиниці[36] та не можуть активувати канал, якщо наявна лише пороутворювальна субодиниця[4][37]. Також відомо, що різні субодиниці SUR по-різному реагують на активатори, так за присутності Mg-АТФ пінациділ може активувати Kir6.2-SUR2A, але не Kir6.2-SUR1[38]. Так показано, що KCOs зв'язуються лише на SUR, а також специфічність зв'язування.
Медичне значення
Каналопатії
Мутації, що призводять до порушення утворення комплексу канала або механізмів його закриття призводять до проблем з секрецією інсуліну. Пацієнти з цими мутаціями можуть страждати на конгенітальний гіперінсулінізм або перманентний неонатальний цукровий діабет в разі втрати функції каналу або її посилення відповідно[1].
Лікарські засоби, що впливають на KATP-канали
За допомогою таких похідних сулфонілсечовини як ацетогексамід, толбутамід, гліпізид, глібенкламід та глімепірид лікують цукровий діабет другого типу.
У гладеньких м'язах KCOs спричинюють релаксацію судин та зниження кров'яного тиску за рахунок відкриття KATP-каналів. Деякі з таких речовин використовуються в терапевтиці як засіб проти артеріальної гіпертензії. Більше того, KCOs використовуються як ліки проти таких хвороб як гостра та хронічна ішемія міокарда, застійна серцева недостатність, бронхіальна астма, нетримання сечі та декотрі міопатії скелетних м'язів.
У β-клітинах острівців Лангерганса підшлункової залози, спричиняючи відкриття KATP-каналів, лікують гіперсекрецію інсуліну, що пов'язана з інсуліномою та хронічну гіпоглікемію у дітей[10].
Див. також
- Іонні канали
- Калієві канали
- Калієві канали вхідного випрямлення
Примітки
- Gregory M. Martin, Craig Yoshioka, Emily A. Rex, Jonathan F. Fay, Qing Xie, Matthew R. Whorton, James Z. Chen, Show-Ling Shyng (January 2017). Cryo-EM structure of the ATP-sensitive potassium channel illuminates mechanisms of assembly and gating. eLife 6. PMID 28092267. doi:10.7554/eLife.24149.(англ.)
- Danina M. Muntean, Lorand Kiss, Norbert Jost, Istvan Baczko (2015). ATP-sensitive potassium channel modulators and cardiac arrhythmias: an update. Current pharmaceutical design 21 (8): 1091–1102. PMID 25354183.(англ.)
- A. Noma (September 1983). ATP-regulated K+ channels in cardiac muscle. Nature 305 (5930): 147–148. PMID 6310409.
- Tucker, Stephen J.; Gribble, Fiona M.; Zhao, Chao; Trapp, Stefan; Ashcroft, Frances M. (1997). Truncation of Kir6.2 produces ATP-sensitive K+ channels in the absence of the sulphonylurea receptor. Nature 387 (6629): 179–183. ISSN 0028-0836. doi:10.1038/387179a0.(англ.)
- Jones, P. M.; George, A. M. (2004). The ABC transporter structure and mechanism: perspectives on recent research. Cellular and Molecular Life Sciences (CMLS) 61 (6): 682–699. ISSN 1420-682X. doi:10.1007/s00018-003-3336-9.
- Davidson, A. L.; Dassa, E.; Orelle, C.; Chen, J. (2008). Structure, Function, and Evolution of Bacterial ATP-Binding Cassette Systems. Microbiology and Molecular Biology Reviews 72 (2): 317–364. ISSN 1092-2172. doi:10.1128/MMBR.00031-07.
- Шуба, 2012, с. 249.
- Baukrowitz, Thomas; Tucker, Stephen J.; Schulte, Uwe; Benndorf, K; Ruppersberg, J.Peter; Fakler, Bernd (1999). Inward rectification in KATP channels: a pH switch in the pore. The EMBO Journal 18 (4): 847–853. ISSN 0261-4189. doi:10.1093/emboj/18.4.847.(англ.)
- Stanfield, Peter R.; Sutcliffe, Michael J. (2003). Spermine Is Fit to Block Inward Rectifier (Kir) Channels. The Journal of General Physiology 122 (5): 481–484. ISSN 0022-1295. doi:10.1085/jgp.200308957.(англ.)
- Hibino, Hiroshi; Inanobe, Atsushi; Furutani, Kazuharu; Murakami, Shingo; Findlay, Ian; Kurachi, Yoshihisa (2010). Inwardly Rectifying Potassium Channels: Their Structure, Function, and Physiological Roles. Physiological Reviews 90 (1): 291–366. ISSN 0031-9333. doi:10.1152/physrev.00021.2009.(англ.)
- Шуба, 2010, с. 250.
- Beech, D.J.; Zhang, H.; Nakao, K.; Bolton, T.B. (1993). Single channel and whole-cell K-currents evoked by levcromakalim in smooth muscle cells from the rabbit portal vein. British Journal of Pharmacology 110 (2): 583–590. ISSN 00071188. doi:10.1111/j.1476-5381.1993.tb13850.x.(англ.)
- Shieh, C-C; Brune, M E; Buckner, S A; Whiteaker, K L; Molinari, E J; Milicic, I A; Fabiyi, A C; Daza, A; Brioni, J D; Carroll, W A; Matsushita, K; Yamada, M; Kurachi, Y; Gopalakrishnan, M (2009). Characterization of a novel ATP-sensitive K+ channel opener, A-251179, on urinary bladder relaxation and cystometric parameters. British Journal of Pharmacology 151 (4): 467–475. ISSN 00071188. doi:10.1038/sj.bjp.0707249.
- Flagg, T. P.; Kurata, H. T.; Masia, R.; Caputa, G.; Magnuson, M. A.; Lefer, D. J.; Coetzee, W. A.; Nichols, C. G. (2008). Differential Structure of Atrial and Ventricular KATP: Atrial KATP Channels Require SUR1. Circulation Research 103 (12): 1458–1465. ISSN 0009-7330. doi:10.1161/CIRCRESAHA.108.178186.
- Karschin, Andreas; Brockhaus, Johannes; Ballanyi, Klaus (1998). KATPchannel formation by the sulphonylurea receptors SUR1 with Kir6.2 subunits in rat dorsal vagal neuronsin situ. The Journal of Physiology 509 (2): 339–346. ISSN 00223751. doi:10.1111/j.1469-7793.1998.339bn.x.
- Inagaki, Nobuya; Gonoi, Tohru; Iv, John P.Clement; Wang, Chang-Zheng; Aguilar-Bryan, Lydia; Bryan, Joseph; Seino, Susumu (1996). A Family of Sulfonylurea Receptors Determines the Pharmacological Properties of ATP-Sensitive K+ Channels. Neuron 16 (5): 1011–1017. ISSN 08966273. doi:10.1016/S0896-6273(00)80124-5.
- Yamada, Mitsuhiko (2010). Mitochondrial ATP-sensitive K+channels, protectors of the heart. The Journal of Physiology 588 (2): 283–286. ISSN 00223751. doi:10.1113/jphysiol.2009.179028.(англ.)
- Rorsman, Patrik; Ramracheya, Reshma; Rorsman, Nils J. G.; Zhang, Quan (2014). ATP-regulated potassium channels and voltage-gated calcium channels in pancreatic alpha and beta cells: similar functions but reciprocal effects on secretion. Diabetologia 57 (9): 1749–1761. ISSN 0012-186X. doi:10.1007/s00125-014-3279-8.(англ.)
- Nichols CG, Lederer WJ. Adenosine triphosphate-sensitive potassium channels in the cardiovascular system // Am J Physiol Heart Circ Physiol. 1991. 261. P.H1675-H1686
- Yellon D, Downey J. Preconditioning the myocardium: from cellular physiology to clinical cardiology // Physiol Rev.-2003.-83.-P.1113-1151
- M. L. Ashford, P. R. Boden & J. M. Treherne (January 1990). Glucose-induced excitation of hypothalamic neurones is mediated by ATP-sensitive K+ channels. Pflugers Archiv : European journal of physiology 415 (4): 479–483. PMID 2315006.
- Vanessa H. Routh (July 2002). Glucose-sensing neurons: are they physiologically relevant?. Physiology & behavior 76 (3): 403–413. PMID 12117577.
- Ballanyi, K. (2004). Protective role of neuronal KATP channels in brain hypoxia. Journal of Experimental Biology 207 (18): 3201–3212. ISSN 0022-0949. doi:10.1242/jeb.01106.
- Bouchard, J.-F.; Dumont, E.; Lamontagne, D. (1994). Evidence that prostaglandins I2, E2, and D2 may activate ATP sensitive potassium channels in the isolated rat heart. Cardiovascular Research 28 (6): 901–905. ISSN 0008-6363. doi:10.1093/cvr/28.6.901.(англ.)
- Imai T, Okamoto T, Yamamoto Y, Tanaka H, Koike K, Shigenobu K, Tanaka Y. Effects of different types of K+ channel modulators on the spontaneous myogenic contraction of guinea-pig urinary bladder smooth muscle // Acta Physiol. Scand. 2001. 173. P.323-333
- Kajioka S, Shahab N, Asano H, Morita H, Sugihara M, Takahashi-Yanaga F, Yoshihara T, Nakayama S, Seki N, Naito S. Diphosphate regulation of adenosine triphosphate sensitive potassium channel in human bladder smooth muscle cells // J. Urol. 2011. 186. P.736-744
- Petkov GV. Role of potassium ion channels in detrusor smooth muscle function and dysfunction // Nat Rev Urol. 2011. 9(1). P.30-40
- J. E. Walker, M. Saraste, M. J. Runswick, N. J. Gay (1982). Distantly related sequences in the alpha- and beta-subunits of ATP synthase, myosin, kinases and other ATP-requiring enzymes and a common nucleotide binding fold. The EMBO journal 1 (8): 945–951. PMID 6329717.(англ.)
- Ueda, Kazumitsu; Inagaki, Nobuya; Seino, Susumu (1997). MgADP Antagonism to Mg2+-independent ATP Binding of the Sulfonylurea Receptor SUR1. Journal of Biological Chemistry 272 (37): 22983–22986. ISSN 0021-9258. doi:10.1074/jbc.272.37.22983.(англ.)
- Doyle, M. E. (2003). Pharmacological Agents That Directly Modulate Insulin Secretion. Pharmacological Reviews 55 (1): 105–131. ISSN 00316997. doi:10.1124/pr.55.1.7.(англ.)
- Edwards, G; Weston, A H (1993). The Pharmacology of ATP-Sensitive Potassium Channels. Annual Review of Pharmacology and Toxicology 33 (1): 597–637. ISSN 0362-1642. doi:10.1146/annurev.pa.33.040193.003121.(англ.)
- Wickenden, Alan D (2002). K+ channels as therapeutic drug targets. Pharmacology & Therapeutics 94 (1-2): 157–182. ISSN 01637258. doi:10.1016/S0163-7258(02)00201-2.(англ.)
- Terzic, A.; Jahangir, A.; Kurachi, Y. (1995). Cardiac ATP-sensitive K+ channels: regulation by intracellular nucleotides and K+ channel-opening drugs. American Journal of Physiology-Cell Physiology 269 (3): C525–C545. ISSN 0363-6143. doi:10.1152/ajpcell.1995.269.3.C525.(англ.)
- Ashcroft, F M (1988). Adenosine 5'-Triphosphate-Sensitive Potassium Channels. Annual Review of Neuroscience 11 (1): 97–118. ISSN 0147-006X. doi:10.1146/annurev.ne.11.030188.000525.(англ.)
- M. Ashcroft, Frances; M. Gribble, Fiona (2000). New windows on the mechanism of action of KATP channel openers. Trends in Pharmacological Sciences 21 (11): 439–445. ISSN 01656147. doi:10.1016/S0165-6147(00)01563-7.(англ.)
- Uhde, Ingo; Toman, Andreas; Gross, Insa; Schwanstecher, Christina; Schwanstecher, Mathias (1999). Identification of the Potassium Channel Opener Site on Sulfonylurea Receptors. Journal of Biological Chemistry 274 (40): 28079–28082. ISSN 0021-9258. doi:10.1074/jbc.274.40.28079.(англ.)
- John, Scott A.; Monck, Jonathan R.; Weiss, James N.; Ribalet, Bernard (1998). The sulphonylurea receptor SUR1 regulates ATP-sensitive mouse Kir6.2 K+channels linked to the green fluorescent protein in human embryonic kidney cells (HEK 293). The Journal of Physiology 510 (2): 333–345. ISSN 00223751. doi:10.1111/j.1469-7793.1998.333bk.x.(англ.)
- Isomoto, Shojiro; Kondo, Chikako; Yamada, Mitsuhiko; Matsumoto, Shigeto; Higashiguchi, Omi; Horio, Yoshiyuki; Matsuzawa, Yuji; Kurachi, Yoshihisa (1996). A Novel Sulfonylurea Receptor Forms with BIR (Kir6.2) a Smooth Muscle Type ATP-sensitive K+Channel. Journal of Biological Chemistry 271 (40): 24321–24324. ISSN 0021-9258. doi:10.1074/jbc.271.40.24321.(англ.)
Джерела
- Шуба, Я. М. (2010). Основи молекулярної фізіології іонних каналів: навчальний посібник для студентів вищих навчальних закладів. К.: Наукова думка. с. 446. ISBN 978-966-00-1042-0.
- Gregory M. Martin, Craig Yoshioka, Emily A. Rex, Jonathan F. Fay, Qing Xie, Matthew R. Whorton, James Z. Chen, Show-Ling Shyng (January 2017). Cryo-EM structure of the ATP-sensitive potassium channel illuminates mechanisms of assembly and gating. eLife 6. PMID 28092267. doi:10.7554/eLife.24149.(англ.)
- Tucker, Stephen J.; Gribble, Fiona M.; Zhao, Chao; Trapp, Stefan; Ashcroft, Frances M. (1997). Truncation of Kir6.2 produces ATP-sensitive K+ channels in the absence of the sulphonylurea receptor. Nature 387 (6629): 179–183. ISSN 0028-0836. doi:10.1038/387179a0.(англ.)
- Hibino, Hiroshi; Inanobe, Atsushi; Furutani, Kazuharu; Murakami, Shingo; Findlay, Ian; Kurachi, Yoshihisa (2010). Inwardly Rectifying Potassium Channels: Their Structure, Function, and Physiological Roles. Physiological Reviews 90 (1): 291–366. ISSN 0031-9333. doi:10.1152/physrev.00021.2009.(англ.)
|
|
Ця стаття належить до добрих статей української Вікіпедії. |