Водневоподібний атом
Водне́воподі́бні а́томи — атоми (іони), що складаються, як атом водню, з ядра і одного електрона. До них крім водню та його важких ізотопів (дейтерій і тритій) відносяться іони елементів з атомним номером , які втратили всі електрони крім одного: He+, Li+2, Be+3 тощо.
.png.webp)
Разом з атомом водню вони утворюють найпростіший ізоелектронний ряд. Рівні енергії( і спектри) водневоподібних атомів схожі на спектри атома водню, і відрізняються від них масштабом енергій (і частот) переходів у разів. Для таких атомів виконується теорія Бора.
У водневоподібному атомі електрон і ядро утворюють систему двох тіл, задача про поведінку якої може бути розв'язана точно.
Системи схожі з водневоподібними атомами утворюють також атомне ядро і мюон (мезоатом), а також електрон і позитрон (позитроній), для них також отримують аналогічні водневим рівні енергії та спектри.
Значення
Атом може складатися з десятків електронів, що обертаються навколо ядра. Всі вони взаємодіють між собою, що робить точне теоретичне обрахування положень енергетичних рівнів практично неможливим. У водневоподібному атомі є лише два компоненти: ядро і електрон. В такому випадку, радіаційні і релятивістські поправки до кулонівського потенціалу малі, і можуть бути з великою точністю обраховані за допомогою теорії збурень.
Завдяки цьому, водневоподібні атоми є найкращими модельними об'єктами для дослідження різних аспектів взаємодії елементарних частинок. Рівняння Дірака було підтверджене завдяки виведеному з його допомогою значенню тонкого розщеплення рівнів енергій водневоподібних атомів. Також, лембів зсув знайшли саме при дослідженнях атома водню. Рівняння Брейта, Бете-Солпітера, Логунова-Тавхелідзе, були перевірені саме на таких системах. [1]
Поведінка водневоподібних атомів у зовнішніх полях також ретельно досліджена. Тому, такі явища як зееманівське розщеплення також найкраще описані саме для водневоподібних атомів.
Спрощений опис
Взагалі, положення електрону в атомі може бути просторово-складним, проте для принципового розуміння причин дискретності спектрів атомів, можна розглянути дуже спрощену ситуацію плоскої орбіти.[2]
Електрон на таких масштабах не можна вважати корпускулою, що рухається по орбіті, проте можна розглянути його як стоячу хвилю, місцем локалізації якої є коло з радіусом r. У цьому випадку, в довжину орбіти має вкладатися ціла кількість періодів хвилі, тобто
- , або ж ,
Цей вираз є одним з постулатів Бора
Поле, що створюється ядром з зарядом Z, є кулонівським полем з потенціалом і потенціальною енергією
Сила, що діє на електрон з боку ядра є доцентровою силою, тобто дорівнює добутку маси електрону на доцентрове прискорення , з чого можна вивести наступне рівняння:
Спростивши це рівняння і виразивши з нього значення для швидкості, можна вивести наступну умову для можливих радіусів орбіти електрона:
- ,
де n=1,2,3... Число n називають також головним квантовим числом.
Цим дозволеним радіусам відповідають рівні енергії
- ,
де E — сума потенціальної і кінетичної енергії на даній орбіті.
Для більшої точності, замість маси електрона в цьому рівнянні треб використовувати приведену масу системи ядро-електрон, що дорівнює .
Цей вираз доволі точно описує рівні енергії електрона і спектр, що породжується переходами між ними проте тонка і надтонка структура не можуть бути пояснені таким способом.
Квантовомеханічний опис
Рівняння Шредінгера
Рівняння Шредінгера для водневоподібного атому можна записати наступним чином[3]:
Розв'язок його є складним, проте значення допустимих рівнів енергії електрону, що допускаються ним, є таким самим як і в спрощеному випадку, описаному вище.
Орбітальний момент імпульсу електрона може приймати ряд дискретних значень, де l — орбітальне квантове число, що може приймати будь-які цілі значення в проміжку від 0 до n-1.
Проекція орбітального моменту імпульсу на деяку вісь може приймати лише значення . Число m — магнітне квантове число, і може приймати будь-які цілі значення від -l до l.
Рівняння Дірака
Для врахування релятивістських ефектів, а також ефектів, пов'язаних зі спін-орбітальною взаємодією, замість рівняння Шредінгера можна використати рівняння Дірака. Воно дозволяє вивести тонку структуру рівнів енергії водневоподібних атомів. [4]
Рівняння Дірака для електрона в кулонівському полі ядра, так само як і рівняння Шредінгера, має точний розв'язок. При цьому, гамільтоніан взаємодії виглядає наступним чином:[5]
- ,
де — оператори спіну і моменту. У цьому рівнянні третій член відповідає спін-орбітальній взаємодії, а четвертий — релятивістським поправкам.
Спектр енергій електрона має вигляд:[5]
- ,
де j=l+½ — власне значення оператору повного моменту.
Таким чином, енергія електрона починає залежати від двох квантових чисел.
Поправки, що вносяться третім членом у цьому рівнянні є значно меншими, ніж різниця між різними рівнями енергії, що задаються головним квантовим числом n. Таким чином, хоча виродження енергетичних рівнів і знімається (різним наборам квантових чисел відповідають різні енергії), різниця між цими рівнями є невеликою, тому часто кажуть про розщеплення рівня, що задається головним квантовим числом, на кілька рівнів, що відповідають різним значенням повного моменту.
При ще детальнішому розгляді потрібно врахувати взаємодію магнітних моментів ядра і електрона, завдяки яким кожен енергетичний рівень розпадається на групу підрівнів. Ці підрівні називаються надтонкою структурою.[6]
Квантова електродинаміка
За рівнянням Дірака, кожна спектральна лінія у водневоподібному атомі є двічі виродженою. Так, наприклад, рівні енергії 2S½ і 2P½ збігаються . Проте у 1947 році Різерфорд і Лемб виявили, що між цими рівнями є різниця, приблизно в 1058 МГц.
Пояснити цей ефект можна, використавши апарат квантової електродинаміки. Поправки до рівняння Дірака, що виникають, називаються радіаційними поправками.
У КЕД всі частинки представляються збудженнями відповідних полів. Вакуум, таким чином, не є абсолютно порожнім, проте є лише особливим станом поля (взагалі кажучи, багатьох полів — фотонного поля, електрон-позитронного поля тощо), при якому це поле має найменшу можливу енергію, що називається нульовими коливаннями. У цьому стані, поле не може віддавати енергію, проте воно не є абсолютно інертним — саме завдяки йому відбувається взаємодія частинок. [7] Наприклад, дві заряджені частинки взаємодіють завдяки тому, що кожна з них випромінює фотони, які поглинаються іншою. Проте, безпосереднє випромінювання фотонів порушувало б закон збереження енергії, тому у цьому випадку йдеться про віртуальні частинки, зв'язок між енергією і імпульсом для яких не виконується.
Таким чином, кожна заряджена частинка оточена "шубою" з віртуальних фотонів, які, в свою чергу, породжують віртуальні електрон-позитронні пари, при анігіляції яких утворюються віртуальні фотони тощо. Постійне випромінювання і поглинання віртуальних фотонів "трясе" електрон, що призводить до коливання відстані до ядра, і, відповідно, потенційної енергії. Це зростання енергії також пояснює виникнення аномального магнітного моменту електрона[8] Додаткову енергію, що виникає таким чином, для орбіт з l=0 можна виразити як:
- ,
де α — стала тонкої структури.
Інший радіаційний ефект, що зміщує енергетичні рівні електрона в протилежному напрямку, виникає через те, що у "шубі" електрона, позитивно заряджені частинки притягуються до нього, а негативно заряджені — відштовхуються. Це явище носить назву поляризація вакууму. У атомі, завдяки цьому, ефективний заряд ядра збільшується на відстані порядка комптонівської довжини хвилі електрона. У атомі водню, відстань між протоном і електроном значно більша, тому для нього цей ефект відповідає лише за 3% зсуву. Проте для таких систем як мюонний атом, де радіус орбіти у сотні разів менший, значення цієї поправки зростає настільки, що вона починає переважати, і рівень 2S½ у ньому знаходиться нижче, ніж 2P½.[8]
Спектри водневоподібних атомів
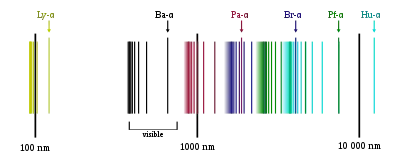
Завдяки своїй простоті, спектри водневоподібних атомів є добре дослідженими і описаними. Оскільки, як було описано вище, енергія електрона у водневоподібному атомі може приймати лише обмежений ряд значень, які, грубо, можна виразити як
- ,
де E0 — константа, що дорівнює -13,53 ев.
Атом випромінює, при переході електрона з одного енергетичного рівня на інший, а тому допустимі енергії такого випромінювання задаються формулою
- , де m,n — цілі числа.
Лінії часто для зручності групують у серії. Всередині кожної серії m — постійне.
Так, серія Лаймана відповідає переходам на нижню орбіталь. При таких переходах випромінюється енергія
- .
Відповідно, серія Бальмера відповідає переходам на другу орбіталь, серія Пашена — на третю, серія Брекета — на четверту, серія Пфунда — на п'яту і т.д.
При достатній роздільній здатності інтерферометра, можна побачити, що кожна лінія, насправді складається з кількох (іноді, великої кількості) розташованих поруч ліній. Причиною цього є наявність тонкої і надтонкої структури енергетичних рівнів.
Енергія збудження
Для того щоб перевести електрон на більш високоенергетичну орбіталь, потрібно передати йому ту саму кількість енергії, яку він випроменив би при зворотному переході.
Перехід електрона з першої орбіталі, енергія на якій є найнижчою, на будь-яку вищу називається збудженням. Найменша енергія, яку треба передати атому для переведення в збуджений стан дорівнює Z2·13,53·(1-1/22)=Z2·10,15 ев. [9]
Також, це означає, що якщо незбуджений атом будь-яким чином отримує енергію, меншу за це значення, то його внутрішня енергія не може змінитися — удар буде абсолютно пружним. Для прикладу, середня енергія теплового руху атомів при кімнатній температурі дорівнює 0,04 ев.[10]
Енергія іонізації
Іонізацією називають відрив електрона від атома. Фактично, енергія, що потрібна для цього дорівнює потенціальній енергії електрона, взятій зі зворотнім знаком. Для незбудженого атома ця енергія дорівнює E=Z2·13,53 ев.[9]
Магнітне поле
Електрон у атомі має кінетичну енергію, тобто рухається навколо ядра, а отже, створює магнітне поле. При цьому, просторовий розподіл заряду є стабільним (у випадку незбудженого електрона), тому електричне поле електрону, а відповідно, і його магнітне поле, не змінюються з часом — електрон не випромінює.
Таким чином, спрощуючи, орбіту електрона можна уявити як замкнений контур, по якому тече постійний струм, тобто соленоїд.
Магнітний момент, що створюється електроном з головним квантовим числом n в такому випадку дорівнює
- ,
де μB — магнетон Бора, що дорівнює 9,27·10-24 Дж/Τ. Магнітний момент, що створюється електроном, в ціле число разів більший за магнетон Бора, тому він є природною одиницею вимірювання цієї величини.
В реальності картина магнітного поля електрона є складнішою через те, що орбіталь електрона є не пласким кільцем, а складною тривимірною фігурою. Відповідно, електрон у ній має три ступені свободи (а не одну, як у кільці), і магнітне поле залежить від трьох квантових чисел.
В основному, магнітне поле все одно задається головним квантовим числом n, проте, через поправки, що залежать від магнітного квантового числа m, кожному значенню n відповідає до 2n-1 близьких значень магнітного моменту.[11]
Некласичні системи
Багато інших систем, що не є атомами в класичному розумінні, демонструють подібний спектр енергій. До таких систем належать:
- Мюоній (електрон + антимюон)
- Позитроній (електрон + позитрон)
- Мюонний водень (протон + мюон)
- Піонний водень (протон + піон)
Рідбергові атоми, особливо, якщо збуджується зовнішній електрон атому лужного металу, є практично ідентичними водневоподібним.[12]
Примітки
- Уровни энергии и электромагнитные свойства водородоподобных атомов(рос.)
- Зісман, 1970, с. 308.
- Ігумнов, 2014, с. 60.
- Тонкая структура уровней атома водорода Архівовано 6 серпня 2017 у Wayback Machine.(рос.)
- Левіч, 1971, с. 485.
- Находкін, Харченко, 2012, с. 245.
- Сівухін, 1986, с. 278.
- лэмбовский сдвиг(рос.)
- Зісман, 1970, с. 311.
- Зісман, 1970, с. 312.
- Зісман, 1970, с. 316.
- Борщевський, 2010, с. 2.
Література
- Физическая энциклопедия / Под ред. А. М. Прохорова. — М. : Советская энциклопедия, 1988. — Т. 1. — 699 с.
- Г.А. Зисман, О.М. Тодес. Оптика, физика атомов и молекул, физика атомного ядра и микрочастиц // Курс общей физики. — 4-е. — М. : Наука, 1970. — Т. ΙΙΙ. — 500 с.
- Владимир Игумнов. Физические основы микроэлектроники. Учебное пособие. — Москва-Берлін : Дірект-Медіа, 2014. — 358 с. — ISBN 9785457975743.
- В.Г. Левич. Квантовая механика. Квантовая статистика и физическая кинетика. // Курс теоретической физики. — 2-е. — М. : Наука, 1971. — Т. ΙΙ. — 936 с.
- Находкін М.Г., Харченко Н.П.,. Атомна фізика. — Київ : Київ. нац. ун-т ім. Тараса Шевченка, 2012. — 551 с. — ISBN 978-966-439-385-7.
- Д.В. Сивухин. Атомная физика, ч.1. // Общий курс физики. — М. : Наука, 1986. — Т. V. — 426 с.
- А. Я. Борщевский. Строение атомных частиц. Водородоподобные атомы. — М. : Химический факультет МГУ, 2010. — 86 с.