Кіназа Aurora B
Кіназа Aurora B (англ. Aurora kinase B) – білок, який кодується геном AURKB, розташованим у людини на короткому плечі 17-ї хромосоми.[4] Довжина поліпептидного ланцюга білка становить 344 амінокислот, а молекулярна маса — 39 311[5]. Це фермент, який бере участь у контролі правильного приєднання центромер до веретена поділу під час мітозу.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MAQKENSYPW | PYGRQTAPSG | LSTLPQRVLR | KEPVTPSALV | LMSRSNVQPT | ||||
| AAPGQKVMEN | SSGTPDILTR | HFTIDDFEIG | RPLGKGKFGN | VYLAREKKSH | ||||
| FIVALKVLFK | SQIEKEGVEH | QLRREIEIQA | HLHHPNILRL | YNYFYDRRRI | ||||
| YLILEYAPRG | ELYKELQKSC | TFDEQRTATI | MEELADALMY | CHGKKVIHRD | ||||
| IKPENLLLGL | KGELKIADFG | WSVHAPSLRR | KTMCGTLDYL | PPEMIEGRMH | ||||
| NEKVDLWCIG | VLCYELLVGN | PPFESASHNE | TYRRIVKVDL | KFPASVPMGA | ||||
| QDLISKLLRH | NPSERLPLAQ | VSAHPWVRAN | SRRVLPPSAL | QSVA |
Цей білок за функціями належить до серин/треонінових протеїнкіназ. Задіяний у таких біологічних процесах, як клітинний цикл, поділ клітини. Білок має сайт для зв'язування з АТФ, іоном магнію. Локалізований у цитоплазмі, цитоскелеті, ядрі, хромосомах, центромерах.
Функція
Сегрегація хромосом під час мітозу знаходиться під контролем кіназ і фосфатаз. Кінази Aurora асоційовані з мікротрубочками під час збірки веретена поділу і його приєднання до хромосом. Кіназа Aurora B локалізована на мікротрубочках поблизу кінетохорів і контролює виникнення механічного напруження, яке виникає тільки у випадку правильного приєднання сестринських хроматид до протилежних полюсів веретена поділу.
В ракових клітинах спостерігається підвищена експресія кіназ цієї групи, внаслідок чого порушується контроль правильної сегрегації хромосом. В наслідок цього у ракових клітинах спостерігається прогресуюча анеуплодія.
Відкриття
Кіназа Aurora B була ідентифікована в 1998 році під час ПЛР-скринінгу кіназ які надлишково експресується в ракових клітинах.[6] В тому самому році кіназа Aurora B була ідентифікована в скринінг-тесті на кінази які змінюють проліферацію дріжджів S. cerevisiae коли надлишково експресовані.[7]
Експресія та локалізація в клітині
Рівень експресії, активність та субклітинна локалізація кінази Aurora B змінюється залежно від фази клітинного циклу. Експресія Aurora B сягає максимуму при переході від фази G2 до M, тоді як максимум активності спостерігається під час мітозу.[6]
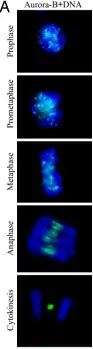
Кіназа Aurora B це сервісний протеїн який контролює правильне проходження хроматину через клітинний цикл. Зокрема, Aurora B локалізована на хромосомах під час профази, на центромерах під час прометафази та метафази, та в центрі веретена поділу в анафазі.[8] Локалізація була визначена за допомогою іммунофлуоресцентного забарвлення та флуоресцентної мікроскопії в людських клітинах, в C. elegans, та в Drosophila melanogaster. Більш детальне дослідження локалізації Aurora B в реальному часі було проведене в людських клітинах за допомогою штучного мічення Aurora B флуоресцентним білком.[9] Це дослідження показало що асоціація Aurora B з центромерами є динамічною, тобто одночасно з центромер-асоційованою Aurora B існує певна кількість Aurora B у цитоплазмі. Дослідження з використанням флуоресцентно-міченою кіназою також показало що вона асоційована з мікротрубочками веретена поділу під час анафази мітозу, внаслідок чого її мобільність суттєво знижується. Окрім цього, частина Aurora B локалізована неподалік від клітинної мембрани завдяки асоціації з астральними мікротрубочками.
Регуляція Aurora B
Aurora B в клітині взаємодіє з трьома іншими білками: з сурвівіном, бореаліном та INCENP. Кожен з цих компонентів є важливим для правильної локалізації та функції всього комплексу.[10] INCENP стимулює активність Aurora B, як, можливо, і сурвівін.[11]
Локалізація Aurora B на центромерах під час прометафази і метафази залежить від фосфорилювання кінетохор-специфічного варіанту гістону H3 (CENP-A).[12] CENP-A маркує центромерну ділянку хромосоми і є необхідним для правильного монтування кінетохрного комплексу білків на центромері. Фосфориляція CENP-A по серину 7 кіназою Aurora A є сигналом до залучення Aurora B до центромери.[13] В той же час Aurora B сама по собі може фосфорилювати той же самий серин на CENP-A якщо вона вже є асоційованою з центромерою.
На додачу до цього топоізомераза ІІ також бере участь у регуляції локалізації та активності Aurora B.[14] Ця регуляція може мати відношення до ролі топоізомерази ІІ в розлученні сестринських хроматид безпосередньо перед початком анафази. В клітинах з вимкненим геном топоізомерази II, Aurora B та INCENP так і не переміщаються до центру веретена поділу під час мітозу. Замість того, вони залишаються асоційованими з центромерами нероз*єднаних сестринських хроматид. Також, клітини без топоізомерази II мають набагато нижчу активність Aurora B. Інгібування Aurora B через відсутність топоізомерази II можливо залежить від активності BubR1 (див. нижче).
Було показано, що Aurora B зв'язується з білком EB1, що регулює динаміку мікротрубочок.[15] Непряма іммунофлуоресценція показала що Aurora B та EB1 я колокалізованими під час анафази рівно посередині веретена поділу під час цитокінезу. Надлишкова експресія EB1 підсилює активність Aurora B, можливо через те що EB1 блокує дезактивацію Aurora B протеїн фосфатазою 2A.
Роль в біорієнтації хромосом
Досліди в модельних організмах показали що Aurora B контролює правильну біорієнтацію хромосом, тобто те що сестринські хроматиди приєднані до різних полюсів веретена поділу.
Інгібування Aurora B за допомогою РНК інтерференції [16] або мікроінжекції блокуючих антитіл[17] негативно впливає на процес вирівнювання хромосом на екваторі клітини під час метафази. Інгібування Aurora B ймовірно призводить до збільшення кількості помилок під час приєднання мікротрубочок до кінетохору; наприклад таких коли обидві сестринські хроматиди приєднуються до одного й того самого полюсу.[18]
Численні мішені кінази Aurora В були знайдені в різних модельних організмах. Однією з них є CENP-A.[12] Фосфориляція CENP-A кіназою Aurora B сягає максимуму в прометафазі. Фактично, Aurora A фосфорилює той самий сайт на CENP-A що й Aurora B, при чому фосфориляція CENP-A Aurora A передує фосфориляції Aurora B.
Aurora B також взаємодіє з кінезином, асоційованим з мітотичною центромерою (MCAK). Aurora B та MCAK обоє локалізовані на внутрішній центромері під час прометафази.[19] Було показано що Aurora B залучає MCAK на центромеру та фосфорилює MCAK по багатьох положеннях.[20] Фосфориляція MCAK кіназою Aurora B обмежує здатність MCAK деполімеризувати мікротрубочки. Важливо, що інгібування MCAK призводить до неправильного приєднання кінетохору до мікротрубочок веретена поділу.[21]
Роль в конденсації та когезії хромосом
Aurora B відповідає за фосфориляцію гістона H3 по серину 10 під час мітозу.[22] Ця модифікація є консервативною від дріжджів (де кіназа відома як Ipl1) до людини. Слід зазначити що фосфорилювання H3 кіназою Aurora B не має відношення до конденсації хроматину. Хоча вона присутня у високій концентрації на центромерах, вона також диффузно розподілена по всьому хроматину.
В клітинах Drosophila «вимикання» кінази Aurora B порушую структуру та компакцію хромосом.[23] В цих клітинах, конденсин втрачає здатність зв'язувати хромосомну ДНК. Аналогічно, в C. elegans, активність конденсину залежить від Aurora B під час метафази.[24] Хоча, в екстракті ооцитів Xenopus, конденсація хроматину за участі конденсину відбуваєтьяс нормально навіть за відсутності Aurora B.[25] Аналогічно, після обробки клітин інгібіторами Aurora B (які виключають кіназну функцію, але не змінюють фізичну локалізацію Aurora B), конденденсин працює нормально.
Aurora B локалізується на спарених плечах гомологічних хромосом в метафазі І під час мейозу в C. elegans та змінює динаміку мікротрубочок в мітозі.[26] Вимкнення когезії між хроматидами, яке контролюється Aurora B, необхідне для переходу від метафази до анафази І та сегрегації гомологічних хромосом.[27] В мітотичних B-лімфоцитах, правильна центромерна локалізація партнерів Aurora B залежить від когезіну.[28]
Роль в цитокінезі
Комплекс Aurora B необхідний для цитокінезу у хордових, C. elegans, D. melanogaster, та дріжджах.
В різних модельних системах, надлишкова експресія каталітично неактивної Aurora B блокує цитокінез.[7] Порушення в цитокінезі можуть також виникнути від неправильної локалізації Aurora B через мутації в білках-партнерах.[29]
Мішенню Aurora B є також білки, які локалізовані в борозні розщеплення (the cleavage furrow), включаючи проміжні філаменти типу ІІІ,[30] десмін, та GFAP.[31] Як правило, фосфориляція дестабілізує проміжні філаменти. тому, було запропоновано що фосфорилювання проміжних філаментів в борозні розщеплення є етапом в підготовці до цитокінезу.[31] Дійсно, мутації в сайтах-мішенях Aurora B в проміжних філаментах призвели до дефектів останніх стадій цитокінезу.
Роль в контролі правильності веретена поділу
Перехід від метафази до анафази, яка є точкою неповернення в мітозі, можливий лише за проходження через контрольну точку яку фіксує правильну організацію веретена поділу (the spindle assembly checkpoint). Правильною є така організація, при якій кожна з хроматид з кожної пари сестринських хроматид приєднана до різних полюсів веретена поділу. При неправильній збірці веретена поділу, тобто при неможливості правильно приєднати хромосоми до полюсів поділу, процес мітозу має бути аварійно зупинений («заарештований»). Клітини без Aurora B нездатні переривати мітоз навіть за наявності грубих помилок у приєднанні хромосом.[32] Це призводить до постійно прогресуючого несиметричного розподілу хромосом при діленні таких клітин.
Aurora B може бути залучена до локалізації білків Mad2 та BubR1, які розпізнають коректність приєднання хромосом до мікротрубочок. Втрата Aurora B зменшує концентрацію Mad2 та BubR1 на кінетохорі. Aurora B також може бути відповідальною за підтримку локалізації Mad2 та BubR1 на кінетохорі після їх початкового залучення.[33] Aurora B може бути прямо або непрямо залучення до гіперфосфориляції BubR1.[34]
Білки-партнери
Aurora B взаємодіє з наступними наступними білками-партнерами:
Роль в розвитку раку
Аномально висока концентрація кінази Aurora B викликає помилки в розподіленні хромосом під час мітозу, що призводить до утворення клітин з аномальною кількістю хромосом (анеуплоїдія). Хромосомна нестабільність є одночасно і прчиною, і рушійною силою розвитку злоякісних новоутворень.
Література
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Wheatley S.P., Carvalho A., Vagnarelli P., Earnshaw W.C. (2001). INCENP is required for proper targeting of Survivin to the centromeres and the anaphase spindle during mitosis.. Curr. Biol. 11: 886 — 890. PubMed DOI:10.1016/S0960-9822(01)00238-X
- Zeitlin S.G., Shelby R.D., Sullivan K.F. (2001). CENP-A is phosphorylated by Aurora B kinase and plays an unexpected role in completion of cytokinesis.. J. Cell Biol. 155: 1147 — 1157. PubMed DOI:10.1083/jcb.200108125
- Nigg E.A. (2001). Mitotic kinases as regulators of cell division and its checkpoints.. Nat. Rev. Mol. Cell Biol. 2: 21 — 32. PubMed DOI:10.1038/35048096
- Goto H., Yasui Y., Nigg E.A., Inagaki M. (2002). Aurora-B phosphorylates Histone H3 at serine28 with regard to the mitotic chromosome condensation.. Genes Cells 7: 11 — 17. PubMed DOI:10.1046/j.1356-9597.2001.00498.x
- Honda R., Korner R., Nigg E.A. (2003). Exploring the functional interactions between Aurora B, INCENP, and survivin in mitosis.. Mol. Biol. Cell 14: 3325 — 3341. PubMed DOI:10.1091/mbc.E02-11-0769
Примітки
- Сполуки, які фізично взаємодіють з Aurora kinase B переглянути/редагувати посилання на ВікіДаних.
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:11390 (англ.). Процитовано 26 квітня 2018.
- UniProt, Q96GD4 (англ.). Процитовано 26 квітня 2018.
- Bischoff, J. R. et al.
- Terada, Y.et al.
- R.R. Adams, M. Carmena and W.C. Earnshaw, Chromosomal passengers and the (aurora) ABCs of mitosis, Trends Cell Biol. 11 (2001), pp. 49–54.
- Murata-Hori, M., Tatsuka, M. & Wang, Y. L. Probing the dynamics and functions of Aurora B kinase in living cells during mitosis and cytokinesis.
- R. Honda, R. Korner and E.A. Nigg, Exploring the functional interactions between B. Aurora, INCENP, and survivin in mitosis, Mol.
- J. Chen, S. Jin, S.K. Tahir, H. Zhang, X. Liu, A.V. Sarthy, T.P. McGonigal, Z. Liu, S.H. Rosenberg and S.C. Ng, Survivin enhances Aurora-B kinase activity and localizes Aurora-B in human cells, J. Biol.
- Zeitlin, S. G., Shelby, R. D. & Sullivan, K. F. CENP-A is phosphorylated by Aurora B kinase and plays an unexpected role in completion of cytokinesis.
- N. Kunitoku, T. Sasayama, T. Marumoto, D. Zhang, S. Honda, O. Kobayashi, K. Hatakeyama, Y. Ushio, H. Saya and T. Hirota, CENP-A phosphorylation by Aurora-A in prophase is required for enrichment of Aurora-B at inner centromeres and for kinetochore function, Dev.
- Coelho PA, Queiroz-Machado J, Carmo AM, Moutinho-Pereira S, Maiato H, et al. (2008) Dual Role of Topoisomerase II in Centromere Resolution and Aurora B Activity.
- Sun L., Gao J., Dong X., Liu M., Li D., Shi X., Dong J. T., Lu X., Liu C., Zhou J. (2008) Proc.
- Adams, R. R., Maiato, H., Earnshaw, W. C. & Carmena, M. Essential roles of Drosophila inner centromere protein (INCENP) and Aurora-B in histone H3 phosphorylation, metaphase chromosome alignment, kinetochore disjunction, and chromosome segregation.
- Kallio, M. J., McCleland, M. L., Stukenberg, P. T. & Gorbsky, G. J. Inhibition of aurora B kinase blocks chromosome segregation, overrides the spindle checkpoint, and perturbs microtubule dynamics in mitosis.
- Hauf, S.et al.
- L. Wordeman, M. Wagenbach and T. Maney, Mutations in the ATP-binding domain affect the subcellular distribution of mitotic centromere-associated kinesin (MCAK), Cell Biol.
- P.D. Andrews, Y. Ovechkina, N. Morrice, M. Wagenbach, K. Duncan, L. Wordeman and J.R. Swedlow, Aurora B regulates MCAK at the mitotic centromere, Dev.
- S.L. Kline-Smith, A. Khodjakov, P. Hergert and C.E. Walczak, Depletion of centromeric MCAK leads to chromosome congression and segregation defects due to improper kinetochore attachments, Mol.
- Hsu, J. Y.et al.
- Giet, R. & Glover, D. M. Drosophila Aurora B kinase is required for histone H3 phosphorylation and condensin recruitment during chromosome condensation and to organize the central spindle during cytokinesis.
- Crosio, C. et al.
- MacCallum, D. E., Losada, A., Kobayashi, R. & Hirano, T. ISWI remodeling complexes in Xenopus egg extracts: identification as major chromosomal components that are regulated by INCENP-aurora B. Mol.
- Kaitna, S., Pasierbek, P., Jantsch, M., Loidl, J. & Glotzer, M. The Aurora B kinase AIR-2 regulates kinetochores during mitosis and is required for separation of homologous chromosomes during meiosis.
- Rogers, E., Bishop, J. D., Waddle, J. A., Schumacher, J. M. & Lin, R. The aurora kinase AIR-2 functions in the release of chromosome cohesion in Caenorhabditis elegansmeiosis.
- Sonoda, E.et al.
- Mackay, A. M., Ainsztein, A., Eckley, D. M. & Earnshaw, W. C. A dominant mutant of inner centromere protein (INCENP), a chromosomal protein, disrupts prometaphase congression and cytokinesis.
- Goto, H.et al.
- Kawajiri, A. et al.
- S. Hauf, R.W. Cole, S. LaTerra, C. Zimmer, G. Schnapp, R. Walter, A. Heckel, J. vanMeel, C.L. Rieder and J.M. Peters, The small molecule Hesperadin reveals a role for Aurora B in correcting kinetochore–microtubule attachment and in maintaining the spindle assembly checkpoint, J. Cell Biol. 161 (2003), pp. 281—294.
- S.M. Lens, R.M. Wolthuis, R. Klompmaker, J. Kauw, R. Agami, T. Brummelkamp, G. Kops and R.H. Medema, Survivin is required for a sustained spindle checkpoint arrest in response to lack of tension, EMBO J. 22 (2003), pp. 2934—2947.
- C. Ditchfield, V.L. Johnson, A. Tighe, R. Ellston, C. Haworth, T. Johnson, A. Mortlock, N. Keen and S.S. Taylor, Aurora B couples chromosome alignment with anaphase by targeting BubR1, Mad2, and Cenp-E to kinetochores, J. Cell Biol. 161 (2003), pp. 267—280.
- Ryser S, Dizin E, Jefford CE, Delaval B, Gagos S, Christodoulidou A, Krause KH, Birnbaum D, Irminger-Finger I (February 2009). Distinct roles of BARD1 isoforms in mitosis: full-length BARD1 mediates Aurora B degradation, cancer-associated BARD1beta scaffolds Aurora B and BRCA2. Cancer Res. 69 (3). с. 1125–34. PMID 19176389. doi:10.1158/0008-5472.CAN-08-2134.
- Wheatley SP, Carvalho A, Vagnarelli P, Earnshaw WC (June 2001). INCENP is required for proper targeting of Survivin to the centromeres and the anaphase spindle during mitosis. Curr. Biol. 11 (11). с. 886–90. PMID 11516652. doi:10.1016/S0960-9822(01)00238-X.
- Chen J, Jin S, Tahir SK, Zhang H, Liu X, Sarthy AV, McGonigal TP, Liu Z, Rosenberg SH, Ng SC (January 2003). Survivin enhances Aurora-B kinase activity and localizes Aurora-B in human cells. J. Biol. Chem. 278 (1). с. 486–90. PMID 12419797. doi:10.1074/jbc.M211119200.
- Sampath SC, Ohi R, Leismann O, Salic A, Pozniakovski A, Funabiki H (July 2004). The chromosomal passenger complex is required for chromatin-induced microtubule stabilization and spindle assembly. Cell 118 (2). с. 187–202. PMID 15260989. doi:10.1016/j.cell.2004.06.026.
- Gassmann R, Carvalho A, Henzing AJ, Ruchaud S, Hudson DF, Honda R, Nigg EA, Gerloff DL, Earnshaw WC (July 2004). Borealin: a novel chromosomal passenger required for stability of the bipolar mitotic spindle. J. Cell Biol. 166 (2). с. 179–91. PMC 2172304. PMID 15249581. doi:10.1083/jcb.200404001.
- Delaval B, Ferrand A, Conte N, Larroque C, Hernandez-Verdun D, Prigent C, Birnbaum D (June 2004). Aurora B -TACC1 protein complex in cytokinesis. Oncogene 23 (26). с. 4516–22. PMID 15064709. doi:10.1038/sj.onc.1207593.