Острівцева кора
'Острівцева частка (лат. cortex insularis), або острівець (лат. insula — острівець)- частина кори головного мозку, яка знаходиться в глибині латеральної борозни (щілини, що відділяє скроневу частку від тім'яної і лобової частки, лат. sulcus lateralis).
| Острівцева частка | |
|---|---|
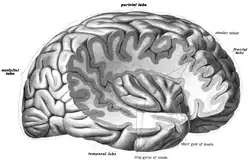 Острівцева частка правої півкулі мозку. | |
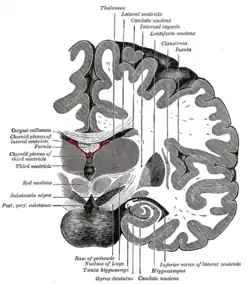 Вінцевий розтин навпроти мосту. Острівцева частка згори праворуч | |
| Деталі | |
| Артерія | Середня мозкова артерія |
| Ідентифікатори | |
| Латина | Cortex insularis |
| Анатомія Грея | subject #189 |
| NeuroNames | 111 |
| NeuroLex ID | birnlex_1117 |
| TA98 | A14.1.09.149 і A12.2.07.053 |
| TA2 | 5502 |
| FMA | 67329[1] |
| Анатомічна термінологія | |
Анатомія
Острівцева частка центральною інсулярною борозною (лат. sulcus centralis insulae) ділиться на дві частини: велику передню і меншу задню (в якій виявлено більше десятка окремих зон). Ділянка великої кори, яка покриває інсулу латеральніше утворює кришечку (лат. operculum або Pars opercularis) і формуються з частини прилеглих лобової, скроневої та тім'яної часток. Передня частина острівцевої частки розділена неглибокими борознами на три або чотири коротких звивини (лат. gyri brevi insulae). Задня частина острівцевої частки' сформована довгими звивинами (лат. gyri longi insulae).
З'єднання
Передні відділи острівцевої частки отримують прямі проекційні волокна з базальної частини вентральних медіальних ядер таламуса і оcобливо значну кількість волокон центрального ядра мігдалеподібного тіла. Крім того, передні відділи острівцевої частки самі шлють проекційні волокна до мігдалеподібного тіла.
В одному з досліджень на макаках резус виявлено взаємні (реципрокні) зв'язки між острівцевою часткою й майже всіма дрібними ядрами в мигдалеподібному комплексі. Задні відділи острівцевої частки шлють проекційні волокна переважно до центральної й до дорсально-латеральної частини мигдалеподібного ядра. Тоді як передні відділи острівцевої частки шлють проекційні волокна до передньої ділянки мигдалеподібного тіла, а також медіального, кортикального, додаткового базального магноцеллюлярного, медіального базального, та латерального мигдалеподібного ядер.[2]
Задня острівцева частка взаємопоєднана з вторинною соматосенсорною корою й отримує вхідні сигнали від вентральних задньо-нижніх ядер таламуса, які в свою чергу, одержують вхідну інформацію від спіноталамічного шляху. Крім того, було виявлено, що цей регіон отримує вхідні імпульси від вентромедиальнго ядра (задня частина таламуса), вузькоспеціалізованого на передачі гомеостатичної інформації, — больової, тактильної температурної чутливості, локального кисневого статусу, свербіжу тощо.[3]
Нейровізуалиізаційні дослідження з використанням т. зв. дифузійної МРТ показали, що в передня інсула взаємопов'язана з зонами в скроневій і потиличній частках, оперкулярною й фронтоорбітальною корою, трикутною й оперкулярною частинами лобової частки. Те саме дослідження виявило відмінності в анатомічних моделях з'єднань між лівою й правою півкулею.
«Циркулярна острівцева борозна»[4] — це напівкругла борозна, яка відокремлює острівець від сусідніх звивин кришечки (лат. operculum)[5] спереду, згори і ззаду.
Цитоархитектоніка
В острівцевій частці виявлені ділянки з різною клітинною структурою чи цитоархиітектонікою, зокрема, гранулярноклітинні в задній частині й агранулярноклітинні в передній. Джон Оллман і його колеги показали, що передня острівцева частка містить популяцію т. зв. веретеноподібних нейронів. Вони також називаються нейронами фон Економо.[6]
Поля Бродмана
Відповідно до класифікації цитоархітектонічних полів кори Бродмана, острівцева ділянка кори головного мозку містить Поле Бродмана 13, Поле Бродмана 14, Поле Бродмана 16, а також поле 44.
Розвиток
Деякі дослідники вважають, що острівцева кора розвивається з окремої частки кінцевого мозку (лат. telencephalon). Інші джерела вважають її похідною зі скроневої частки. В більшості досліджень острівцева кора вважається відносно старою структурою.[7][8]
Функції
Обробка мультимодальної сенсорної інформації
Функціональні візуалізаційні дослідження показують активацію острівцевої кори впродовж виконання інтеграційних аудіо-візуальних завдань[9][10]
Інтероцептивне самоусвідомлення (усвідомлення тілесних відчуттів)
Є свідчення, що на додаток до своєї базової функції, острівець може грати роль в здійсненні деяких «вищих» функцій, які працюють тільки у людей і приматів. Веретеноподібні нейрони знайдені в більш високій щільності в лобовій корі і передній поясній корі правої півкулі (ще одному регіоні, який досяг високого рівня спеціалізації у людиноподібних мавп). Було припущення, що ці нейрони беруть участь у когнітивно-емоційних процесах, характерних для приматів, включаючи людиноподібних мавп, таких як співпереживання і метакогнітивні, емоційні переживання. Це підтверджується результатами функціональної візуалізації й показує, що структура і функція правої передньої острівцевої кори корелюється з умінням відчувати своє серцебиття, або співчувати чужому болю. Вважається, що ці функції не відрізняються від «нижчих» острівцевих функцій, а швидше виникають як наслідок ролі острівцевої кори в усвідомленні гомеостатичної інформації.[11][12] Права передня інсула допомагає iнтероцептивному усвідомленню тілесних відчуттів, таких, як уміння оцінити власне серцебиття. Крім того, обсяг сірої речовини в правій передній інсулі корелює, з підвищеною точністю, як із подібними суб'єктивними внутрішніми тілесними відчуттями, так і з негативними емоційними переживаннями[13]. Острівцева кора також бере участь у контролі артеріального тиску[14], зокрема, впродовж і після тренування, окрім того його активність залежить від величини усвідомлених докладених зусиль[15][16]. Визначено, що острівцева кора грає роль в досвіді тілесної самосвідомості[17][18], відчуття приналежності всього тіла та його окремих частин[19][20]. Інші види інтероцептивного сприйняття, за які відповідальна острівцева кора — пасивне прослуховування музики, сміх і плач, співчуття і емпатія, і мови.
Острівцева кора також є місцем, в якому оцінюється відчуття[21]. і яке реагує, коли людина відчуває біль при погляді на зображення болючих подій, як ніби це відбувається з її власним тілом[22] Права передня інсула бере участь у сприйнятті ступеню тепла й холоду (без больових відчуттів) на шкірі. Інші внутрішні відчуття, що обробляються в інсулі — відчуття повноти шлунка й здуття живота. Повний сечовий міхур також активує острівцеву кору.[23][24][25][26][27][28]
Одне з томографічних досліджень показало, що неприємне відчуття задишки проходить обробку в острівцевій корі й мигдалеподібному тілі[29]
Кіркова обробка вестибулярного відчуття (рівноваги) проходить також в острівцевій корі[30] , тому при невеликих пошкодженнях передньої інсули у пацієнта може виникнути запаморочення[31].
Інші інтероцептивні сприйняття, які проходять обробку в інсулярній корі — пасивне прослуховування музики[32], сміх і плач[33], співчуття і емпатія[34], мова[35]
Контроль моторики
Острівцева кора сприяє рухам рук і очей[36][37], ковтанню[38][39] , моториці шлунку[39], і мовній артикуляції[40][41]. Дослідження інсули показали, що вона — «Центральний командний центр», який перевіряє, чи серцевий ритм і кров'яний тиск збільшилися на початку вправи[42]. Дослідження інсулярної кори впродовж розмови показало її пов'язаність зі здібностями до тривалого мовлення й складних фраз[43]. Острівцева кора також задіяна в процесі навчання рухам[44] і була визначена як така, що відіграє помітну роль в одужанні й відновленні рухових функцій після інсульту[45].
Гомеостаз
Важливу роль відіграє острівцева кора у виконанні різних гомеостатичних функцій, пов'язаних зі здійсненням основних життєвих потреб, таких як смакові, вісцеральні відчуття. Контроль вегетативних функцій здійснюється шляхом регуляції симпатичної і парасимпатичної систем[46][47]. Відзначена також і її роль у регуляції імунної системи[48][49][50].
Емоції
Острівцева кора, зокрема її передня частина, вважається пов'язаною з лімбічною системою. Інсула все частіше стає об'єктом уваги через її роль у тілесному самоусівдомленні й емоційній сфері. Зокрема, Антоніо Дамасіо (Antonio Damasio) запропонував тезу про те, що цей регіон мозку відіграє важливу роль у визначенні вісцеральних станів, пов'язаних із емоційними переживаннями. Це, по суті, нейробіологічна розробка ідей Вільяма Джеймса, який першим припустив, що суб'єктивний емоційний досвід (тобто почуття) виникають від інтерпретації нашим мозком тілесних станів, які викликали емоційні події. Це приклад втіленого пізнання.
З точки зору функції, вважається, що інсула виробляє емоційно-релевантний контекст для чуттєвого досвіду. Щоб бути точним, передня інсула більшою мірою пов'язана з нюховими, смаковими, вегетативними й лімбічними функціями, в той час як задня острівцева кора має відношення скоріше до слухових, соматосенсорних і скелетомоторних функцій. Експерименти з залученням функціонально-візуалізаційних методів показали, що інсула відіграє важливу роль в досвіді болю й досвід ряду базових емоцій, включаючи гнів, страх, відразу, щастя й печаль[51].
Вважається, що передня острівцева кора відповідає за емоційні переживання, в тому числі материнської і романтичної любові, гніву, страху, печалі, щастя, сексуального збудження, відрази, ворожості, несправедливості, обурення, невпевненості,[52] , зневіри, соціальної ізоляції, довіри, співпереживання, скульптурної краси, стану єднання з Богом, і стану галюцинації[53] .
Соціальні емоції
В острівцевій корі проходять процеси обробки відчуття відрази як до запахів[54] так і до вигляду бруду й каліцтва[55] — навіть уявних[56]. В аспекті соціального досвіду острівцева кора бере участь в обробці інформації щодо порушення загальноприйнятих норм поведінки[57] , емоційних процесів[58], емпатії[59] й оргазму[60]. Виявлена активність інсули при прийнятті соціальних рішень. Tizianna Quarto і співавт. виміряли емоційний інтелект (ЕІ) (здатність виявляти, регулювати і обробляти емоції). Було обстежено шістдесят три здорових піддослідних. Емоційний інтелект (ЕІ) був виміряний у кореляції з лівою інсулярною активністю з використанням функціональної МРТ. Піддослідним показували різні фотографії людей з мімікою, що відповідає різним емоціям і доручено вирішувати: вибирати або ігнорувати людину на фотографії. Результати завдань з прийняття соціальних рішень показали активацію при цьому острівцевої кори[61].
Клінічне значення
Вважається, що острівцева кора бере участь у функціонуванні свідомості і відіграє важливу роль у здійсненні різних функцій, як правило, пов'язаних з регуляцією гомеостазу та емоціями. Серед функцій острівцевої кори, зокрема: сприйняття, моторний контроль, самосвідомість, пізнання та міжособовий досвід. Звідси й її роль у відповідних психопатологічних процесах.
Прогресуюча експресивна афазія
Вид семантичної афазії. При прогресуючій експресивній афазії відбувається погіршення нормальної мовної функції, яке призводить до втрати здатності до вільного спілкування при збереженій здатності розуміти окремі слова й інтактних нелінгвістичних когнітивних функціях. Зустрічається при різноманітних дегенеративних неврологічних захворюваннях, у тому числі хворобі Піка, хворобі моторного нейрона, кортікобазальній дегенерації, лобово-скроневій деменції, хворобі Альцгеймера. Це пов'язано з гіпометаболізмом[62] і атрофією лівої передньої острівцевої кори[63].
Залежність
- Див. Залежність
Ряд функціональних досліджень зображень мозку показали, що острівцева кора активується, коли особи, які зловживають наркотиками, піддаються впливу оточення й сигналів, які викликають потяг до вживання. Це було показано для різних наркотиків, включаючи кокаїн, алкоголь, опіати й нікотин. Незважаючи на ці висновки, острівцева кора була проігнорована в наркологічній літературі.
Дослідження, опубліковане в 2007 році показало, що сигаретні курці, які мають пошкодження острівцевої кори, від інсульту, наприклад, позбуваються своєї пристрасті до сигарет[64]. Це було підтверджено й більш новими дослідженнями[65][66][67]. Це робить острівцеву кору перспективною ділянкою для нових досліджень і мішенню для нових анти-наркотичних препаратів.[68][69]
Інші клінічні стани
Острівцева кора вважається такою, що відіграє роль у виникненні й перебігу таких хворобливих станів, як тривожних розладів[70], емоційних дисфункцій[71], анорексії[72].
Історія
Острівцева кора була вперше описана Йоганом Крістіаном Райлем (нім. Johann Christian Reil) серед інших мозкових утворень[73]. Генрі Грей у всесвітньо відомій «Анатомії Грея» назвав це утворення Островом Райля.[73]
Додаткові зображення
 Інсула лівої півкулі
Інсула лівої півкулі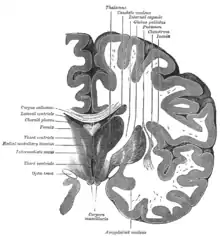 Вінцевий розтин мозку через третій шлуночок.
Вінцевий розтин мозку через третій шлуночок.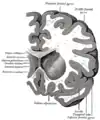 Вінцевий розтин через передній ріг бічних шлуночків.
Вінцевий розтин через передній ріг бічних шлуночків.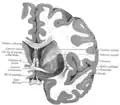 Вінцевий розтин мозку через передню спайку.
Вінцевий розтин мозку через передню спайку.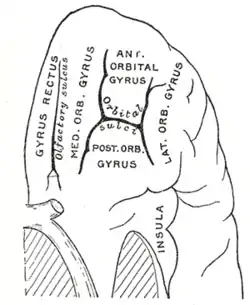 Орбітальна поверхня лівої лобової частки.
Орбітальна поверхня лівої лобової частки.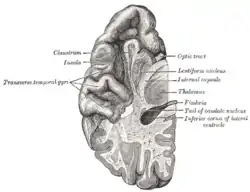 Ділянка мозку, що показує верхню поверхню скроневої частки.
Ділянка мозку, що показує верхню поверхню скроневої частки.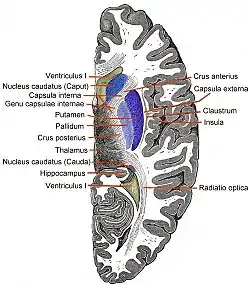 Горизонтальний розтин лівої півкулі головного мозку.
Горизонтальний розтин лівої півкулі головного мозку._section_description_2.JPG.webp) Фронтальний розтин людського мозку
Фронтальний розтин людського мозку Поперечні скроневі й острівцеві звивини
Поперечні скроневі й острівцеві звивини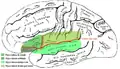 Кришечка лат. operculum
Кришечка лат. operculum
Посилання
- Foundational Model of Anatomy
- MUFSON, E; MESULAM, M; PANDYA, D (1 липня 1981). Insular interconnections with the amygdala in the rhesus monkey. Neuroscience 6 (7): 1231–1248. PMID 6167896. doi:10.1016/0306-4522(81)90184-6.
- Craig AD, Chen K, Bandy D, Reiman EM, 2000 Thermosensory activation of insular cortex, Nat. Neurosci, volume3, issue2, pages=184–90
- Johannes Sobotta. Sobotta's Atlas and Text-book of human anatomy 1909. Sobotta's Atlas and Text-book of human anatomy 1909. с. 145. Процитовано 10 листопада 2013.
- Definition: 'Circular Sulcus Of Insula'. MediLexicon. Процитовано 30 березня 2012.
- Bauernfeind A (April 2013). A volumetric comparison of the insular cortex and its subregions in primates. Human Evolution 64 (4): 263–279. PMC 3756831. doi:10.1016/j.jhevol.2012.12.003.
- Brain, MSN Encarta. Archived 2009-10-31.
- Kolb, Bryan; Whishaw, Ian Q. (2003). Fundamentals of human neuropsychology (вид. 5th). [New York]: Worth. ISBN 0-7167-5300-6.
- Bushara, Khalaf e t al (2001 Jan 1). Neural correlates of auditory-visual stimulus onset asynchrony detection.. J Neurosci 21 (1): 300–4. PMID 11150347.
- Bushara, Khalaf et al (2003 Feb). Neural correlates of cross-modal binding.. Nat Neurosci. 6 (2): 190–5. PMID 12496761. doi:10.1038/nn993.
- Benedetto De Martino; Dharshan Kumaran; Ben Seymour; Raymond J. Dolan (August 2006). Frames, Biases, and Rational Decision-Making in the Human Brain. Science 313 (6): 684–687. Bibcode:2006Sci...313..684D. PMC 2631940. PMID 16888142. doi:10.1126/science.1128356.
- Gui Xue; Zhonglin Lu; Irwin P. Levin d; Antoine Bechara (2010). The impact of prior risk experiences on subsequent risky decision-making: The role of the insula. NeuroImage 50 (2): 709–716. PMC 2828040. PMID 20045470. doi:10.1016/j.neuroimage.2009.12.097.
- Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ |title=Neural systems supporting interoceptive awareness. Nat. Neurosci. v7 issue2 pg189–95, February 2004
- Lamb K, Gallagher K, McColl R, Mathews D, Querry R, Williamson JW. Exercise-induced decrease in insular cortex rCBF during postexercise hypotension.Med Sci Sports Exerc v39, issue4, pages672–9, April 2007|url=http://meta.wkhealth.com/pt/pt-core/template-journal/lwwgateway/media/landingpage.htm?issn=0195-9131&volume=39&issue=4&spage=672
- Williamson JW, McColl R, Mathews D, Mitchell JH, Raven PB, Morgan WP., Hypnotic manipulation of effort sense during dynamic exercise: cardiovascular responses and brain activation., J. Appl. Physiol. volume90, issue4, pages1392–9., April 2001|url=http://jap.physiology.org/cgi/content/full/90/4/1392
- Williamson JW, McColl R, Mathews D, Ginsburg M, Mitchell JH., Activation of the insular cortex is affected by the intensity of exercise.,J. Appl. Physiol. volume87., issue3 pages1213–9 September 1999|url=http://jap.physiology.org/cgi/content/full/87/3/1213
- Karnath HO, Baier B, Nägele T |title=Awareness of the functioning of one's own limbs mediated by the insular cortex? J. Neurosci. volume25 issue31 pages=7134–8, August 2005.,JNEUROSCI.1590-05.2005 |url=http://www.jneurosci.org/cgi/pmidlookup?view=long&pmid=16079395
- Craig AD., How do you feel—now? The anterior insula and human awareness ., Nature Reviews Neuroscience volume10 issue=1, pages59–70 January 2009
- Farrer C, Frith CD., Experiencing oneself vs another person as being the cause of an action: the neural correlates of the experience of agency., NeuroImage volume15 issue3 pages596–603, March 2002 |url=http://linkinghub.elsevier.com/retrieve/pii/S1053811901910092
- Tsakiris M, Hesse MD, Boy C, Haggard P, Fink GR., Neural signatures of body ownership: a sensory network for bodily self-consciousness., Cereb. Cortex, volume17 issue10 pages2235–44, October 2007|url=http://cercor.oxfordjournals.org/cgi/pmidlookup?view=long&pmid=17138596
- Baliki MN, Geha PY, Apkarian AV., Parsing pain perception between nociceptive representation and magnitude estimation, J. Neurophysiol. volume101 issue2 pages875–87., February 2009|url=http://jn.physiology.org/cgi/pmidlookup?view=long&pmid=19073802
- Ogino Y, Nemoto H, Inui K, Saito S, Kakigi R, Goto F, Inner experience of pain: imagination of pain while viewing images showing painful events forms subjective pain representation in human brain., Cereb. Cortex volume17 issue5 pages1139–46, May 2007|url=http://cercor.oxfordjournals.org/cgi/reprint/17/5/1139
- Song GH, Venkatraman V, Ho KY, Chee MW, Yeoh KG, Wilder-Smith CH., Cortical effects of anticipation and endogenous modulation of visceral pain assessed by functional brain MRI in irritable bowel syndrome patients and healthy controls journal=Pain volume126 issue1–3 pages79–90, December 2006|url=http://linkinghub.elsevier.com/retrieve/pii/S0304-3959(06)00340-X
- Olausson H, Charron J, Marchand S, Villemure C, Strigo IA, Bushnell MC |title=Feelings of warmth correlate with neural actникаivity in right anterior insular cortex., Neurosci. Lett. volume389 issue1 pages1–5 November 200|url=http://linkinghub.elsevier.com/retrieve/pii/S0304-3940(05)00742-1
- Craig AD, Chen K, Bandy D, Reiman EM., Thermosensory activation of insular cortex., Nat. Neurosci. volume3 issue2 pages184–90., February 2000
- Ladabaum U, Minoshima S, Hasler WL, Cross D, Chey WD, Owyang C., Gastric distention correlates with activation of multiple cortical and subcortical regions., Gastroenterology volume120 issue2 pages369–76 February 2001|url=http://linkinghub.elsevier.com/retrieve/pii/S0016508501699906
- Hamaguchi T, Kano M, Rikimaru H, etal., Brain activity during distention of the descending colon in humans., Neurogastroenterol. Motil.vol16 issue3 pages299–309., June 2004|url=http://www3.interscience.wiley.com/resolve/openurl?genre=article&sid=nlm:pubmed&issn=1350-1925&date=2004&volume=16&issue=3&spage=299%5Bнедоступне+посилання+з+квітня+2019%5D
- Matsuura S, Kakizaki H, Mitsui T, Shiga T, Tamaki N, Koyanagi T., Human brain region response to distention or cold stimulation of the bladder: a positron emission tomography study., J. Urol.vol168, issue5, pages2035–9, November 2002|url=http://linkinghub.elsevier.com/retrieve/pii/S0022-5347(05)64290-5
- Leupoldt, A., Sommer, T., Kegat, S., Baumann, H. J. at al., The Unpleasantness of Perceived Dyspnea Is Processed in the Anterior Insula and Amygdala, American Journal of Respiratory and Critical Care Medicine, 24 January 2008, volume177, issue9, pages1026–1032 |pmid=18263796|url=http://171.66.122.149/content/177/9/1026.full.pdf+html%5Bнедоступне+посилання+з+квітня+2019%5D
- Kikuchi M, Naito Y, Senda M, etal : Cortical activation during optokinetic stimulation — an fMRI study., Acta Otolaryngol, v129, is4, pages440–3, April 2009 |url=http://www.informaworld.com/openurl?genre=article&doi=10.1080/00016480802610226&magic=pubmed
- Papathanasiou ES, Papacostas SS, Charalambous M, Eracleous E, Thodi C, Pantzaris M: Vertigo and imbalance caused by a small lesion in the anterior insula.E, lectromyogr Clin Neurophysiol., volume46, issue3, pages185–92., 2006
- Brown S, Martinez MJ, Parsons LM: Passive music listening spontaneously engages limbic and paralimbic systems., NeuroReport, volume15, issue13, pages2033–7., September 2004|url=http://meta.wkhealth.com/pt/pt-core/template-journal/lwwgateway/media/landingpage.htm?issn=0959-4965&volume=15&issue=13&spage=2033
- Sander K, Scheich H: Left auditory cortex and amygdala, but right insula dominance for human laughing and crying., J Cogn Neurosci, volume=17, issue=10, pages=1519–31, October 2005|url=http://www.mitpressjournals.org/doi/abs/10.1162/089892905774597227
- Архівована копія. Архів оригіналу за 14 липня 2010. Процитовано 1 лютого 2017.
- Bamiou DE, Musiek FE, Luxon LM (May 2003). The insula (Island of Reil) and its role in auditory processing. Literature review. Brain Res. Brain Res. Rev. 42 (2): 143–54. PMID 12738055. doi:10.1016/S0165-0173(03)00172-3.
- Anderson TJ, Jenkins IH, Brooks DJ, Hawken MB, Frackowiak RS, Kennard C (October 1994). Cortical control of saccades and fixation in man. A PET study. Brain 117 (Pt 5): 1073–84. PMID 7953589. doi:10.1093/brain/117.5.1073.
- Fink GR, Frackowiak RS, Pietrzyk U, Passingham RE (April 1997). Multiple nonprimary motor areas in the human cortex. J. Neurophysiol. 77 (4): 2164–74. PMID 9114263.
- Sörös P, Inamoto Y, Martin RE (August 2009). Functional brain imaging of swallowing: an activation likelihood estimation meta-analysis. Hum Brain Mapp 30 (8): 2426–39. PMID 19107749. doi:10.1002/hbm.20680.
- Penfield W, Faulk ME (1955). The insula; further observations on its function. Brain 78 (4): 445–70. PMID 13293263. doi:10.1093/brain/78.4.445.
- Dronkers NF (November 1996). A new brain region for coordinating speech articulation. Nature 384 (6605): 159–61. Bibcode:1996Natur.384..159D. PMID 8906789. doi:10.1038/384159a0.
- Ackermann H, Riecker A (May 2004). The contribution of the insula to motor aspects of speech production: a review and a hypothesis. Brain Lang 89 (2): 320–8. PMID 15068914. doi:10.1016/S0093-934X(03)00347-X.
- Nowak M, Holm S, Biering-Sørensen F, Secher NH, Friberg L (June 2005). "Central command" and insular activation during attempted foot lifting in paraplegic humans. Hum Brain Mapp 25 (2): 259–65. PMID 15849712. doi:10.1002/hbm.20097.
- Borovsky A, Saygin AP, Bates E, Dronkers N (June 2007). Lesion correlates of conversational speech production deficits. Neuropsychologia 45 (11): 2525–33. PMID 17499317. doi:10.1016/j.neuropsychologia.2007.03.023.
- Mutschler I, Schulze-Bonhage A, Glauche V, Demandt E, Speck O, Ball T (2007). A rapid sound-action association effect in human insular cortex. У Fitch, Tecumseh. PLoS ONE 2 (2): e259. Bibcode:2007PLoSO...2..259M. PMC 1800344. PMID 17327919. doi:10.1371/journal.pone.0000259.
- Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS (February 1993). Individual patterns of functional reorganization in the human cerebral cortex after capsular infarction. Annals of Neurology 33 (2): 181–9. PMID 8434880. doi:10.1002/ana.410330208.
- Oppenheimer SM, Gelb A, Girvin JP, Hachinski VC (September 1992). Cardiovascular effects of human insular cortex stimulation. Neurology 42 (9): 1727–32. PMID 1513461. doi:10.1212/wnl.42.9.1727.
- Critchley HD (December 2005). Neural mechanisms of autonomic, affective, and cognitive integration. J. Comp. Neurol. 493 (1): 154–66. PMID 16254997. doi:10.1002/cne.20749.
- Pacheco-López G, Niemi MB, Kou W, Härting M, Fandrey J, Schedlowski M (March 2005). Neural substrates for behaviorally conditioned immunosuppression in the rat. J. Neurosci. 25 (9): 2330–7. PMID 15745959. doi:10.1523/JNEUROSCI.4230-04.2005.
- Ramírez-Amaya V, Alvarez-Borda B, Ormsby CE, Martínez RD, Pérez-Montfort R, Bermúdez-Rattoni F (June 1996). Insular cortex lesions impair the acquisition of conditioned immunosuppression. Brain Behav. Immun. 10 (2): 103–14. PMID 8811934. doi:10.1006/brbi.1996.0011.
- Ramírez-Amaya V, Bermúdez-Rattoni F (March 1999). Conditioned enhancement of antibody production is disrupted by insular cortex and amygdala but not hippocampal lesions. Brain Behav. Immun. 13 (1): 46–60. PMID 10371677. doi:10.1006/brbi.1998.0547.
- Wager, Tor (June 2002). Functional Neuroanatomy of Emotion: A Meta-Analysis of Emotion Activation Studies in PET and fMRI. NeuroImage 16 (2): 331–48. PMID 12030820. doi:10.1006/nimg.2002.1087.
- Vilares I, Howard JD, Fernandes HL, Gottfried JA, Kording KP (2012). Differential Representations of Prior and Likelihood Uncertainty in the Human Brain. Current Biology 22 (18): 1641–1648. PMC 3461114. PMID 22840519. doi:10.1016/j.cub.2012.07.010.
- Craig, A. D. (Bud) (2009). How do you feel — now? The anterior insula and human awareness. Nature Reviews Neuroscience 10 (1): 59–70. PMID 19096369. doi:10.1038/nrn2555. Архів оригіналу за 7 січня 2013. Процитовано 6 лютого 2017.
- Wicker B, Keysers C, Plailly J, Royet JP, Gallese V, Rizzolatti G (October 2003). Both of us disgusted in My insula: the common neural basis of seeing and feeling disgust. Neuron 40 (3): 655–64. PMID 14642287. doi:10.1016/S0896-6273(03)00679-2.
- Wright P, He G, Shapira NA, Goodman WK, Liu Y (October 2004). Disgust and the insula: fMRI responses to pictures of mutilation and contamination. NeuroReport 15 (15): 2347–51. PMID 15640753. doi:10.1097/00001756-200410250-00009.
- Jabbi M, Bastiaansen J, Keysers C (2008). A common anterior insula representation of disgust observation, experience and imagination shows divergent functional connectivity pathways. У Lauwereyns, Jan. PLoS ONE 3 (8): e2939. Bibcode:2008PLoSO...3.2939J. PMC 2491556. PMID 18698355. doi:10.1371/journal.pone.0002939.
- Sanfey AG, Rilling JK, Aronson JA, Nystrom LE, Cohen JD (June 2003). The neural basis of economic decision-making in the Ultimatum Game. Science 300 (5626): 1755–8. Bibcode:2003Sci...300.1755S. PMID 12805551. doi:10.1126/science.1082976.
- Phan KL, Wager T, Taylor SF, Liberzon I (June 2002). Functional neuroanatomy of emotion: a meta-analysis of emotion activation studies in PET and fMRI. NeuroImage 16 (2): 331–48. PMID 12030820. doi:10.1006/nimg.2002.1087.
- Singer T (2006). The neuronal basis and ontogeny of empathy and mind reading: review of literature and implications for future research. Neurosci Biobehav Rev 30 (6): 855–63. PMID 16904182. doi:10.1016/j.neubiorev.2006.06.011.
- Ortigue S, Grafton ST, Bianchi-Demicheli F (August 2007). Correlation between insula activation and self-reported quality of orgasm in women. NeuroImage 37 (2): 551–60. PMID 17601749. doi:10.1016/j.neuroimage.2007.05.026.
- Quarto, Tiziana; Blasi, Giuseppe; Maddalena, Chiara; Viscanti, Giovanna; Lanciano, Tiziana; Soleti, Emanuela; Mangiulli, Ivan; Taurisano, Paolo та ін. (9 лютого 2016). Association between Ability Emotional Intelligence and Left Insula during Social Judgment of Facial Emotions. PLoS ONE 11 (2): e0148621. ISSN 1932-6203. PMC 4747486. PMID 26859495. doi:10.1371/journal.pone.0148621.
- Nestor PJ, Graham NL, Fryer TD, Williams GB, Patterson K, Hodges JR (November 2003). Progressive non-fluent aphasia is associated with hypometabolism centred on the left anterior insula. Brain 126 (Pt 11): 2406–18. PMID 12902311. doi:10.1093/brain/awg240.
- Gorno-Tempini ML, Dronkers NF, Rankin KP, etal (March 2004). Cognition and anatomy in three variants of primary progressive aphasia. Annals of Neurology 55 (3): 335–46. PMC 2362399. PMID 14991811. doi:10.1002/ana.10825.
- Nasir H. Naqvi; David Rudrauf; Hanna Damasio; Antoine Bechara. (January 2007). Damage to the Insula Disrupts Addiction to Cigarette Smoking (abstract). Science 315 (5811): 531–4. Bibcode:2007Sci...315..531N. PMC 3698854. PMID 17255515. doi:10.1126/science.1135926.
- Vorel SR, Bisaga A, McKhann G, Kleber HD (July 2007). Insula damage and quitting smoking. Science 317 (5836): 318–9; author reply 318–9. PMID 17641181. doi:10.1126/science.317.5836.318c.
- Suner-Soler, R. (2011). Smoking Cessation 1 Year Poststroke and Damage to the Insular Cortex. Stroke 43 (1): 131–136. PMID 22052507. doi:10.1161/STROKEAHA.111.630004.
- Gaznick, N. (2013). Basal Ganglia Plus Insula Damage Yields Stronger Disruption of Smoking Addiction Than Basal Ganglia Damage Alone. Nicotine 16 (4): 445–453. doi:10.1093/ntr/ntt172.
- Hyman, Steven E. (1 серпня 2005). Addiction: A Disease of Learning and Memory (abstract). Am J Psychiatry 162 (8): 1414–22. PMID 16055762. doi:10.1176/appi.ajp.162.8.1414.
- Marco Contreras; Francisco Ceric; Fernando Torrealba (January 2007). Inactivation of the Interoceptive Insula Disrupts Drug Craving and Malaise Induced by Lithium (abstract). Science 318 (5850): 655–8. Bibcode:2007Sci...318..655C. PMID 17962567. doi:10.1126/science.1145590.
- Paulus MP, Stein MB (August 2006). An insular view of anxiety. Biol. Psychiatry 60 (4): 383–7. PMID 16780813. doi:10.1016/j.biopsych.2006.03.042.
- Thayer JF, Lane RD (December 2000). A model of neurovisceral integration in emotion regulation and dysregulation. J Affect Disord 61 (3): 201–16. PMID 11163422. doi:10.1016/S0165-0327(00)00338-4.
- Gaudio S, Wiemerslage L, Brooks SJ, Schiöth HB (2016). A systematic review of resting-state functional-MRI studies in anorexia nervosa: Evidence for functional connectivity impairment in cognitive control and visuospatial and body-signal integration.. Neurosci Biobehav Rev 71: 578–589. PMID 27725172. doi:10.1016/j.neubiorev.2016.09.032.
- Binder DK, Schaller K, Clusmann H (November 2007). The seminal contributions of Johann-Christian Reil to anatomy, physiology, and psychiatry. Neurosurgery 61 (5): 1091–6; discussion 1096. PMID 18091285. doi:10.1227/01.neu.0000303205.15489.23.