Сайленсинг генів
Сайленсинг генів (від. англ. gene silencing — пригнічення експресії генів, «приглушення», або «вимкнення» генів) — це регулювання експресії генів у клітині для запобігання експресії певного гена[1][2]. Сайленсинг генів може відбуватися під час транскрипції або трансляції і часто використовується в дослідженнях. Зокрема, все частіше застосовуються методи, що дозволяють вимикати гени для виробництва терапевтичних засобів для боротьби з раком та іншими захворюваннями, такими як інфекційні захворювання та нейродегенеративні розлади.
Термін «сайленсинг генів» часто використовують як синонім нокдауну генів[3][4]. Коли ген піддають сайленсингу, його експресія знижується . На противагу цьому, коли ген піддають нокауту, він повністю стирається з геному організму і, таким чином, не має експресії . Сайленсинг генів вважається механізмом нокдауну генів, оскільки методи, що застосовуються для сайленсингу, такі як RNAi, CRISPR або siRNA, як правило, знижують експресію гена щонайменше на 70 %, але повністю її не усувають. Методи, що використовують сайленсинг, часто є більш універсальними, ніж нокаут генів, оскільки вони дозволяють дослідникам вивчати гени, критично необхідні для виживання тваринних моделей, і які неможливо повністю видалити. Крім того, сайленсинг дає більш повне уявлення про розвиток захворювань, оскільки хвороби, як правило, пов'язані з генами, що мають знижену експресію.
Типи
Транскрипційний
- Геномний імпринтинг
- Парамутація
- Сайленсинг транспозону (або модифікації Гістона)
- Трансгенний сайленсинг
- Позиційний ефект
- РНК-спрямоване метилювання ДНК
Пост-транскрипційний
- РНК-інтерференція
- РНК-сайленсинг
- Нонсенс-опосередковане розпад
Мейотичний
- Трансвекція
- Мейотичнй сайленсинг непарної ДНК
Методи дослідження
Антисенсові олігонуклеотиди
Антисенсові (антисмислові) олігонуклеотиди були відкриті в 1978 році Полем Замєчником та Мері Стівенсон.[5] Олігонуклеотиди, що представляють собою короткі фрагменти нуклеїнової кислоти, зв'язуються з комплементарними молекулами мРНК-мішені, коли їх додають до клітини[6]. Ці молекули можуть складатися з одноланцюгової ДНК або РНК і, як правило, мають довжину 13–25 нуклеотидів[7]. Антисенсові олігонуклеотиди можуть впливати на експресію генів двома способами: за допомогою механізму РНКаза H- залежного механізму або за допомогою стеричного блокувального механізму . РНКаза-Н-залежні олігонуклеотиди викликають деградацію молекул-мішеней мРНК, тоді як олігонуклеотиди стеричних блокаторів перешкоджають трансляції молекули мРНК . Більшість антисмислових лікарських препаратів функціонують через РНКаза H-залежний механізм, в якому РНКаза H гідролізує нитку РНК гетеродуплексу ДНК/РНК . Цей механізм вважається більш ефективним, що призводить до зниження експресії білка та мРНК приблизно на 80 % до 95 %.
Рибозими
Рибозими - це каталітичні молекули РНК, які пригнічують експресію генів . Ці молекули працюють, розщеплюючи молекули мРНК, по суті піддаючи сайленсингу гени, що їх продукували. Сідні Альтман та Томас Чех вперше виявили каталітичні молекули РНК, РНКазу Р та інтронні рибозими групи II, у 1989 році та отримали Нобелівську премію за своє відкриття[8][9]. Існує кілька типів мотивів рибозимів, серед яких молоток, шпилька, вірус гепатиту дельта, група I, група II і рибозими РНКази Р. Мотиви рибозиму молотка, шпильки та вірусу гепатиту дельта (HDV) зазвичай зустрічаються у вірусах або вірусних РНК . Ці мотиви здатні самостійно розщеплювати специфічний фосфодіефірний зв'язок на молекулі мРНК . Нижчі еукаріоти та деякі бактерії містять рибозими I та II групи. Ці мотиви можуть сплайсингуватися самі з собою, розщеплюючи та з'єднуючь між собою фосфодіефіріи зв'язми . Останній з наведених мотивів рибозиму — рибозим РНКази Р — знайдено у Escherichia coli, він відомий своєю здатністю розщеплювати фосфодіефірні зв'язки кількох попередників тРНК під час приєднання до білкового кофактора .
РНК-інтерференція

Інтерференція РНК (RNAi) — це природний процес, що використовується клітинами для регулювання експресії генів. Він був відкритий в 1998 році Ендрю Файром та Крейгом Мелло, які отримали за своє відкриття Нобелівську премію в 2006 році. Процес сайленсингу генів спочатку починається з надходження в клітину дволанцюгової молекули РНК (dsRNA), яка запускає шлях РНКі. Потім дволанцюгова молекула розрізається на невеликі дволанцюгові фрагменти ферментом, який називається Dicer . Ці невеликі фрагменти, які включають невеликі інтерферуючі РНК (siRNA) та мікроРНК (miRNA), мають довжину приблизно 21–23 нуклеотидів. Фрагменти інтегруються в мульти-субодиничний білок, який називається РНК-індукованим комплексом сайленсингу, який містить білки Аргонавта, які є основними компонентами шляху РНКі . Один ланцюг молекули, який називається «направляючим» ланцюгом, зв'язується з RISC, а інший, відомий як «пасажирський» ланцюг, деградує. Направляючий, або антисенсовий ланцюг фрагмента, що залишається зв'язаним з RISC, спрямовує специфічний щодо послідовності сайленсинг молекули цільової мРНК. Гени можна піддати сайленсингу молекулами siRNA, які викликають ендонуклеотичне розщеплення цільових молекул мРНК, або молекулами miРНК, які пригнічують трансляцію молекули мРНК. З розщепленням або трансляційною репресією молекул мРНК гени, що їх утворюють, робляться по суті неактивними. Вважається, що РНКі розвинувся як механізм захисту клітин від проникнення чужорідних організмів, таких як РНК-віруси, або для боротьби з розповсюдженням транспозонів у ДНК клітини . І РНК-віруси, і транспозони можуть існувати як дволанцюгові РНК і призводити до активації РНКі. В даний час siRNA широко використовуються для пригнічення специфічної експресії генів та оцінки функції генів. Компанії, що використовують цей підхід, включають Alnylam, Sanofi, Arrowhead, Discerna, та Persomics.
Три основні області, які не транслюються, та мікроРНК
Три основні області, які не транслюються (3'UTR) матричних РНК (мРНК) часто містять регуляторні послідовності, які після транскрипції викликають сайленсинг генів. Такі 3'-UTR часто містять сайти зв'язування мікроРНК (miRNA), а також регуляторні білки. Зв'язуючи конкретні сайти в межах 3'-UTR, велика кількість специфічних міРНК знижує експресію генів своїх конкретних цільових мРНК шляхом інгібування трансляції, або безпосередньо викликаючи деградацію транскрипту, використовуючи механізм, подібний до інтерференції РНК (див. MicroRNA). 3'-UTR також може мати області сайленсера, які зв'язують репресорні білки, що інгібують експресію мРНК.
Застосування
Медичні дослідження
Методи сайленсингу генів широко використовуються дослідниками для вивчення генів, пов'язаних з хворобами. Ці розлади включають рак, інфекційні захворювання, респіраторні захворювання та нейродегенеративні розлади. В даний час генний сайленсинг також використовується в методах виявлення наркотиків, таких як синтетична летальність, високопродуктивний скринінг та мініатюрні екрани RNAi.
Рак
РНК-інтерференція використовується для сайленсингу генів, асоційованих з декількома видами раку. В in vitro дослідженнях хронічного мієлолейкозу (СМЛ) siРНК використовували для розщеплення злитого білка BCR-ABL, що перешкоджає зв'язку препарату Gleevec (іматиніб) з раковими клітинами[10]. Розщеплення злитого білку зменшувало кількість трансформованих кровотворних клітин, які поширюються по всьому організму за рахунок підвищення чутливості клітин до препарату . РНК-інтерференція може також використовуватися для націлювання на конкретні мутанти. Наприклад, siRNA були здатні специфічно зв'язуватися з молекулами супресору пухлини р53, що містять мутацію в одній точці, і знищувати її, залишаючи супресор дикого типу неушкодженим[11].
Віруси
Вірусні гени та гени клітин-хазяїнів, необхідні вірусам для розмноження або потрапляння в клітину, або які відіграють важливу роль у життєвому циклі вірусу, часто є мішенями для противірусної терапії. RNAi використовувалися для націлювання генів на кілька вірусних захворювань, таких як вірус імунодефіциту людини (ВІЛ) та гепатит[12][13]. Зокрема, siRNA була використана для замовчування первинного рецептора хемокінового рецептора ВІЛ 5 (CCR5)[14]. Це заважало вірусу потрапляти в лімфоцити периферичної крові людини та первинні гемопоетичні стовбурові клітини[15]. Подібна методика була використана для зменшення кількості виявленого вірусу в клітинах, інфікованих гепатитом В та С. При гепатиті В для сайленсингу поверхневого антигену вірусу гепатиту В використовували сайленсинг на основі siRNA, що призводило до зменшення кількості вірусних компонентів[16]. Крім того, методи siРНК, що застосовуються при гепатиті С, знижували кількість вірусу в клітині на 98 %[17][18].
Бактерії

На відміну від вірусів, бактерії не так чутливі до замовчування siRNA[19]. Передусім це пов'язано з тим, як розмножуються бактерії. Бактерії розмножуються поза клітиною-господарем і не містять необхідних механізмів для функціонування РНКі . Однак бактеріальні інфекції все-таки можна піддати сайленсингу з використанням siRNA шляхом націлення на ген клітин-господарів, які беруть участь у імунній відповіді, викликаній інфекцією, або шляхом націлювання на ген клітин-господарів, які опосередковують потрапляння бактерій у клітини[20]. Наприклад, siRNA використовували для зменшення кількості протизапальних цитокінів, експресованих у клітинах мишей, оброблених ліпополісахаридом (LPS)[21]. Зниження експресії запального цитокіну, фактора некрозу пухлини α (TNFα), у свою чергу, спричинило зменшення септичного шоку, якого зазнавали миші, які отримували ЛПС . Крім того, siRNA була використана для запобігання потрапляння бактерій, Psueomonas aeruginosa, до епітеліальних клітин легенів миші шляхом нокдауну гена кавеоліну-2 (CAV2)[22]. Таким чином, хоча механізми siRNA не можуть бути безпосередньо націлені на бактерії, вони все одно можуть бути уражені siRNA, коли націлені компоненти, що беруть участь у бактеріальній інфекції.
Респіраторні захворювання
Рибозими, антисмислові олігонуклеотиди та нещодавно РНКі використовувались для націлювання молекул мРНК, що беруть участь у розвитку астми[20][23]. Ці експерименти дозволили припустити, що siRNA можна використовувати для боротьби з іншими респіраторними захворюваннями, такими як хронічна обструктивна хвороба легень (ХОЗЛ) та муковісцидоз . ХОЗЛ характеризується гіперплазією келихоподібних клітин та гіперсекрецією слизу[24]. Виявлено, що секреція слизу знижується, якщо натрансформуючий фактор росту (TGF) -α націлити siRNA в епітеліальних клітинах NCI-H292 дихальних шляхів людини[25]. Крім гіперсекреції слизу, хронічне запалення та пошкоджена тканина легенів характерні для ХОЗЛ та астми. Вважається, що трансформуючий фактор росту TGF-β відіграє певну роль у цих проявах[26][27]. В результаті, коли інтерферон (IFN)-γ використовувався для нокдауну TGF-β, зменшувалися показникфіброзу легень, спричиненого пошкодженням та рубцюванням легеневої тканини[28][29].
Хвороба Гантінгтона
Хвороба Гантінгтона (HD) є результатом мутації гена білку гантінгтіну, яка викликає надлишок повторів CAG[30]. Потім ген утворює мутований білок гантінгтін з поліглютаміном, що повторюється поблизу амінного кінця молекули[31]. Ця хвороба невиліковна і, як відомо, викликає руховий, когнітивний та поведінковий дефіцити[32]. Дослідники розглядали можливість сайленсингу генів як потенційного терапевтичного факту для ХГ.
Аміотрофічний бічний склероз
Аміотрофічний латеральний склероз (АЛС), який також називають хворобою Лу Геріга, — це захворювання моторних нейронів, що вражає головний і спинний мозок. Захворювання призводить до переродження моторних нейронів, що врешті-решт веде до загибелі нейронів та м'язової дегенерації[33]. Було виявлено, що АЛС можуть спричиняти сотні мутацій гена супероксиддисмутази Cu/Zn (SOD1)[34]. Сайленсинг генів використовували для нокдауну мутованої форми SOD1, характерного для АЛС[35]. Зокрема, молекули siRNA успішно використовуються для націлення на мутантний ген SOD1 та зменшення його експресії за рахунок алель-специфічного сайленсингу гена[36].
Проблеми застосування для терапії
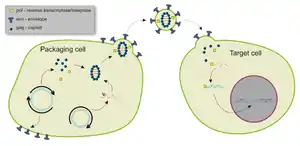
Існує кілька проблем, пов'язаних із терапією на основі сайленсингу генів, включаючи доставку до цільових клітин та їхню специфіку. Наприклад, для лікування нейродегенеративних порушень молекули для сайленсинг-терапії повинні надходити до мозку. Гематоенцефалічний бар'єр ускладнює доставку молекул до мозку через кров, запобігаючи проходженню більшості молекул, які вводяться в кров[30][31]. Таким чином, дослідники виявили, що вони повинні безпосередньо вводити молекули у мозок або застосовувати спеціальні імплантовані помпи.
Див. також
Список літератури
- Redberry, Grace (2006). Gene silencing : new research. New York: Nova Science Publishers. ISBN 9781594548321.
- Gene Silencing. National Center for Biotechnology Information. Процитовано 11 листопада 2013.
- RNAi: What's all the noise about gene silencing?. Environmental Health Perspectives 112 (4): A224–9. March 2004. PMC 1241909. PMID 15033605. doi:10.1289/ehp.112-a224. Проігноровано невідомий параметр
|vauthors=(довідка) - RNA interference: learning gene knock-down from cell physiology. Journal of Translational Medicine 2 (1): 39. November 2004. PMC 534783. PMID 15555080. doi:10.1186/1479-5876-2-39. Проігноровано невідомий параметр
|vauthors=(довідка) - RNA therapeutics: beyond RNA interference and antisense oligonucleotides. Nature Reviews. Drug Discovery 11 (2): 125–40. February 2012. PMC 4743652. PMID 22262036. doi:10.1038/nrd3625. Проігноровано невідомий параметр
|vauthors=(довідка) - Antisense oligonucleotides: basic concepts and mechanisms. Molecular Cancer Therapeutics 1 (5): 347–55. March 2002. PMID 12489851. Проігноровано невідомий параметр
|vauthors=(довідка) - Antisense and RNA interference approaches to target validation in pain research. Current Opinion in Drug Discovery & Development 7 (2): 179–87. March 2004. PMID 15603251. Проігноровано невідомий параметр
|vauthors=(довідка) - Phylactou, L. (1 вересня 1998). Ribozymes as therapeutic tools for genetic disease. Human Molecular Genetics 7 (10): 1649–1653. PMID 9735387. doi:10.1093/hmg/7.10.1649.
- Sidney Altman--Nobel laureate for work with RNA. Mayo Clinic Proceedings 87 (10): e73. October 2012. PMC 3498233. PMID 23036683. doi:10.1016/j.mayocp.2012.01.022. Проігноровано невідомий параметр
|vauthors=(довідка) - Stable expression of small interfering RNA sensitizes TEL-PDGFbetaR to inhibition with imatinib or rapamycin. The Journal of Clinical Investigation 113 (12): 1784–91. June 2004. PMC 420507. PMID 15199413. doi:10.1172/JCI20673. Проігноровано невідомий параметр
|vauthors=(довідка) - Synthetic small inhibiting RNAs: efficient tools to inactivate oncogenic mutations and restore p53 pathways. Proceedings of the National Academy of Sciences of the United States of America 99 (23): 14849–54. November 2002. Bibcode:2002PNAS...9914849M. PMC 137507. PMID 12403821. doi:10.1073/pnas.222406899. Проігноровано невідомий параметр
|vauthors=(довідка) - Antiviral effects of human immunodeficiency virus type 1-specific small interfering RNAs against targets conserved in select neurotropic viral strains. Journal of Virology 78 (24): 13687–96. December 2004. PMC 533941. PMID 15564478. doi:10.1128/JVI.78.24.13687-13696.2004. Проігноровано невідомий параметр
|vauthors=(довідка) - RNA interference blocks gene expression and RNA synthesis from hepatitis C replicons propagated in human liver cells. Proceedings of the National Academy of Sciences of the United States of America 100 (5): 2783–8. March 2003. Bibcode:2003PNAS..100.2783W. PMC 151418. PMID 12594341. doi:10.1073/pnas.252758799. Проігноровано невідомий параметр
|vauthors=(довідка) - Inhibiting HIV-1 infection in human T cells by lentiviral-mediated delivery of small interfering RNA against CCR5. Proceedings of the National Academy of Sciences of the United States of America 100 (1): 183–8. January 2003. Bibcode:2002PNAS..100..183Q. PMC 140921. PMID 12518064. doi:10.1073/pnas.232688199. Проігноровано невідомий параметр
|vauthors=(довідка) - Inhibition of HIV-1 infection by lentiviral vectors expressing Pol III-promoted anti-HIV RNAs. Molecular Therapy 8 (2): 196–206. August 2003. PMID 12907142. doi:10.1016/s1525-0016(03)00165-5. Проігноровано невідомий параметр
|vauthors=(довідка) - Small interfering RNA inhibits hepatitis B virus replication in mice. Molecular Therapy 8 (5): 769–76. November 2003. PMID 14599810. doi:10.1016/s1525-0016(03)00244-2. Проігноровано невідомий параметр
|vauthors=(довідка) - Clearance of replicating hepatitis C virus replicon RNAs in cell culture by small interfering RNAs. Proceedings of the National Academy of Sciences of the United States of America 100 (1): 235–40. January 2003. Bibcode:2002PNAS..100..235R. PMC 140937. PMID 12518066. doi:10.1073/pnas.0235524100. Проігноровано невідомий параметр
|vauthors=(довідка) - Interfering with hepatitis C virus RNA replication. Virus Research 102 (1): 19–25. June 2004. PMID 15068876. doi:10.1016/j.virusres.2004.01.011. Проігноровано невідомий параметр
|vauthors=(довідка) - Interfering with disease: opportunities and roadblocks to harnessing RNA interference. Trends in Molecular Medicine 9 (9): 397–403. September 2003. PMC 7128953. PMID 13129706. doi:10.1016/s1471-4914(03)00143-6. Проігноровано невідомий параметр
|vauthors=(довідка) - RNA interference: from gene silencing to gene-specific therapeutics. Pharmacology & Therapeutics 107 (2): 222–39. August 2005. PMC 7112686. PMID 15908010. doi:10.1016/j.pharmthera.2005.03.004. Проігноровано невідомий параметр
|vauthors=(довідка) - Systemic delivery of synthetic siRNAs. RNA Therapeutics. Methods in Molecular Biology 629. 2010. с. 87–91. ISBN 978-1-60761-656-6. PMID 20387144. doi:10.1007/978-1-60761-657-3_6.
- Pseudomonas invasion of type I pneumocytes is dependent on the expression and phosphorylation of caveolin-2. The Journal of Biological Chemistry 280 (6): 4864–72. February 2005. PMID 15545264. doi:10.1074/jbc.M411702200. Проігноровано невідомий параметр
|vauthors=(довідка) - A review of antisense therapeutic interventions for molecular biological targets in asthma. Biologics 1 (3): 271–83. September 2007. PMC 2721314. PMID 19707336. Проігноровано невідомий параметр
|vauthors=(довідка) - Determinants of prognosis of COPD in the elderly: mucus hypersecretion, infections, cardiovascular comorbidity. The European Respiratory Journal. Supplement 40: 10s–14s. May 2003. PMID 12762568. doi:10.1183/09031936.03.00403403. Проігноровано невідомий параметр
|vauthors=(довідка) - Cigarette smoke induces MUC5AC mucin overproduction via tumor necrosis factor-alpha-converting enzyme in human airway epithelial (NCI-H292) cells. American Journal of Physiology. Lung Cellular and Molecular Physiology 287 (2): L420–7. August 2004. PMID 15121636. doi:10.1152/ajplung.00019.2004. Проігноровано невідомий параметр
|vauthors=(довідка) - Inflammation and repair processes in chronic obstructive pulmonary disease. American Journal of Respiratory and Critical Care Medicine 160 (5 Pt 2): S12–6. November 1999. PMID 10556162. doi:10.1164/ajrccm.160.supplement_1.5. Проігноровано невідомий параметр
|vauthors=(довідка) - Epithelial cells and fibroblasts: structural repair and remodelling in the airways. Paediatric Respiratory Reviews. 5 Suppl A: S35–40. 2004. PMID 14980241. doi:10.1016/s1526-0542(04)90008-5. Проігноровано невідомий параметр
|vauthors=(довідка) - Pulmonary Fibrosis. Mayo Clinic. Процитовано 13 грудня 2013.
- Molecular mechanisms of antifibrotic effect of interferon gamma in bleomycin-mouse model of lung fibrosis: downregulation of TGF-beta and procollagen I and III gene expression. Experimental Lung Research 21 (5): 791–808. Sep–Oct 1995. PMID 8556994. doi:10.3109/01902149509050842. Проігноровано невідомий параметр
|vauthors=(довідка) - Gene Silencing. HOPES - Huntington's Outreach Project for Education, at Stanford. Stanford University. 5 квітня 2012. Процитовано 13 грудня 2013.
- RNAi-based therapies for Huntington's disease: delivery challenges and opportunities. Therapeutic Delivery 3 (9): 1061–76. September 2012. PMID 23035592. doi:10.4155/tde.12.80. Проігноровано невідомий параметр
|vauthors=(довідка) - Progress and challenges in RNA interference therapy for Huntington disease. Archives of Neurology 66 (8): 933–8. August 2009. PMID 19667213. doi:10.1001/archneurol.2009.180. Проігноровано невідомий параметр
|vauthors=(довідка) - What is ALS?. The ALS Association.
- Double-mismatched siRNAs enhance selective gene silencing of a mutant ALS-causing allele. Acta Pharmacologica Sinica 29 (2): 211–6. February 2008. PMID 18215350. doi:10.1111/j.1745-7254.2008.00740.x. Проігноровано невідомий параметр
|vauthors=(довідка) - Boulis, Nicholas. Gene Therapy for Motor Neuron Disease. Society for Neuroscience. Процитовано 13 грудня 2013.
- Selective silencing by RNAi of a dominant allele that causes amyotrophic lateral sclerosis. Aging Cell 2 (4): 209–17. August 2003. PMID 12934714. doi:10.1046/j.1474-9728.2003.00054.x. Проігноровано невідомий параметр
|vauthors=(довідка) - Petition for Determination of Nonregulated Status: Arctic™ Apple (Malus x domestica) Events GD743 and GS784. United States Department of Agriculture — Animal and Plant Health Inspection Service. Retrieved 2012-08-03.
- Apple-to-apple transformation. Okanagan Specialty Fruits. Архів оригіналу за 25 вересня 2013. Процитовано 3 серпня 2012.
Посилання
- RNAiAtlas — database of siRNA libraries and their target analysis resultsArchived February 10, 2015, at the Wayback Machine.
- Science project: Transgenic apple varieties Approaches to preventing outcrossing — possible effects on micro-organisms
- MeSH Gene+silencing
- Research project: New Cost-effective method for gene silencing
- Assays for gene silencing in yeast. Methods in Enzymology 350. 2002. с. 165–86. ISBN 9780121822538. PMID 12073311. doi:10.1016/S0076-6879(02)50962-9.