Синдром полікістозних яєчників
Синдром полікістозних яєчників (СПКЯ) є ендокринним розладом, що вражає жінок репродуктивного віку. Цей синдром призводить до безпліддя, інсулінорезистентності[1], ожиріння та серцево-судинних проблем та безлічі інших проблем зі здоров'ям. Це полігенний, поліфакторний, системний, запальний, дисрегульований стероїдний стан, аутоімунне захворювання, що проявляється в основному через недосконалості у способі життя.
Це дуже поширений ендокринний розлад, який вражає приблизно 5–10% жінок репродуктивного віку у всьому світі[2]. Деякі дослідження навіть припускають, що СПКЯ може вразити більше 20% жінок репродуктивного віку у всьому світі [3].
Вперше симптоми цієї хвороби були описані Штейном та Левенталем у 1935 р. Спочатку хвороба була названа синдромом Штейна-Левенталя, а пізніше перейменована в СПКЯ у 1960-х[4].
Патогенез та гормональний статус
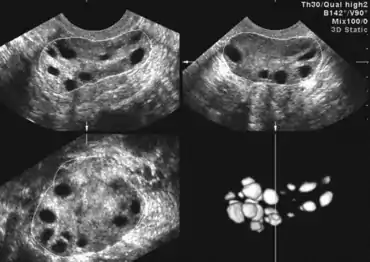
Яєчники при синдромі можуть містити від декілької кіст до більш ніж 20-ти. Коли в фолікулах яєчників утворюються множинні кісти внаслідок гормонального дисбалансу, це характеризується як СПКЯ. Через утримуваних у воді кіст, деякі з яких можуть досягати 10 мм в ширину, розмір яєчника збільшується до 10 см в ширину. Відсутність овуляції і менструального циклу перешкоджає заплідненню і зачаттю, тому вагітність стає важкою.
Кіста -- це заповнений водою мішечок, що містить яйцеклітину, який, як правило, повинен був бути вивантажений для можливого запліднення. Перетворення яйцеклітини в кісту, яку називають «функціональною кістою», запобігає овуляції. Коли овуляція блокується, це призводить до порушення менструального циклу, у крайніх випадках викликаючи аменорею[5].
Навіть якщо відбувається імплантація, зростає ризик переривання вагітності та народження дитини. СПКЯ може спричинити ускладнення, пов’язані з вагітністю, такі як гестаційний діабет, гіпертонія, спричинена вагітністю[6]. Зазвичай клітини тека яєчників забезпечують підтримку зростаючого фолікула, сприяючи генерації зрілих ооцитів. Але ці клітини у хворих на СПКЯ гіперчутливо реагують на стимулюючу дію інсуліну, тому вони розмножуються, викликаючи гіпертекоз яєчників. Інсулінорезистентність посилює андрогенний потенціал у клітинах тека, посилюючи СПКЯ. Крім того, висока чутливість клітин теки до стимуляції гонадальних стероїдів гонадотропіном сприяє андрогенності при СПКЯ.
При СПКЯ порушується пульсуюча секреція гонадотропін-рилізинг-гормону з гіпоталамуса, що є ще одни фундаментальним фактором, характеринм СПКЯ. Гонадотропін-рилізинг-гормон спонукає гіпофіз виділяти фолікулостимулюючий гормон та лютеїнізуючий гормон, які необхідні для обидвох фаз менструального циклу. Оскільки цих гормонів значно менше, яйцеклітина або не утворюється, або не може звільнитися від фолікула. Тяжкі порушення циклу виникають аменорею, яка може бути двох типів: первинна або вторинна аменорея. У той час як первинна аменорея - це нездатність досягти менархе через хромосомні або анатомічні проблеми, вторинна аменорея, також звана гіпоталамічною аменореєю, характеризується відсутністю менструальних циклів протягом 3 і більше місяців поспіль. Високий рівень пептидного гормону пролактину блокує гонадотропін-рилізинг-гормон.
Оскільки людський організм є складною системою, а метаболіти функціонально взаємопов’язані, порушення в одних може вплинути і на інші. Порушення рівня низки гормонів (пролактин, антимюлерівський гормон, кортизол, андроген), нейромедіаторів (дофамін), пептидів, ліпідів, білків та глюкози пов'язані з проявом СПКЯ. Гіперпролактинемія викликає гіпогонадотропний гіпогонадизм, що характеризується аменореєю, галактореєю (ненормальне вироблення молока з грудей) та остеопорозом[7]. Зазвичай після пологів пролактин стимулює вироблення молока альвеолярними клітинами в грудях. Пролактинома гіпофіза є однією з причин високого рівня пролактину.
Гормон ХГЧ (хоріонічний гонадотропін людини) призводить до того, що яєчник зазнає значної лютеїнізації, викликаючи виділення надлишку естрогенів, прогестерону та місцевих цитокінів. Ендотеліальний фактор росту судин - речовина, що індукує гіперпроникність судин, він спонукає ХГЧ збільшувати проникність капілярів при СГЯ. СПКЯ робить жінку сприйнятливою до СГЯ.
Симптоматика
Однак симптоми СПКЯ можна розглядати як спектр, оскільки його прояви різняться залежно від конституції окремих жінок та навіть расової належності.
Деякі з кист продукують андрогени, що призводить до проявлення чоловічих ознак у жінок, аж до гіперандрогенії. Видимі ознаки гіперандрогенії включають збільшення ваги, абдомінального та підшкірного жиру, гірсутизм, алопеція (випадання волосся) за чоловічим типом, кліторомегалія, глибокий голос, себорея (жирна шкіра), вугрі тощо. Окрім цих морфологічних особливостей, відбувається зміна метаболічного профілю.
Пацієнтки часто відчувають абдомінальний біль, лихоманку, нудоту, блювоту, сечовипускання, запор тощо. Притискання великих кіст до сечового міхура або прямої кишки відповідає за аномальний рух сечі та мисок.
- Інсулінорезистентність є основним симптомом СПКЯ. Це призводить до гіперінсулінемії та може призвести до цукрового діабету. Високий рівень інсуліну відповідає за відкладення жиру навколо живота або центральне ожиріння. У більшості жінок з СПКЯ індекс маси тіла становить 30 і вище. У пацієнток часто спостерігається тяга до цукру, часте сечовипускання, затримка загоєння, втома, затуманення зору, відчуття поколювання, епізоди зміни настрою, тривоги та депресії. Ці стани також пов’язані з діабетом. Через гормональний дисбаланс при СПКЯ на шкірі з’являються світло-коричневі або чорні плями - стан, відомий як „acanthosis nigricans“. Шкіра шиї, пахв, стегон і грудей більш схильна до цієї пігментації шкіри. Насправді темна пігментація є шкірним маркером стійкості до інсуліну.
- Гірсутизм слабкий або відсутній у жінок СПКЯ південноазіатського та скандинавського походження, оскільки чутливість до андрогенів сальних залоз відрізняється, але пацієнтки з СПКЯ на Близькому Сході та Середземномор’ї більше страждають від гірсутизму.
- Гіпертонія та серцево-судинні проблеми тощо є супутніми захворюваннями СПКЯ. Здоровий артеріальний тиск у жінок становить 120 більше 80 і менше. Хворі на СПКЯ мають високий ризик розвитку серцево-судинних захворювань раннього генезу.
- Апное[8] сну (розлад сну, при якому дихання неодноразово зупиняється і починається) - ще один симптом СПКЯ, що виникає через змінений рівень статевих стероїдів.
- Метаболічний синдром, спричинений СПКЯ, величезний. Насправді патології є двосторонніми, оскільки метаболічний синдром і постійні запалення можуть призвести до СПКЯ. На основі доказів простежено зв'язок між неалкогольною жировою хворобою печінки, хронічною хворобою печінки, що характеризується ураженням печінки внаслідок інфільтрації жирової печінки, що веде до кінцевої стадії захворювання печінки, та СПКЯ, що вказує на нову гепатооваріальну вісь.
СПКЯ може поставити жінку на ризик раку матки, оскільки переважаючий високий рівень естрадіолу та відсутність прогестерону через неправильну роботу яєчників збільшує ризик гіперплазії ендометрію. Ендоцервікс із дефіцитом слизу та гладкою піхвою є особливістю СПКЯ, яку можна спостерігати під час огляду тазу.
Терапія
Терапевтичні варіанти СПКЯ варіюються від фармакологічних до хірургічних.
Кісти СПКЯ - це функціональні кісти, які можуть розсмоктуватися самостійно. Але деякі кісти можуть лопнути і кровоточити, що призведе до раптового сильного болю внизу живота
СПКЯ корегується тільки за умови зміни способу життя: хоч у разі оперативного втручання і відновлення після нього, як і у випадку комплексної терапії.
Приблизно 60–80% пацієнток із СПКЯ мають резистентність до інсуліну, а приблизно 95% пацієнтів із ожирінням мають резистентність до інсуліну, підвищений ризик серцево-судинних захворювань та діабету 2 типу. Модифікація способу життя вважається лікуванням першочерговим, незалежно від вимог народження.
Рекомендовано пацієнтам із СПКЯ із надмірною вагою контролювати свій раціон, тобто споживати 1200–1500 ккал/день, і забезпечити, щоб вони брали участь у помірних фізичних навантаженнях принаймні 30 хв на день принаймні п’ять днів на тиждень. Обмежуючи споживання калорій, займаючись фізичними вправами, звертаючись до поведінки, отримуючи медикаментозне лікування, отримуючи хірургічне лікування ожиріння для зниження ІМТ до нормального діапазону та відмовляючись від куріння та пиття, пацієнти можуть покращити резистентність до інсуліну та рівень вільного тестостерону, а також зменшити порушення менструального циклу, надлишковий ріст волосся, вугрі та інші симптоми[9].
Рандомізоване порівняння впливу режиму харчування та/або фізичних вправ на функцію яєчників та метаболічні показники у жінок із зайвою вагою. Через чотири місяці автори виявили, що індекс маси тіла був знижений на 6% за допомогою дієти, 3% за допомогою фізичних вправ та 5% від комбінованих втручань. Крім того, рівень тестостерону в сироватці крові знизився, а рівень глобуліну, що зв’язує статеві гормони (ГСГБ), підвищився, і 30 пацієнтів (69%) відновили менструальний цикл. Ці результати свідчать про те, що дієтичне управління та фізичні вправи, як окремо, так і в поєднанні, однаково ефективні для покращення репродуктивної функції у жінок із надмірною вагою/ожирінням із СПКЯ.
Було проведено мета-аналіз дев'яти досліджень, в яких було залучено 583 жінки з ожирінням, які страждають на СПКЯ, і зазначив, що поєднання дієти та ЛФК може зменшити ІМТ та рівень глюкози в крові натще і покращити резистентність до інсуліну. Кілька моніторингових досліджень показали, що у пацієнтів із СПКЯ, які знижують ІМТ до вагітності, спостерігається підвищений рівень вагітності та показник живонародженості. Зменшення ІМТ за допомогою ЗСЖ також зменшує несприятливі наслідки ожиріння, такі як діабет, високий кров'яний тиск, високий вміст жиру в крові, серцево-судинні захворювання та рак ендометрія.
Ладсон та ін. провели подвійне сліпе рандомізоване контрольоване дослідження, порівнюючи лише ЗСЖ із ЗСЖ плюс метформін у 114 пацієнтів із СПКЯ, і не виявили різниці у середньому зниженні ваги, рівні овуляції або рівнях андрогену через шість місяців. Цей висновок вказує на те, що додавання метформіну до ЗСЖ не призводить до додаткової втрати ваги. Однак останніми роками, з поглибленням генетичних досліджень, нове дослідження показало, що мутація багатьох генів хромосомних локусів, включаючи 8p23.1, 11p14.1 та 9p22.32, тісно пов'язана із виникненням СПКЯ і зазначило, ІМТ мав мінімальний вплив на результати, що вимагало додаткових тривалих спостережень та досліджень.
Метформін [10]
Є сенсибілізатором інсуліну і може покращити якість життя жінок за рахунок зниження підвищених показників, таких як інсулін, андрогени, одночасно підвищуючи рівень глобуліну, що зв’язує статеві гормони та білку, що зв’язує фактор росту інсуліну. Метформін діє на адипоцитокіни, ангіогенні білки та метаболічні регулятори такі як адипонектин, лептин. Крім того, цей препарат знижує гіперреактивність тромбоцитів у хворих на СПКЯ, покращуючи цілісність мітохондрій.
Екзенатид та ліраглутид (агоністи рецепторів глюкагоноподібного пептиду-1), як монотерапія, так і в комбінації з метформіном, можуть зменшити вагу пацієнтки при СПКЯ. Комбінована терапія з ексенатидом та метформіном покращувала менструальну циклічність, метаболічні профілі гормональних показників та маркери запалення у жінок із надмірною вагою, інсулінорезистентних олігоовуляторних препаратів із СПКЯ.
Оральні контрацептиви (ОК)
ОК прийняті протягом довгострокових періодів від 6 місяців, є першочерговим методом лікування СПКЯ. Прийом покращує гіперандрогенні прояви та регулюють менструальний цикл, пригнічуючи овуляцію та запобігаючи утворенню кісти. Ці таблетки в основному складаються з естрогенів та прогестеронів. Естроген пригнічує утворення та дозрівання фолікулів яєчників, пригнічуючи ФСГ та прогестерон, що не тільки пригнічує овуляцію, пригнічуючи ЛГ, але також збільшує в’язкість цервікального слизу та перешкоджає проникненню та заплідненню яйцеклітини сперматозоїдів[11]. У той же час ОК можуть збільшувати концентрацію глобуліну, що зв’язує статеві гормони, тим самим знижуючи рівень вільного тестостерону, зменшуючи периферичну роль андрогенів і дозволяючи відбуватися депривації андрогенів.
ОК-терапія може відновити менструальний цикл, захистити від небажаної вагітності та захистити ендометрій, що запобігає ризику раку ендометрію.Однак прийом створює ризик тромбозу вен. Крім того, він знижує рівень 25-гідроксивітаміну D в сироватці крові, що може вплинути на здоров’я кісток[12].
Інозитол
Останні три роки вивчається терапія інозитолами[13].
Міо-інозитол (МІ) і D-хіро-інозитол (ДХІ) є вторинними сигналізаторами інсуліну, МІ бере участь у фолікулярних шляхах гонадотропіну, які організовують овуляцію. У яєчниках співвідношення МІ/ДХІ становить 100: 1, але різко знижується за рахунок інсуліно-стимульованої епімерази у гіперінсулінемічних жінок із синдромом полікістозних яєчників (СПКЯ).
Інозитоли довели свою ефективність при СПКЯ, покращуючи метаболічний та гормональний стан та відновлюючи спонтанну овуляцію. У допоміжній репродуктивній технології інозитол покращував параметри стимуляції яєчників, хоча дані щодо результатів фертильності суперечливі. Враховуючи свої функції, інозитоли є привабливим варіантом лікування СПКЯ, хоча потрібні більш детальні дослідження щодо спонтанної та неспонтанної фертильності. В яєчниках ІМ є одним з сигналізаторів фолікулостимулюючого гормону та лютеїнізуючого гормону, шляхи яких дуже складні та нелінійні.
Домінуючим шляхом ФСГ є опосередкований цАМФ протеїнкіназою А шлях, що призводить до стероїдогенезу, де індукція ароматази вважається головним ефектом[14]. Цей подвійний механізм сигналізації впливає на овуляцію. З одного боку, стимуляція рецептора ФСГ у ранній фолікулярній фазі активує шлях цАМФ, який при високій концентрації підтримує ооцит у профазі 1 та стимулює проліферацію та ріст клітин гранульози. З іншого боку, модуляція концентрації рецепторів ФСГ у домінантному фолікулі та овуляторний приплив ЛГ активують шлях ІМ. Зміна цАМФ та підвищена концентрація кальцію сприяють відновленню мейозу та вивільненню зрілого ооцита.
Похідні ІМ, здається, беруть участь у регуляції цитоскелету і необхідні для прискорення яйцепровідного транспорту. Сигналізація ІМ може регулювати рівень вироблення антимюлерівського гормону, індукованого ФСГ, у клітинах гранульози. АМН, зменшуючи чутливість ооцитів до ФСГ, бере участь у регулюванні дозрівання фолікулів.
МІ та ДХІ є привабливим варіантом лікування цього складного синдрому завдяки їх здатності модулювати дію інсуліну та організувати функцію ооцитів і яєчників. МІ та ДХІ, особливо у поєднанні у фізіологічному співвідношенні 40: 1, дійсно можуть бути ефективними методами лікування жінок СПКЯ.
Примітки
- Синдром поликистозных яичников. Википедия (рос.). 17 березня 2020. Процитовано 7 червня 2021.
- Norman RJ, Dewailly D, Legro RS, Hickey TE (2007). Polycystic ovary syndrome. Lancet. с. 370:685–97.
- Azziz R, Woods KS, Reyna R. (2004). The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol. с. 89:2745–9.
- Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril 2004;81:19–25.
- Patel, S (2018). Polycystic ovary syndrome (PCOS), an inflammatory, systemic, lifestyle endocrinopathy. Journal of Steroid Biochemistry and Molecular Biology.
- R. Homburg (2008). Pregnancy complications in PCOS, in: diagnosis manag, Polycyst. Ovary Syndrome. с. 135–142.
- A. Capozzi, G. Scambia, A. Pontecorvi, S. Lello (2015). Нyperprolactinemia: pathophysiology and therapeutic approach. Gynecol. Endocrinol. с. 506–510.
- E. Tasali, E. Van Cauter, D.A. Ehrmann (2008). Polycystic ovary syndrome and obstructive sleep apnea. Sleep Med. Clin. с. 37–46. ISBN http://dx.doi.org/10.1016/j.jsmc.2007.11.001. Перевірте значення
|isbn=(довідка). - Peipei Jin & Yongyong Xie (2017). Treatment strategies for women with polycystic ovary syndrome. Gynecological Endocrinology. ISBN https://doi.org/10.1080/09513590.2017.1395841 Перевірте значення
|isbn=(довідка). - Polycystic ovary syndrome. Wikipedia (англ.). 22 травня 2021. Процитовано 7 червня 2021.
- Sitruk-Ware R, Nath A. (2013). Characteristics and metabolic effects of estrogen and progestins contained in oral contraceptive pills. Best Pract Res Clin Endocrinol Metab. с. 27:13–24. 23.
- Skowro�nska P, Pastuszek E, Kuczy�nski W, et al. (2016). The role of vitamin D in reproductive dysfunction in women – a systematic review. Ann Agric Environ Med. с. 23:671–6.
- Antonio Simone Laganà ,1,3,* Simone Garzon,2,3 Jvan Casarin,1 Massimo Franchi,2 and
Fabio Ghezzi1 (2018). Inositol in Polycystic Ovary Syndrome: Restoring Fertility through a Pathophysiology- Based Approach. ISBN https://doi.org/10.1016/j.tem.2018.09.001 Перевірте значення
|isbn=(довідка). - Milewska, E.M. et al. (2016). (2016) Inositol and human reproduction: From cellular metabolism to clinical use. Gynecol. Endocrinol. с. 32, 690–695.
